壁材对真空低温喷雾干燥制备乳双歧杆菌Probio-M8微胶囊的影响
郭 帅,卢家君,孟和毕力格
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室 呼和浩特 010018)
益生菌是在适当剂量下给宿主带来健康好处的活的微生物[1]。典型的益生菌为乳酸杆菌和双歧杆菌。近年来,人们对益生菌的研究逐年增加,其中双歧杆菌是益生菌领域的一个重要研究方向[2]。本研究所用菌株——乳双歧杆菌Probio-M8 是从中国健康妇女母乳中分离得到的一株具有潜在益生特性的双歧杆菌,具有治疗便秘和腹泻,抑制幽门螺杆菌生长,缓解和治疗冠心病,缓解哮喘,缓解或治疗旅行性腹泻等益生功效[3-7]。然而,益生菌存活率较低,如何有效提高益生菌的存活率问题是目前研究人员面临的巨大挑战。
胶囊化被定义为将活性物质包裹在淀粉、蛋白质或脂质载体基质中的过程[8-9],是保护益生菌免受恶劣条件影响的一种强有力的方法[10-11]。在微胶囊化方法中,喷雾干燥是益生菌微胶囊化最古老和最常用的技术之一。国外学者Maciel 等[12]通过研究发现,喷雾干燥过程中,通常可通过添加特定的组分来增强细胞保护,脱脂乳粉中含有的乳糖及乳蛋白在乳酸菌喷雾干燥过程中发挥了主要的保护作用,可以防止干燥过程中水分散失导致的细胞膜泄露。此外,脱脂乳中的蛋白质可以通过稳定细胞膜成分来防止细胞损伤,当与乳钙相互作用时,它们可以在细菌细胞壁上形成保护涂层[13]。谷氨酸钠作为重要壁材,主要是通过其氨基和微生物蛋白质的羧基之间的反应来稳定蛋白质结构[14]。麦芽糊精为高分子化合物,具有良好的乳化特性及成膜特性,干燥过程中在菌体表面形成保护层,可以减少细胞与氧气的接触面积以及因细胞壁损坏而造成的胞内物质外泄[15]。先前的研究报道了单一保护剂并不能满足菌体抵抗外界恶劣环境所需的条件,而在复合保护剂中,由于各种保护剂成分的在干燥过程中具有附加或协同保护作用,因此比单一成分能更好地保护微生物[16-17]。
本试验的主要目的是评价不同壁材对真空低温喷雾干燥技术制备乳双歧杆菌Probio-M8 微胶囊的影响,通过对微胶囊粉的一些物理性质的测定,以及对细胞膜完整性的、玻璃化转变温度和抗氧化能力的研究,选择一种适合于真空低温喷雾干燥制备乳双歧杆菌Probio-M8 微胶囊的壁材,为乳双歧杆菌Probio-M8 的工业化生产奠定基础。
1 材料与方法
1.1 菌种
供试菌株乳双歧杆菌Probio-M8(Probio-M8)由内蒙古农业大学乳酸菌菌种资源库(Lactic acid bacteria collection center,LABCC)提供。
1.2 试剂与仪器
改良MRS 培养基 (MRS 培养基+0.50 g/L 的L-半胱氨酸盐酸盐) 购自英国Oxoid 公司;脱脂乳、麦芽糊精、谷氨酸钠、荧光染料LIVE/DEAD 细菌细胞活性测定试剂盒L7012,美国Invitrogen 公司。
YC-2000 真空低温喷雾干燥机,上海雅程仪器设备有限公司;TM4000PLUS 扫描电镜,日本株式会社日立高新技术那珂事业所;DSC25 型差示扫描量热仪,美国TA 公司;Synergy H1 酶标仪,美国BioTek 公司;DM4000B 正置荧光显微镜,德国Leica 公司;HD-3A 型智能水分活度测量仪,无锡市华科仪器仪表有限责任公司;水分测定仪,上海奥豪斯仪器有限公司。
1.3 方法
1.3.1 菌种活化培养、收集 将冷冻保存(-80℃)的Probio-M8 菌种接入已灭菌的改良MRS 液体培养基中,于37 ℃厌氧条件下培养24 h,再以2%的量接入到已灭菌的改良MRS 培养基中厌氧培养24 h,连续活化3 代,获得处于稳定期的Probio-M8,再将菌液以4 500×g、4 ℃离心15 min,用PBS 清洗2 次,弃上清,收集菌泥。
1.3.2 喷雾干燥 前期试验已经完成对5 种壁材(脱脂乳、麦芽糊精、谷氨酸钠、海藻糖、阿拉伯胶)制备乳双歧杆菌Probio-M8 微胶囊的优化,发现单一保护壁材脱脂乳、麦芽糊精、谷氨酸钠保护效果优于海藻糖和阿拉伯胶,脱脂乳、麦芽糊精、谷氨酸钠质量分数均为10%时保护效果较好,复合保护壁材为脱脂乳质量分数为13%、麦芽糊精为10%、谷氨酸钠7%时保护效果最好。因此本试验选取这4 种保护壁材进行喷雾干燥,喷雾干燥条件如表1。

表1 真空低温喷雾干燥条件Table 1 Vacuum low temperature spray drying conditions
1.3.3 活菌计数及存活率计算 以改良MRS 琼脂培养基为计数培养基,采用稀释平板菌落计数法。菌体存活率计算公式:
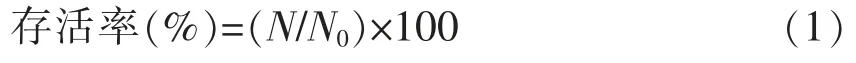
式中,N——干燥后样品单位体积活菌数,CFU/g;N0——干燥前样品单位体积活菌数,CFU/g。
1.3.4 微胶囊粉末的物理性质
1.3.4.1 水分含量及水分活度的测定 取3~5 g微胶囊粉剂,使用全自动水分测定仪测定微胶囊粉剂水分含量。利用智能水分活度仪测量样品的水分活度,具体操作为:取适量脱脂乳均匀铺平托盘,测定并预热,然后称取适量样品,均匀铺平托盘并进行测定。
1.3.4.2 微胶囊粉末的松密度和振实密度 根据Yoha 等[18]描述的方法测定松密度(ρL)和振实密度(ρT)。振实密度是将约2 g 益生菌粉末倒入空的10 mL 量筒中,将样品重量m(kg)除以量筒中测量的体积VL(m3)计算得到松密度。振实密度是通过将量筒中的样品轻敲200 次以达到恒定体积,将样品质量m 除以量筒中测量的体积VT计算得到振实密度。计算公式如(2)和(3):

微胶囊粉末的流动性由松密度和振实密度使用公式(4)和(5)计算:

式中,HR——豪斯纳比;CI——卡尔指数,%。
1.3.4.3 溶解度 微胶囊粉的溶解度根据Seth等[19]描述的方法进行估算。取2 g 样品分别溶于50 mL 水中并完全溶解,然后以3 000 r/min、4 ℃下离心5 min,将上清液转移到培养皿中并称重。此外,上清液置于105 ℃的热空气烘箱中完全干燥,然后称重。根据质量差异计算每个样品的溶解度。
1.3.4.4 再水合时间 根据Lavanya 等[20]的方法分析微胶囊粉的复水能力。将2 g 样品加入50 mL双蒸水中,并在室温下使用磁力搅拌器搅拌。记录完全再水化所需的时间。
1.3.5 细胞膜完整性 本试验用荧光染料LIVE/DEAD 细菌细胞活性测定试剂盒L7012 对菌细胞染色,用来表征不同保护壁材对Probio-M8 菌体细胞膜完整度的影响。具体操作如下:分别取1.5 μL PI 工作液和SYTO 9 工作液加入到1 mL 菌悬液中,振荡混匀后室温下避光孵育15 min,孵育完成后,取2 μL 处理后的待测样品滴加到载玻片上,在荧光显微镜下观察。
1.3.6 形态特征观察 取少许微胶囊粉均匀的涂抹于置于黏有导电的胶性物质样品台上,吹去多余的胶囊微粒,然后在镀金机中镀金,再将制备好的样品置于扫描电镜下,设置电压为15 kV,通过调节探头与样品之间的距离,并选取合适的放大倍数来获取样品的扫描电子显微镜图像。
1.3.7 玻璃化转变温度 准确称取5 mg 微胶囊粉,并将其密封置于差示扫描量热仪(DSC)专用铝盘中,并采用空铝盒作为对照,随后放入DSC中,并另取一空铝盘作为对照。设置温度范围为-40 ℃至100 ℃进行程序升温,升温速率为10 ℃/min,获得样品的热性质曲线。
1.3.8 抗氧化能力
1.3.8.1 总抗氧化能力的测定 用总抗氧化能力测定试剂盒对Probio-M8 干燥后样品的羟自由基清除能力进行3 次重复测定。
1.3.8.2 1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除能力的测定 首先用95%的乙醇将DPPH粉配置成0.1 mmol/L 溶液,然后取2 mL 待测样品,加入8 mL 的DPPH 溶液作为试验组,并在2 mL 95%乙醇溶液中加入8 mL 的DPPH 溶液作为对照组,再将2 mL 待测样品与8 mL 乙醇溶剂混合作为空白组,以消除样品本身和乙醇混合产生的误差。试验组、空白组及对照组置于无光处静置30 min,于波长517 nm 处测定吸光度。
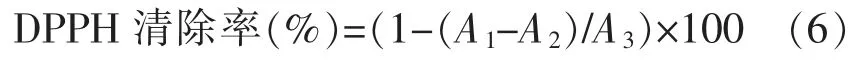
式中,A1——试验组吸光度值;A2——空白组吸光度值;A3——对照组吸光度值。
2 结果与分析
2.1 Probio-M8 微胶囊存活率
图1为脱脂乳、麦芽糊精、谷氨酸钠、复合壁材4 种壁材对Probio-M8 的保护效果。由图可知,以脱脂乳、麦芽糊精、谷氨酸钠、复合壁材为壁材的微胶囊存活率分别为68.85%,68.62%,67.46%和73.8%。其中以复合壁材为壁材的微胶囊存活率显著高于其它3 组(P<0.05),说明不同种类的壁材组合对Probio-M8 微胶囊存活率有较好的保护作用。其次为以脱脂乳为壁材的微胶囊,脱脂乳在喷雾干燥过程中保护细胞活力的有效性与乳糖和乳蛋白的存在有关,乳糖和乳蛋白可能与益生菌的细胞膜相互作用,防止膜在脱水过程中破裂。使用不同的微胶囊壁材会影响益生菌细胞的生存能力,这与Pinto 等[21]的研究一致。
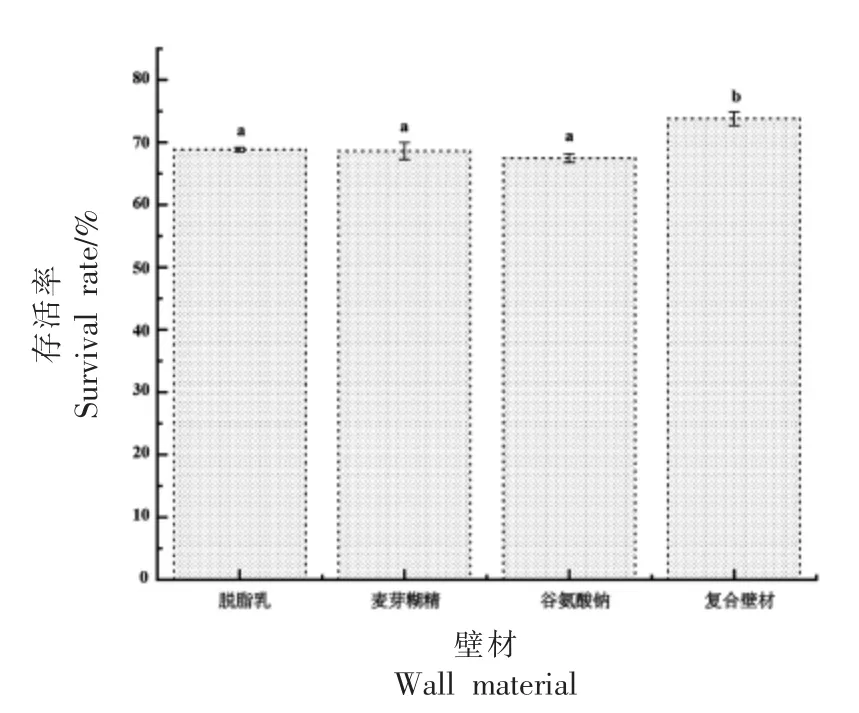
图1 不同壁材对Probio-M8 微胶囊粉末存活率的影响Fig.1 Effects of different wall materials on the survival rate of Probio-M8 microcapsules powders
2.2 水分含量及水分活度
水分活度和含水量是衡量喷雾干燥微胶囊性能的重要理化性质。有研究表明,水分含量强烈影响产品的稳定性和益生菌在储存过程中的生存能力,高水分活度表明食物系统中有更多的游离水可供生化反应进行,从而导致保质期缩短[22-23]。表2给出了不同保护壁材的微胶囊粉末的平均含水量值及水分活度值,分别在4.65%~6.10%和0.17~0.20 之间变化,谷氨酸钠能与水密切作用,所以谷氨酸钠作为壁材的微胶囊粉水分含量最高[24]。一般来说,干燥产品的水分含量和水分活度越低,其稳定性越好,然而对于益生菌产品,过低的水分含量(<2%)和水分活度(<0.1)会影响细胞膜性质,从而抑制细胞代谢,这反过来会降低储存期间的细胞存活力[25]。据报道,微胶囊的水分含量和水分活度分别为5%和0.3 左右时具有良好的储存稳定性[26]。综上,壁材为脱脂乳、麦芽糊精以及复合壁材的微胶囊粉均保持了适当的水分和水分活度。

表2 Probio-M8 微胶囊粉末的水分含量及水分活度Table 2 Moisture content and water activityof Probio-M8 microcapsules powders
2.3 微胶囊粉末的流动性
豪斯纳比(HR)和卡尔指数(CI)可以解释微胶囊粉末流动性[27],对于干燥粉末来说,HR 和CI值越低,粉末流动性越好,以获得更好的流动性来延长其保存期。图2显示了真空低温喷雾干燥下不同保护壁材微胶囊的的流动特性,通过对4 种保护壁材进行比较后发现,复合壁材、脱脂乳、谷氨酸钠和麦芽糊精的作为壁材微胶囊粉HR 值分别为1.56,1.84,2.01,1.99。4 种微胶囊粉对应的CI 值分别为36.24%,45.28%,49.66%,49.55%。以复合壁材为壁材的微胶囊粉表现出较小的HR 和CI 值,说明将不同保护壁材按一定比例混合作为复合保护壁材表现出优异的流动性。
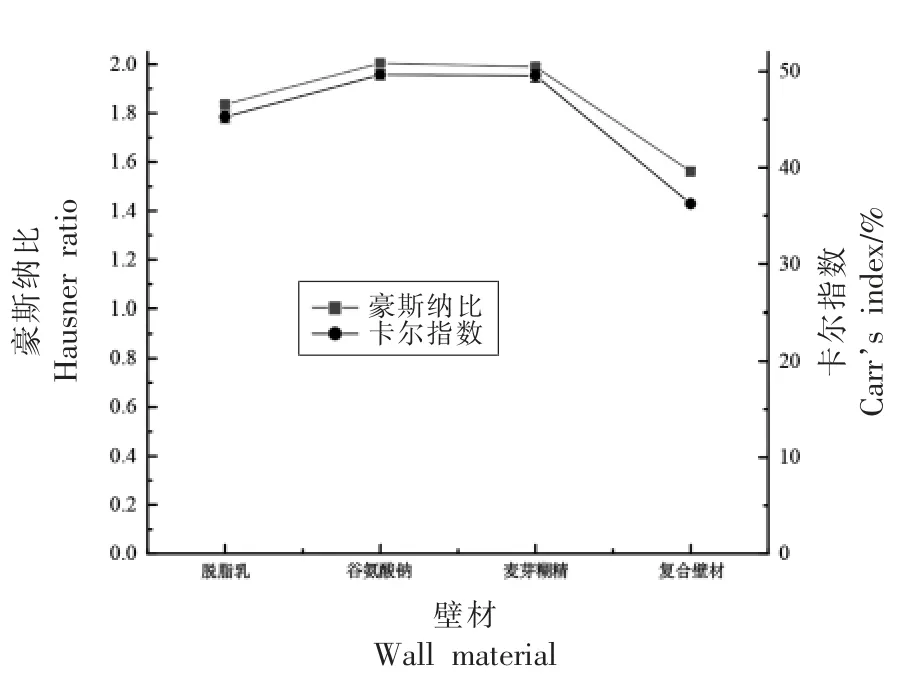
图2 不同Probio-M8 微胶囊粉豪斯纳比和卡尔指数Fig.2 Hausner ratio and Carr’s index of different Probio-M8 microcapsule powders
2.4 微胶囊粉末的溶解度和再水合时间
由图3可知,复合壁材、脱脂乳、谷氨酸钠和麦芽糊精的微胶囊粉溶解度分别是78.75%,90.85%,91.50%,91.75%,4 种壁材对应的微胶囊粉的再水合时间分别为78.9,75.3,42,62.4 s。复合壁材的微胶囊粉溶解度显著低于其它3 种保护壁材的微胶囊粉(P<0.05),其它3 种保护壁材的微胶囊粉的溶解度之间无显著差异(P>0.05)。再水合能力与溶解度成正比,溶解度增加需要更少的时间来启动表面再水合。因此,复合壁材的微胶囊粉再水合时间也高于以谷氨酸钠和麦芽糊精为壁材的微胶囊粉(P<0.05),然而和以脱脂乳粉为壁材的微胶囊粉之间无显著差异(P>0.05),这可能是由于复合壁材是一种复合型保护剂,物质组成较为复杂,从而降低了微胶囊粉的溶解度和再水合能力。

图3 不同Probio-M8 微胶囊粉溶解度和再水合时间Fig.3 The solubility and rehydration time of different Probio-M8 microcapsule powder
2.5 细胞膜完整性
细胞膜的完整性是维持细胞存活和代谢活性的关键因素[28],对抵抗外界不良环境发挥着至关重要的作用。本试验用SYTO 9 和碘化丙锭(PI)两种不同的核酸染色剂来区分活细胞和死细胞,SYTO 9 是膜可渗透的,通常会对群体中的所有细胞进行染色,菌体呈现绿色荧光,而PI 只能进入膜受损的细胞菌体呈现红色[29]。本试验采用SYTO 9 和PI 染料对真空低温喷雾干燥得到的4种不同壁材微胶囊的菌体细胞膜完整性进行测定,结果如图4所示。
正如Gong 等[30]所报道,喷雾干燥过程会对细菌细胞膜的完整性产生不利的影响。Arepally 等[31]也通过研究发现,在喷雾干燥过程中,益生菌细胞会受热和脱水,导致膜损坏,甚至失活。图4显示出的发出红色荧光的菌体即为细胞膜受损导致失活的菌体。此外,不同的包埋壁材对菌体有不同的保护效果。以脱脂乳、麦芽糊精、复合壁材为保护壁材的微胶囊,发出红色荧光的菌体明显少于以谷氨酸钠为保护壁材的微胶囊,说明以脱脂乳、麦芽糊精、复合壁材为保护壁材对菌体细胞膜完整性有较好的保护作用,以复合壁材为保护壁材的微胶囊菌体密度相较于其它3 组的菌体密度较大,而红色荧光有所减少,说明复合壁材对细胞膜完整性有更好的保护作用。

图4 壁材对喷雾干燥后Probio-M8 细胞膜完整性的影响Fig.4 Effects of wall materials on cell membrane integrity of Probio-M8 after spray-drying
2.6 形态特征观察
微胶囊粉末的表面形态对益生菌的复水性和储存稳定性有直接影响[32]。图5显示了4 种不同保护壁材的微胶囊粉在不同放大倍数下获得的SEM 显微照片。根据Lian 等[33]的说法,除了壁材料的化学性质不同之外,它们还具有不同的物理性质(导热性、热扩散性),这可能在喷雾干燥过程中对包封的细胞产生不同程度的保护作用。由图可知,使用不同的保护壁材,微胶囊的的形态并没有明显的差异,均表现出球形和各种尺寸,粒度直径为5~10 μm,并带有凹陷和表面皱缩,而没有裂纹或裂隙的迹象,这表明壁材载体将菌体细胞完全包裹在里面,降低了菌体细胞对外界环境中氧气的胁迫作用,稳定了菌体细胞的活性。有研究表明,喷雾干燥工艺参数对微胶囊形态和粒度产生直接的影响,如喷嘴类型、雾化压力和进料速度[34]。

图5 Probio-M8 微胶囊SEM 图Fig.5 SEM pictogram of Probio-M8 microcapsules
2.7 玻璃化转变温度
玻璃化转变温度(Tg)定义为非晶体系从玻璃态变为橡胶态的温度,玻璃化转变温度对喷雾干燥产品非常重要,因为它与产品的物理(黏性和结块)和结构(孔隙塌陷、质地和再水合能力的变化)稳定性以及储存时发生的生物化学(脂质氧化、基于酶反应的质地或颜色变化)反应直接相关[35-36],当物质低于玻璃化转变温度,体系内的分子由于受到外界的束缚,其分子流动性较低,与外界基本不发生反应。因此,当食品处于玻璃态贮藏时,具有较好的贮藏稳定性。4 种不同保护壁材的DSC热流曲线如图6所示,以脱脂乳、麦芽糊精、谷氨酸钠、复合壁材为壁材的微胶囊粉的Tg分别为183.06,208.10,158.75,181.80 ℃,4 种保护壁材均表现出较高的玻璃化转变温度,这对益生菌微胶囊制剂的稳定性和储存带来十分有利的影响。

图6 Probio-M8 微胶囊DSC 扫描图Fig.6 DSC thermograph of Probio-M8 microcapsules
2.8 抗氧化能力
DPPH·是一种稳定的有机基团,DPPH 溶液在波长517 nm 处有很强的吸收峰,具有特征性颜色紫色。当加入抗氧化物质时,来自抗氧化剂的1 个电子与稳定的DPPH·电子配对,因此,DPPH 的特征紫色变淡,抗氧化剂的浓度越高,DPPH 溶液的颜色越浅,可根据加入抗氧化剂前后DPPH 溶液吸光度值的变化来确定物质的抗氧化能力,不同壁材的益生菌微胶囊制剂对DPPH 自由基的清除能力及总抗氧化能力结果见图7。复合壁材、脱脂乳、谷氨酸钠和麦芽糊精保护的Probio-M8 的DPPH 自由基清除能力分别为59.95,33.90,17.38和16.94,4 种菌体对应的总抗氧化能力分别是6.38,4.60,1.54,1.85 U/mL。脱脂乳的Probio-M8总抗氧化能力和DPPH 自由基的清除能力均高于其它壁材保护的Probio-M8,说明复合壁材Probio-M8 菌体的抗氧化能力有较好的保护作用。

图7 壁材对喷雾干燥后Probio-M8 抗氧化能力的影响Fig.7 Effects of wall materials on antioxidant capacity of Probio-M8 after spray-drying
3 结论
本试验研究了不同壁材对真空低温喷雾干燥技术制备乳双歧杆菌Probio-M8 微胶囊的影响,通过对微胶囊粉的理化性质和存活率的测定,并对其形态进行了研究。试验结果表明,复合壁材的Probio-M8 微胶囊粉末表现出较高的存活率,且具有较低的水分含量和水分活度,粉末流动性也优于其它3 种壁材保护的Probio-M8,然而由于复合壁材组分复杂,其溶解度较低且再水合时间较长。此外,复合壁材保护的Probio-M8 细胞膜的完整性高于其它3 种壁材保护的Probio-M8,有效的保护了菌体细胞膜的完整性,并且具有较高的玻璃化转变温度和较好的抗氧化能力,对微胶囊粉的贮存稳定性有极大的提高。本试验通过对不同壁材对真空低温喷雾干燥技术制备乳双歧杆菌Probio-M8 微胶囊研究,对工业化生产高质量的Probio-M8 菌剂有良好的指导作用。

