UPLC-MS/MS法测定不同附子炮制品中14种生物碱
代 珊, 朱红梅, 李 帅, 毛九州, 张爱军*
(1.西南医科大学药学院,四川 泸州 646000;2.四川省中医药科学院,四川 成都 610041)
附子是毛茛科植物乌头AconitumcarmichaeliiDebx.的子根的加工品,6月下旬至8月上旬采挖,除去母根、须根及泥沙,习称“泥附子”,具有回阳救逆、补火助阳、散寒止痛之功效,但它属于毒性中药材,需经过炮制后方可入药。经典名方是指目前仍广泛应用、疗效确切、具有明显特色与优势的清代及清代以前医籍所记载的方剂[1],2018年,国家中医药管理局发布了《古代经典名方目录(第一批)》[2-3],其中5个经典名方中附子炮制方法记载为“炮”,如小续命汤中附子[4],但古法费时繁琐,火候难以控制,无法适应现代工业化需求。研究表明,炒[5]、烘[6]、蒸[6]、煮[7]、煨[8]等现代炮制方法均可对附子达到减毒存效的目的。
为了解决附子现代生产工艺问题,本实验选择炒、蒸、烘、白附片和黑顺片的炮制方法,通过UPLC-MS/MS法测定其中乌头碱、新乌头碱、次乌头碱、苯甲酰乌头碱、苯甲酰新乌头碱、苯甲酰次乌头碱、乌头原碱、新乌头原碱、次乌头原碱、附子灵、尼奥灵、塔拉萨敏、多根乌头碱、宋果灵14种生物碱含量,并与古法进行比较。化学计量学是一种综合分析方法,可将多个对象与多指标相互关联,从大量复杂的数据中提取信息[9-10],故本实验采用该方法寻找与古法相似的附子现代炮制方法,以期为该药材生产提供依据。
1 材料
1.1 仪器 Agilent 1290型超高效液相色谱仪、Agilent 6460型三重四极杆质谱仪、MassHunter Qualitative Analysis B.03.00软件(美国Agilent公司);AUW220D型电子天平(日本岛津公司);KQ-300B型超声波清洗器(昆山市超声仪器有限公司);Milli-Q纯水系统(美国Millipore公司);DB-207型电热恒温鼓风干燥箱(成都电烘箱厂)。
1.2 试剂与药物 乌头原碱(批号DST200807-007)、新乌头原碱(批号DST191117-026)、次乌头原碱(批号DST200807-059)、多根乌头碱(批号DST201017-059)对照品均购于成都德思特生物科技有限公司,纯度均≥98%;附子灵(批号MUST-20062606)、塔拉萨敏(批号MUST-20051801)对照品均购于成都曼思特生物科技有限公司,纯度均≥98%;尼奥灵(批号PS010183)、宋果灵(批号001150)对照品均购于成都普思生物科技有限公司,纯度均≥98%;苯甲酰乌头碱(批号111794-201705,纯度≥98%)、苯甲酰次乌头碱(批号111796-201705,纯度≥98%)、苯甲酰新乌头碱(批号111795-201805,纯度93.1%)、新乌头碱(批号110799-201608,纯度98.5%)、次乌头碱(批号110798-201609,纯度99.2%)对照品及乌头双酯型生物碱对照提取物(批号112029-201601,乌头碱纯度31.8%,次乌头碱纯度30.0%,新乌头碱纯度31.7%)均购于中国食品药品检定研究院。3批泥附子采自四川布拖,经四川省中医药科学院周先建副研究员鉴定为毛茛科植物乌头AconitumcarmichaeliiDebx.的子根。甲醇、乙腈(色谱纯,美国Fisher公司);甲酸(色谱纯,成都市科隆化学品有限公司);其余试剂均为分析纯。

a. 对照品 b. 供试品a. reference substance b. test sample图1 各生物碱MRM色谱图Fig.1 MRM chromatograms of various alkaloids
2 方法与结果
2.1 炮制品制备 取3批药材,每批平均分成6份,常压蒸制3 h,去皮,切片,干燥,即得蒸附子。药材用锡箔纸包裹,置于电热恒温鼓风干燥箱中,在150 ℃下烘制6~10 h至透心,去皮,切片,干燥,即得烘附子。将药材掩埋在热火灰中,炮至微裂,去皮,切片,干燥,即得炮附子[4]。将药材洗净,浸入食用胆巴的水溶液中数日,连同浸液煮至透心,捞出,水漂,纵切成约5 mm的厚片,再用水浸漂,用调色液使附片染成浓茶色,取出,蒸到出现油面、光泽后烘至半干,再晒干或继续烘干,即得黑顺片[11]。将药材洗净,浸入胆巴水溶液中数日,连同浸液煮至透心,捞出,剥去外皮,纵切成约3 mm的厚片,用水浸漂,取出,蒸透,晒干,即得白附片。将药材洗净,切片,干燥,即得生附片。将中等细度的河砂投入炒药机内,炒至滑利,投入生附片,砂炒至外表皮黄棕色,断面黄色,取出,迅速筛去河砂,晾干,即得炒附片[12]。
2.2 对照品溶液制备 精密称取各对照品适量,甲醇制成含乌头碱8.140 8 μg/mL、新乌头碱8.115 2 μg/mL、次乌头碱7.680 0 μg/mL、苯甲酰乌头碱22.198 4 μg/mL、苯甲酰次乌头碱14.592 8 μg/mL、苯甲酰新乌头碱17.875 2 μg/mL、乌头原碱19.600 0 μg/mL、新乌头原碱20.000 0 μg/mL、次乌头原碱20.000 0 μg/mL、附子灵17.978 4 μg/mL、尼奥灵18.518 0 μg/mL、塔拉萨敏22.743 0 μg/mL、多根乌头碱18.400 0 μg/mL、宋果灵21.560 0 μg/mL的溶液,即得。
2.3 供试品溶液制备 取药材粉末(过3号筛)约2 g,精密称定,置于具塞锥形瓶中,加入氨试液3 mL,精密加入异丙醇-乙酸乙酯(1∶1)混合溶液50 mL,称定质量,超声(功率300 W、频率40 kHz、水温25 ℃以下)处理30 min,放冷,混合溶液补足减失质量,摇匀,滤过,精密量取续滤液25 mL,40 ℃以下减压回收至干[8],残渣用甲醇溶解于25 mL量瓶中,再精密移取1 mL至5 mL量瓶中,加入甲醇至刻度,滤过,续滤液用0.22 μm微孔滤膜过滤,即得。
2.4 分析条件
2.4.1 色谱 Agilent SB-C18色谱柱(2.1 mm×50 mm,1.8 μm);流动相2 mmol/L醋酸铵(含0.1%甲酸)(A)-乙腈(含0.1%甲酸)(B);梯度洗脱(0~1.5 min,10%~20%B;1.5~5 min,20%~70% B;5~5.1 min,70%~100%B;5.1~8 min,100%B);体积流量0.4 min/L;柱温35 ℃;进样量1 μL。
2.4.2 质谱 电喷雾离子源(ESI),正离子模式;毛细管电压4 000 kV;干燥气温度300 ℃,体积流量11 L/min;雾化器压力310 kPa;MRM模式扫描。各生物碱主要质谱参数见表1,MRM色谱图见图1。
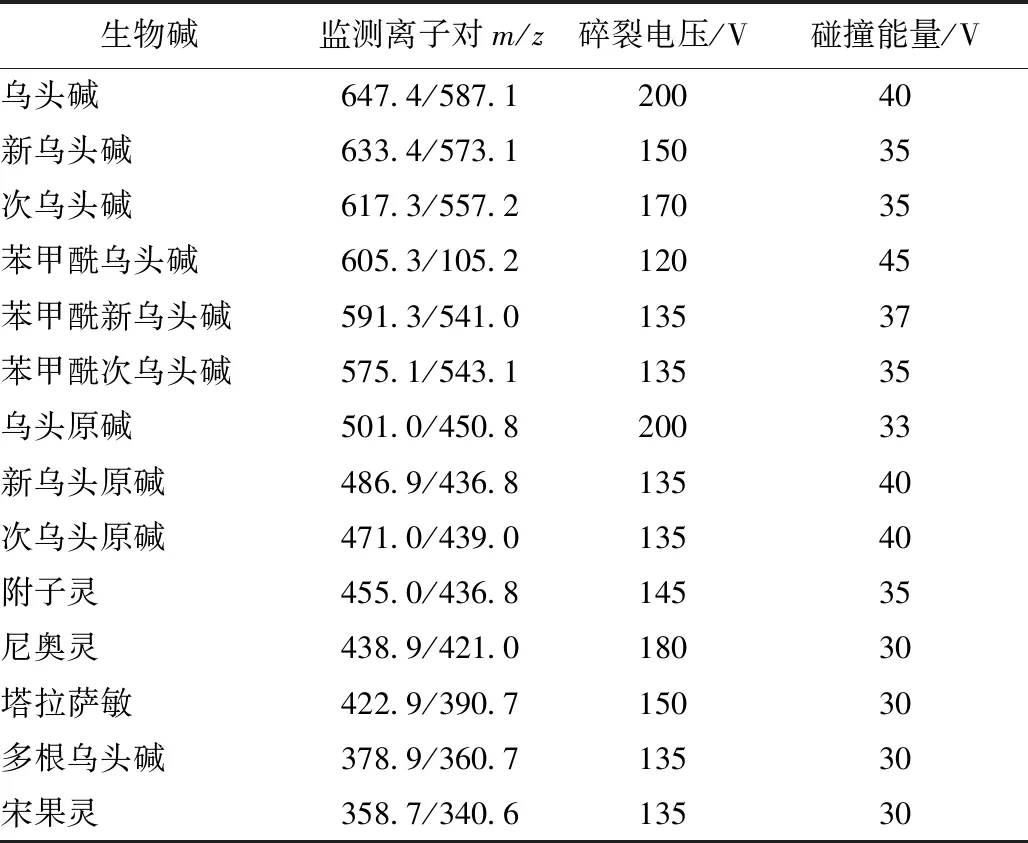
表1 各生物碱主要质谱参数Tab.1 Main mass spectrometric parameters for various alkaloids
2.5 方法学考察
2.5.1 线性关系考察 取“2.2”项下对照品溶液适量,精密配制成不同质量浓度,在“2.4”项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,并分别以信噪比(S/N)3∶1、10∶1为检出限、定量限,结果见表2,可知各生物碱在各自范围内线性关系良好。
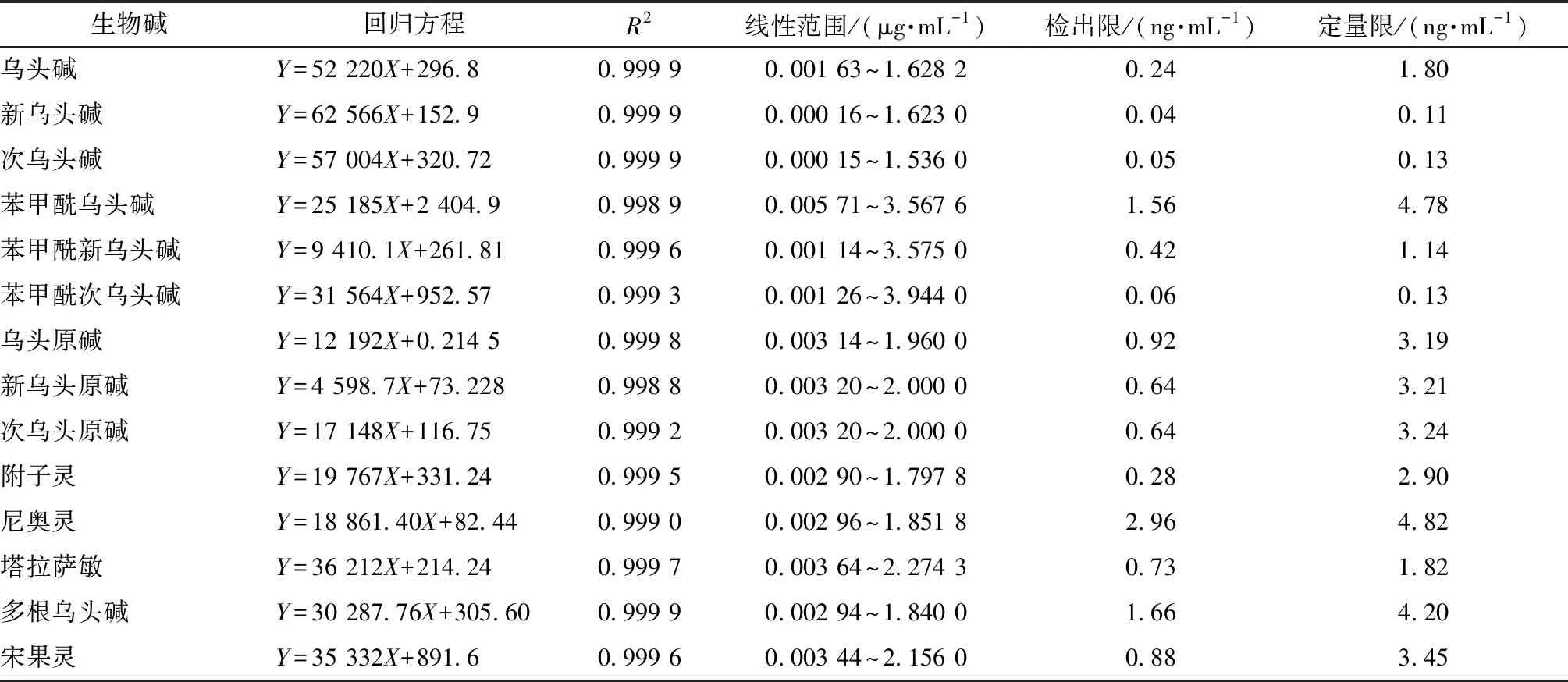
表2 各生物碱线性关系Tab.2 Linear relationships of various alkaloids
2.5.2 精密度试验 将“2.2”项下对照品溶液稀释10倍,在“2.4”项色谱条件下进样测定6次,测得各生物碱峰面积RSD为0.76%~2.88%,表明仪器精密度良好。
2.5.3 稳定性试验 取同一份供试品溶液,于0、2、4、8、10、12、24 h在“2.4”项色谱条件下进样测定,测得各生物碱RSD为1.81%~4.83%,表明溶液在24 h内稳定性良好。
2.5.4 重复性试验 取同一份炮制品约2 g,精密称定,按“2.3”项下方法平行制备6份供试品溶液,在“2.4”项色谱条件下进样测定,测得各生物碱含量RSD均小于4.33%,表明该方法重复性良好。
2.5.5 加样回收率试验 精密称取各生物碱含量已知的同一份炮制品6份,每份约1 g,按100%水平精密加入对照品溶液,按“2.3”项下方法制备供试品溶液,在“2.4”项色谱条件下进样测定,计算回收率。结果,乌头碱、新乌头碱、次乌头碱、苯甲酰乌头碱、苯甲酰新乌头碱、苯甲酰次乌头碱、乌头原碱、新乌头原碱、次乌头原碱、附子灵、尼奥灵、塔拉萨敏、多根乌头碱、宋果灵平均加样回收率分别为102.80%、101.49%、103.33%、96.91%、102.92%、105.52%、100.37%、106.77%、96.92%、99.83%、104.19%、105.20%、105.20%、101.91%,RSD分别为3.66%、4.59%、1.08%、4.05%、3.91%、2.52%、3.31%、3.80%、1.76%、3.42%、1.05%、3.49%、2.61%、3.63%。
2.6 样品含量测定 取各炮制品适量,按“2.3”项下方法制备供试品溶液,在“2.4”项色谱条件下进样测定,计算含量,结果见表3。由此可知,炮附子中生物碱总含量最高,现代炮制品中较低;蒸附子、烘附子、炒附片减毒存效作用较好;黑顺片、白附片中毒性成分虽然大大减少,但有效成分也流失较多;古法炮附子中有效成分虽然保留较多,但减毒效果较差。

表3 各生物碱含量测定结果(μg/g)Tab.3 Results of content determination of various alkaloids(μg/g)
2.7 聚类分析 采用SPSS 26.0软件,以各生物碱含量为变量进行分析,选择组间连接和平方欧式距离,结果见图2。由此可知,当平方欧氏距离为5时,6种炮制品可分为3类,白附片和黑顺片为第1类,蒸附子和烘附子为第2类,炒附片和炮附子为第3类,与炮附子最相似的是炒附片。
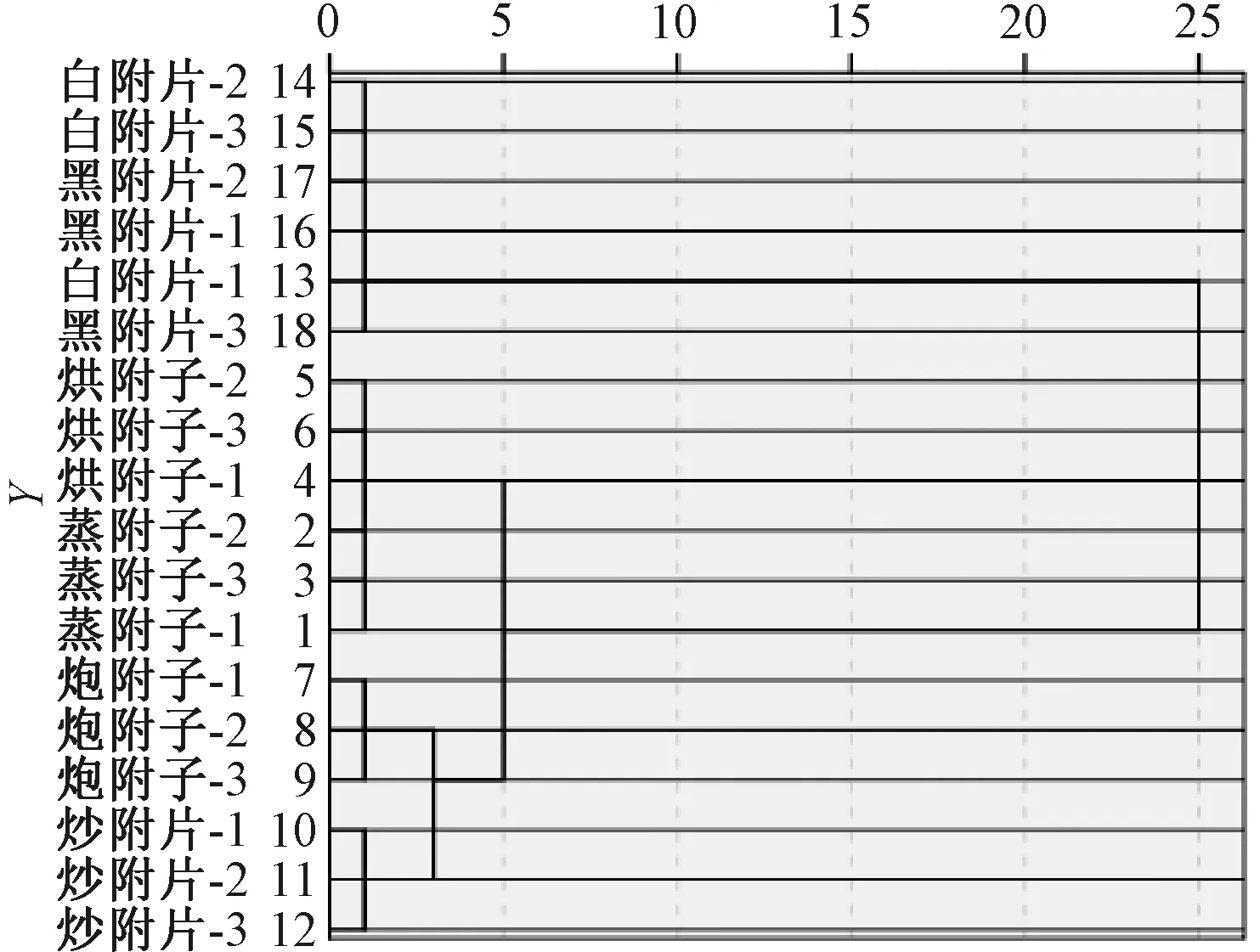
图2 不同炮制品聚类树状图Fig.2 Cluster dendrogram of different processed products
2.8 主成分分析(PCA)、正交偏最小二乘法判别分析(OPLS-DA) 将各生物碱含量导入SIMCA13.0.3软件中进行PCA处理,结果见图3A。由此可知,白附片、黑顺片远离炮附子,即与后者存在较大差异,但两者之间差异较小,表明不同胆巴工艺对生物碱的影响程度具有趋同性;炒附片比烘附子、蒸附子更接近炮附子,表明它对生物碱的影响程度与炮附子具有相似性。
再采用OPLS-DA模型进行分析,测得R2X=0.996,R2Y=0.841,Q2=0.657,表明模型稳定,预测能力较好。除了白附片、黑顺片外,炒、蒸、烘、炮这些炮制工艺的区分比较明显,所得成分也存在差异,见图3B。然后,以变量权重值(VIP)为指标筛选出对附子质量影响显著的生物碱,发现VIP>1者为苯甲酰次乌头碱、苯甲酰新乌头碱、附子灵、新乌头碱、多根乌头碱、次乌头碱,见图3C。

图3 各炮制品PCA-X、OPLS-DA得分图及VIPFig.3 PCA-X, OPLS-DA score plots and VIPs for different processed products
4 讨论
附子生物碱是该药材主要药效物质,其中双酯型生物碱乌头碱、新乌头碱、次乌头碱是剧毒成分,而单酯型生物碱苯甲酰乌头碱、苯甲酰新乌头碱、苯甲酰次乌头碱是有效成分,同时其余原碱类成分也证实具有不同程度的药理活性,如乌头原碱[13]、新乌头原碱[13]、次乌头原碱[13]、多根乌头碱[13]、塔拉萨敏[14]、尼奥灵[15]具有强心和降压作用,附子灵、宋果灵具有镇痛、降压[16]的作用。本实验发现,与古法差异较小的炮制品为炒附片,其原因可能是两者炮制温度接近,均约为170 ℃,而且炮制过程中均未有水蒸气参与;烘附子炮制温度为150 ℃,受热不均匀;蒸附子炮制温度为100 ℃,其间有水蒸气的不断参与,导致其相似度不及炒附片;白附片和黑顺片与古法差异较大,这是因为两者均经胆巴和水浸制、煮、漂、蒸等工序的处理,生物碱大量流失。但有研究发现,不同规格附子炮制品所制备复方汤剂的质量和药效存在显著差异[16-17]。
综上所述,本实验从化学成分的角度出发,发现炒附片与古法炮附子具有相似性,可为后续经典名方中该药材的炮制研究提供了理论依据。

