西红花柱头化学成分及其抗炎活性
童 鑫, 洪吟秋, 张 涛, 童应鹏, 王 平*, 邹忠梅*
(1.浙江工业大学药学院,浙江 杭州 310024;2.中国医学科学院&北京协和医学院药用植物研究所,北京 100193;3.台州学院高等研究院天然产物与健康产品研究所,浙江 台州 318000)
西红花又名藏红花、番红花,由鸢尾科番红花属植物西红花CrocussativusL.的柱头干燥制成[1],作为药食两用的贵重中药,具有活血化瘀、温经凉血解毒、解郁安神功效[2],以及抗抑郁、抗焦虑的潜在药用价值[3]。
西红花主要成分包括单萜类、二萜类、三萜类、四萜类及其衍生物[4-7],此外还有少量黄酮类、酚酸类、蒽醌类、生物碱类[8-11]。研究显示,小鼠西红花柱头乙醇提取物灌胃可减轻经卡拉胶诱导的足肿胀症状并具有时间依赖性,证明西红花柱头乙醇部位具有抗炎活性[12]。针对西红花柱头95%乙醇提取物化学成分,本课题组进行系统性分离和抗炎活性评价,从中分离并鉴定出14个化合物,其中化合物1是新化合物,2是新天然产物,6、8、13~14为首次从番红花属植物中分离得到,3、11具有一定抗炎活性。
1 材料
Advance Ⅲ型核磁共振仪(德国Bruker 公司);Synapt G2 型超高效液相色谱-四级杆飞行时间质谱联用仪、2535型半制备高效液相色谱仪(美国Waters 公司); gel CHP 20P型MIC(70~150 μmol/L,日本三菱公司);Genysys-10S 型紫外光谱仪(美国Thermo公司);大孔吸附树脂D101型(东鸿化工有限公司);YMC-Pack ODS-A 色谱柱(5 μm,10 mm×250 mm,日本YMC公司);CHIRALCEL OD-H色谱柱(5 μm,4.6 mm×250 mm,大赛璐药物手性技术有限公司);Sephadex LH-20羟丙基葡聚糖凝胶(美国Pharmacia公司);ODS(富士化学有限公司);薄层色谱硅胶(GF254)、柱色谱硅胶(青岛海洋化工厂)。RAW264.7细胞株(中国科学院上海细胞库);LPS(美国Sigma公司,L-2880);Griess试剂(上海碧云天生物技术有限公司)。甲醇等试剂均为分析纯(北京化工厂);实验用水为商用纯净水。
西红花从浙江省建德市三都西红花专业合作社采购,经浙江工业大学王平教授鉴定为西红花CrocussativusL.干燥柱头,标本(编号20170302)保存于中国医学科学院药用植物研究所国家中药化合物库。
2 提取与分离
4.5 kg药材用95%乙醇回流提取3次,每次1.5 h,提取液过滤合并后减压浓缩,得到粗浸膏2.1 kg,加入8 L纯水分散,等体积乙酸乙酯和正丁醇各萃取3次,合并萃取液,减压浓缩称定质量,分别得乙酸乙酯、正丁醇、水部位254.5 g、520.0 g、1.5 kg。
254.5 g乙酸乙酯部位浸膏通过硅胶柱常压层析,采用二氯甲烷-甲醇(100∶1、10∶1、1∶1)梯度洗脱,所得馏分合并为Fr.A ~ Fr.H。其中,Fr.D(15.1 g)经硅胶柱[二氯甲烷-甲醇(100∶1~1∶1)]梯度洗脱,然后由Sephadex LH-20[二氯甲烷-甲醇(1∶1)]纯化得化合物6(11.2 mg)。Fr.E(47.5 g)通过 MCI色谱柱[甲醇-水(85∶15~100∶0)]层析,硅胶柱[二氯甲烷-甲醇(250∶1~50∶1)]梯度洗脱,经半制备HPLC得化合物7(18.2 mg)、8(37.7 mg)、9(330.4 mg)、10(39.5 mg)。
520 g正丁醇浸膏通过D101大孔树脂[乙醇-水(30∶70~100∶0)]层析获得馏分,合并为Fr.1~Fr.3。Fr.2(107 g)经硅胶柱[乙酸乙酯-甲醇(10∶1~1∶1)]粗分得到Fr.2.A ~Fr.2.G。其中Fr.2.C(6 g)经中压ODS[甲醇-水(30∶70~100∶0)]与Sephadex LH-20(甲醇)层析减压得到F.2.C.1~F.2.C.11,其中F.2.C.2经半制备HPLC得化合物1(10 mg),F.2.C.11经半制备HPLC得化合物13(11 mg)、14(5 mg)。F.2.C.12经Sephadex LH-20(甲醇)得化合物11(60 mg)、12(50 mg)。Fr.3(40 g)经硅胶柱[二氯甲烷-甲醇(50∶1~2∶1)]层析,得到Fr.3.A~Fr.3.G,其中Fr.3.C~Fr.3.G经硅胶柱[石油醚-丙酮(100∶1~4∶1)]梯度洗脱和半制备型HPLC得化合物2(3 mg)、3(10 mg)、4(160 mg)、5(15 mg)。
3 结构鉴定


图1 化合物1的结构式Fig.1 Structure of compound 1
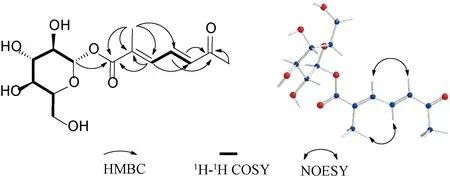
图2 化合物1的主要HMBC和1H-1H COSY相关Fig.2 Key HMBC and1H-1H COSY correlations of compound 1

表1 化合物1的1H-NMR(400 MHz, Acetone-d4)和13C-NMR数据(100 MHz, Acetone-d4)Tab.1 1H-NMR(400 MHz, Acetone-d4) and 13C-NMR data(100 MHz, Acetone-d4) of compound 1
化合物2:无色油状物。ESI-MSm/z:191.1[M+Na]+, 分子式C9H12O3。1H-NMR(600 MHz, Acetone-d6)δ: 7.52(1H, dd,J=15.5, 12.3 Hz, H-4), 7.24(1H, d,J=12.3 Hz, H-3), 6.47(1H, d,J=15.5 Hz, H-5), 3.70(3H, s, H-9), 2.32(3H, s, H-7), 2.08(3H, d,J=1.5 Hz, H-8);13C-NMR(150 MHz, Acetone-d6)δ: 198.1(C-6), 167.8(C-1), 136.9(C-4), 136.1(C-2), 135.7(C-3), 135.7(C-5), 52.1(C-9), 27.3(C-7), 13.1(C-8)。以上数据与文献[14]报道基本一致,故鉴定为(2E,4E)-2-甲基-6-羰基-2,4-庚二烯酸甲酯。
化合物3:黄色粉末。ESI-MSm/z:285.0[M-H]-, 分子式C15H10O6。1H-NMR(600 MHz, Methanol-d4)δ: 8.08(2H, d,J=8.4 Hz, H-2′, H-6′), 6.90(2H,d,J=8.4 Hz, H-3′, H-5′), 6.39(1H, s, H-6), 6.18(1H, s, H-8);13C-NMR(150 MHz, Methanol-d4)δ: 175.9(C-4), 164.2(C-7), 161.1(C-5), 159.1(C-4′), 156.8(C-9), 146.6(C-2), 135.7(C-3), 129.3(C-2′, 6′), 122.3(C-1′), 114.9(C-3′, 5′), 103.1(C-10), 97.8(C-6), 93.1(C-8)。以上数据与文献[15]报道基本一致,故鉴定为山柰酚。
化合物4:红色粉末。ESI-MSm/z:675.2[M+Na]+, 分子式C32H44O14。1H-NMR(500 MHz, Methanol-d4)δ: 7.46(1H, m, H-10), 7.30(1H, d,J=9.3 Hz, H-10′), 6.85~6.80(2H, m, H-15, 15′), 6.76(1H, d,J=15.0 Hz, H-12), 6.72~6.60(m, 3H, H-11, 11′, 12′), 6.51~6.45(2H, m, H-14, 14′), 2.02(12H, s, H-19, 19′, 20, 20′), 5.55(1H, m, H-1″), 4.33(1H, d,J=7.8 Hz, H-1‴);13C-NMR(125 MHz, Methanol-d4)δ: 172.2(C-8′), 168.6(C-8), 146.3(C-12), 145.1(C-12′), 142.0(C-10), 140.3(C-10′), 138.3(C-13), 137.9(C-13′), 137.5(C-14), 136.7(C-14′), 133.2(C-15), 132.7(C-15′), 126.4(C-9), 125.1(C-9′), 124.7(C-11,11′), 104.6(C-1″), 96.0(C-1′), 78.0(C-5″, 5‴), 77.9(C-3‴), 77.8(C-3″), 75.1(C-2‴), 74.0(C-2″), 71.5(C-4‴), 71.0(C-4″), 69.5(C-6″), 62.7(C-6‴), 13.0(C-19′), 12.8(C-20′), 12.8(C-19′), 12.8(C-20′)。以上数据与文献[16]报道基本一致,故鉴定为单侧西红花酸龙胆二糖酯。
化合物5:白色粉末。ESI-MSm/z:501.1[M+Na]+, 分子式C20H30O13。1H-NMR(600 MHz, Methanol-d4)δ: 7.54(1H, dd,J=15.4, 12.3 Hz, H-4), 7.37(1H, d,J=12.3 Hz, H-3), 6.47(1H, d,J=15.4 Hz, H-5), 5.54(1H, d,J=7.62 Hz, H-1′), 4.31(1H, d,J=7.8 Hz, H-1″), 2.34(3H, s, H-7), 2.10(3H, d,J=1.2 Hz, H-8);13C-NMR(150 MHz, Methanol-d4)δ: 199.4(C-6), 165.9(C-1), 136.7(C-3), 136.3(C-5), 135.5(C-4), 134.9(C-2), 103.1(C-1″), 94.9(C-1′), 76.6(C-5′, C-5″), 76.4(C-3″), 76.3(C-3′), 73.6(C-2″), 72.5(C-2′), 70.0(C-4′), 69.4(C-4″), 68.0(C-6′), 61.2(C-6″), 26.3(C-7), 11.9(C-8)。以上数据与文献[13]报道基本一致,故鉴定为(2E,4E)-2-甲基-6-羰基-2,4-庚二烯酸龙胆二糖酯。
化合物6:淡黄色粉末。ESI-MSm/z:309.1[2 M+H]+, 分子式C8H10O3。1H-NMR(500 MHz, Chloroform-d)δ: 7.32(1H, dq,J=11.7, 1.5 Hz, H-3), 7.41(1H, dq,J=15.1, 11.7 Hz, H-4), 6.44(1H, d,J=15.1 Hz, H-5), 2.34(3H, s, H-7), 2.08(3H, d,J=1.5 Hz, H-8);13C-NMR(125 MHz, Chloroform-d)δ: 172.6(C-1), 135.1(C-2), 135.8(C-3), 136.4(C-4), 137.3(C-5), 198.3(C-6), 28.4(C-7), 13.2(C-8)。以上数据与文献[17]报道基本一致,故鉴定为(2E,4E)-2-甲基-6-羰基-2,4-庚二烯酸。
化合物7:无色油状物。ESI-MSm/z:185.1[M+H]+, 分子式C10H16O3。1H-NMR(500 MHz, Acetone-d6)δ: 5.79(1H, s, H-2), 2.79(1H, d,J=17.2 Hz, H-6ax), 2.03(1H, d,J=17.2 Hz, H-6bx), 1.98(3H, s, H-7), 1.01(3H, s, H-8), 1.10(3H, s, H-9), 4.24(1H, d,J=11.4 Hz, H-10ax),3.78(1H, dd,J=11.4 Hz, 5.7 Hz, H-10bx);13C-NMR(125 MHz, Acetone-d6)δ: 197.8(C-1), 128.0(C-2), 164.5(C-3), 78.3(C-4), 41.0(C-5), 50.7(C-6), 20.1(C-7), 25.1(C-8), 24.3(C-9), 65.9(C-10)。以上数据与文献[18]报道基本一致,故鉴定为crocusatin M。
化合物8:无色油状物。ESI-MSm/z:185.1[M+H]+, 分子式C10H16O3。1H-NMR(500 MHz, Methanol-d4)δ: 10.09(1H, s, 1-CHO), 3.85(1H, d,J=12.0 Hz, H-5), 3.69(1H, ddd,J=12.0, 8.0, 3.7 Hz, H-4), 1.63(1H, dd,J=12.6, 3.7 Hz, H-3bx), 1.53(1H, d,J=12.6 Hz, H-3ax), 2.17(3H, s, H-7), 1.26(3H, s, H-8), 1.20(3H, s, H-9);13C-NMR(125 MHz, Methanol-d4)δ: 194.7(CHO), 156.1(C-2), 141.6(C-1), 78.5(C-5), 70.4(C-4), 46.9(C-3), 36.5(C-6), 27.6(C-8), 29.7(C-9), 14.3(C-7)。以上数据与文献[11]报道基本一致,故鉴定为crocusatin K。
化合物9:无色油状物。ESI-MSm/z:119.0[M-H]-,分子式C4H8O4。1H-NMR(500 MHz, Methanol-d4)δ: 4.66(1H, t,J=6.5 Hz, H-3), 4.41(1H, dd,J=12.0, 6.0 Hz, H-4bx), 4.29(1H, d,J=12.0 Hz, H-4ax), 2.74(1H, dd,J=18.0, 6.0 Hz, H-2bx), 2.51(1H, d,J=18.0 Hz, H-2ax)。以上数据与文献[11]报道基本一致,故鉴定为3,4-二羟基丁酸。
化合物10:无色针状晶体,易溶于甲醇。ES-MSm/z:137.0[M-H]-,分子式C7H6O3。1H-NMR(500 MHz, Methanol-d4)δ: 7.88(2H, d,J=8.6 Hz, H-2, H-6), 6.82(2H, d,J=8.6 Hz, H-3, H-5)。结合文献[19]与对羟基苯甲酸对照品的TLC薄层色谱比对,鉴定为对羟基苯甲酸。
化合物11:黄色粉末。ESI-MSm/z:449.1[M+H]+,C21H20O11。1H-NMR(400 MHz, DMSO-d6)δ: 12.49(1H, s, 5-OH), 10.16(1H, s, 3-OH), 9.55(1H, s, 4′-OH), 8.07(2H, d,J=8.8 Hz, H-2′, 6′), 6.94(2H, d,J=8.8 Hz, H-3′, 5′), 6.80(1H, d,J=2.0 Hz, H-8), 6.42(1H, d,J=2.0 Hz, H-6), 5.07(1H, d,J=6.8 Hz, H-1″);13C-NMR(100 MHz, DMSO-d6)δ: 176.6(C-4), 162.5(C-7), 160.8(C-5), 159.9(C-4′), 156.2(C-9), 148.0(C-2), 136.5(C-3), 130.1(C-2′, 6′), 122.0(C-1′), 115.9(C-3′, 5′), 105.2(C-10), 100.3(C-1″), 94.8(C-6), 94.8(C-8), 77.6(C-3″), 76.9(C-5″), 73.6(C-2″), 70.0(C-4″), 61.1(C-6″)。以上数据与文献[20]报道基本一致,故鉴定为山柰酚7-O-β-D-葡萄糖苷。
化合物12:黄色粉末。ESI-MSm/z:449.1[M+H]+,分子式C21H20O11。1H-NMR(400 MHz, DMSO-d6)δ: 12.62(1H, s, OH-5), 10.89(1H, s, 7-OH), 10.21(1H, s, 4′-OH), 8.05(2H, d,J=8.8 Hz, H-2′, 6′), 6.89(2H, d,J=8.8 Hz, H-3′, 5′), 6.44(1H, d,J=1.9 Hz, H-8), 6.22(1H, d,J=2.0 Hz, H-6), 5.47(1H, d,J=7.3 Hz, H-1″);13C-NMR(100 MHz, DMSO-d6)δ: 177.9(C-4), 164.6(C-7), 161.7(C-5), 160.4(C-4′), 156.9(C-9), 156.4(C-2), 133.6(C-3), 131.3(C-2′, 6′), 121.3(C-1′), 115.6(C-3′, 5′), 104.5(C-10), 101.3(C-1′), 99.2(C-6), 94.1(C-8), 77.9(C-3″), 76.9(C-5″), 74.6(C-2″), 70.3(C-4″), 61.3(C-6″)。以上数据与文献[21]报道基本一致,故鉴定为山柰酚3-O-β-D-葡萄糖苷。
化合物13:黄色粉末。ESI-MSm/z:457.1[M+Na]+,分子式C21H22O10。1H-NMR(400 MHz, Methanol-d4)δ: 7.31(2H, d,J=7.7 Hz, H-2′, 6′), 6.81(2H, d,J=8.4 Hz, H-3′, 5′), 6.24~6.15(2H, m, H-6, 8), 5.36(1H, d,J=12.8 Hz, H-2), 4.96(1H, d,J=6.9 Hz, H-1″), 3.87(1H, d,J=11.3 Hz, H-6bx″), 3.68(1H, dd,J=11.3, 5.3 Hz, H-6ax″), 3.54~3.37(4H, m, H-2″, 5″), 3.14(1H, d,J=15.2 Hz, H-3bx), 2.73(1H, d,J=17.2 Hz, H-3ax);13C-NMR(100 MHz, Methanol-d4)δ: 197.2(C-4), 165.6(C-5), 163.5(C-7), 163.2(C-9), 157.7(C-4′), 129.5(C-1′), 127.7(C-2′, 6′), 115.0(C-3′, 5′), 103.5(C-10), 99.8(C-1″), 96.6(C-6), 95.5(C-8), 79.3(C-2), 76.9(C-3″), 76.4(C-5″), 73.2(C-2″), 69.7(C-4″), 60.9(C-6″), 42.7(C-3)。以上数据与文献[22]报道基本一致,故鉴定为柚皮素-7-O-β-D-葡萄糖苷。
化合物14:黄色粉末。ESI-MSm/z:457.1[M+Na]+,分子式C21H20O11。1H-NMR(400 MHz, DMSO-d6)δ:7.41(2H, d,J=8.7 Hz, H-2′, 6′), 7.04(2H, d,J=8.7 Hz, H-3′, 5′), 5.87(2H, m,J=4.9 Hz, H-6, 8), 5.49(1H, dd,J=12.5, 2.8 Hz, H-2), 4.86(1H, d,J=7.2 Hz, H=1″), 3.68(1H, d,J=11.5, 5.3 Hz, H-6ax″), 3.44(1H, d,J=11.5 Hz, H-6bx″), 3.26(1H, d,J=2.9 Hz, H-3bx), 2.67(d,J=2.9 Hz, 1H, H-3ax);13C-NMR(100 MHz, DMSO-d6)δ: 196.3(C-4), 168.2(C-7), 164.0(C-5), 163.2(C-9), 158.0(C-4′), 132.5(C-1′), 128.5(C-2′, 6′), 116.7(C-3′, 5′), 102.1(C-10), 100.7(C-1″), 96.5(C-6), 95.7(C-8), 78.5(C-2), 77.5(C-3″), 76.6(C-5″), 73.8(C-2″), 70.2(C-4″), 61.2(C-6″), 42.5(C-3)。以上数据与文献[23]报道基本一致,故鉴定为柚皮素-4′-O-β-D-葡萄糖苷。
4 抗炎活性筛选
取指数生长期的小鼠巨噬细胞RAW264.7,接种于96孔板(1×105/孔)中,在37 ℃、5% CO2培养箱中常规培养12 h,用5 μmol/mL单体化合物预处理0.5 h后, 再加入LPS(0.5 μg/mL) 反应24 h。以同浓度姜黄素为阳性对照, 通过Griess反应评估细胞培养基中NO水平。
研究表明,在小鼠巨噬细胞内毒素(如 LPS)的诱导下,可产生大量 NO,而抗炎活性物质可消除炎症,减少NO释放[24]。因此,通过测定化合物抑制小鼠巨噬细胞NO的生成量,可筛选西红花中抗炎活性成分。
本实验采用脂多糖(LPS)诱导的小鼠RAW264.7炎症模型,以姜黄素为阳性对照,对化合物1、3~5、11~13进行体外抑制炎症测评,结果显示姜黄素的RAW264.7细胞NO生成量的抑制率(57.9±2.01)%,而3、11在5 μmol/mL浓度下的抑制率分别为(61.77±1.00)%、(55.05±4.52)%,但1、4~5、12~13无明显抑制作用。
5 结论
本实验共分离鉴定出14个化合物,体外抗炎活性实验表明,化合物3、11对脂多糖诱导RAW 267.4细胞的炎症有一定抑制作用。以上结果丰富了西红花的化学成分研究,可为后续开展其抗炎物质探索提供参考。

