右侧前额叶背外侧区低频重复经颅磁刺激对帕金森病非运动症状的疗效
马兴荣 刘 希 任幼红 孙治坤
1)郑州大学第一附属医院,河南 郑州 450052 2)河南省人民医院,河南 郑州 450003
帕金森病(Parkinson’s disease,PD)是常见的神经系统变性疾病之一,其临床表现包括典型的运动症状:运动迟缓、强直、震颤和姿势步态异常[1],同时还有抑郁、认知障碍、睡眠障碍、大小便障碍等非运动症状[2],这使得帕金森病的治疗非常困难,同时给患者带来很大的痛苦,给照料者带来一定的负担。
重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)作为一种无创神经调控技术,近几年来越来越受到人们的重视,既往研究证实其可以在药物治疗的基础上改善PD 患者运动和非运动症状[3-4]。国内外的很多研究尝试了不同皮层刺激区域、不同刺激频率对PD 症状的改善作用,但目前rTMS用于治疗帕金森病还缺乏高质量的临床试验证据[5-6]。在众多的研究中,高频刺激和左侧前额叶背外侧(dorsolateral prefrontal cortex,DLPFC)区是关注的热点。相对于高频rTMS的研究,国内外针对低频的研究还很少。一般认为右侧DLPFC区与帕金森病患者的认知、言语和肢体运动障碍相关[7-8]。也有少量研究采用低频rTMS 右侧DLPFC 区治疗帕金森相关抑郁,认为其机制可能是通过降低靶区域的兴奋性间接兴奋左侧DLPFC 区治疗抑郁症[9]。JIANG等[10]研究发现,右侧DLPFC 区低频rTMS 可以改善PD患者的睡眠障碍,然而在另外的研究中却得出不一样的结果[11]。所以,PD患者给予右侧DLPFC区低频rTMS,其非运动症状尤其是抑郁和睡眠障碍是否可以得到改善还不是十分确定。基于以上背景,本研究观察了持续4 周低频1 Hz rTMS 右侧DLPFC 区对PD非运动症状的治疗作用及安全性,并持续观察治疗后8周的疗效。
1 资料与方法
1.1 一般资料选取60 例2019-05—2021-03 就诊于郑州大学第一附属医院神经内科的PD 患者为研究对象。纳入标准:(1)符合英国帕金森病协会制定的PD 诊断标准,Hoehn-Yahr 分级≤3 级;(2)年龄50~70 岁,右利手;(3)规律服用抗帕金森药物30 d以上(治疗期间及观察期间无抗帕金森药物调整);(4)汉密尔顿抑郁量表24 项(Hamilton depression scale,HAMD-24)评分≥8分,匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)评分>7分;(5)患者及家属对本研究知情同意并签署相关文件。排除标准:(1)合并其他严重疾病或身体条件无法完成治疗者;(2)继发性帕金森综合征患者;(3)近3 个月内规律服用安眠药物、抗抑郁和抗精神疾病药物;(4)有严重精神异常或认知障碍者;(5)有癫痫病史者;(6)体内有起搏器植入者。采用随机数字表法将入组60例PD患者分为rTMS组和对照组各30例,最终57 例完成8 周随访,其中rTMS 组28 例,对照组29例。2 组患者性别、年龄、病程、H-Y 分期、HAMD 评分及PSQI 评分等一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组一般资料对比Table 1 Comparison of general data of the two groups
1.2 治疗方法2 组患者均继续原有常规抗PD 药物治疗,治疗期间及观察期间无抗PD 药物剂量调整。rTMS 组使用重复经颅磁场刺激仪(武汉依瑞德公司,型号:YRD CYY-Ⅰ)给予rTMS 治疗。选取右侧DLPFC 区为刺激部位,休息运动阈值的80%为刺激强度,1 Hz 为刺激频率,刺激时Y125 型环形线圈与颅骨平行。周一至周五,1 次/d,每次刺激30 min,共持续4 周。对照组给予伪刺激,休息运动阈值的50%为刺激强度,刺激线圈与颅骨平面垂直,其余参数设置与磁刺激组相同[12]。目前的刺激参数可以很好耐受,其中2名女性患者出现短暂的头痛但很快恢复,无严重不良反应。
1.3 疗效评定2组分别于治疗前、治疗结束时、治疗后4周、治疗后8周进行HAMD-24量表总分和7类因子分值评定。如受试者总分≥8分,则提示受试者存在抑郁症状,得分越高表明抑郁程度越严重[13]。2组分别于治疗前、治疗结束时、治疗后4周、治疗后8周进行PSQI 量表总分及7 因子评分。每个因子按0~3 等级计分,累积各成分得分为PSQI 总分,总分0~2l分,得分越高,表示睡眠质量越差。
1.4 统计学分析采用SPSS 22.0软件处理数据,计量资料以均数±标准差(±s)表示,应用S-W进行正态性检验,组间比较符合正态分布的用独立样本t 检验,不符合正态分布的用Mann-Whitney U检验;组内不同时间点的两两比较差值符合正态分布的采用配对t 检验,不符合正态分布的采用配对Wilcoxon 检验,以P<0.05为差异有统计学意义。
2 结果
2.1 治疗前后2组HAMD 评分比较 rTMS 组治疗前HAMD 评分与对照组比较差异无统计学意义(P>0.05)。rTMS 组治疗结束时与治疗前相比HAMD 分值明显下降(P<0.05),rTMS 组治疗后4 周及8 周HAMD 分值有所回升,但与治疗前相比差异有统计学意义(P<0.05)。组间比较发现,rTMS 组治疗结束时、治疗后4周及治疗后8周HAMD分值均低于对照组,差异有统计学意义(P<0.05),而对照组各时间点HAMD分值差异无统计学意义(P>0.05)。见表2。
表2 2组治疗前及治疗后不同时间点HAMD评分比较 (分,±s)Table 2 Comparison of HAMD scores between the two groups before and after treatment at different time points (scores,±s)

表2 2组治疗前及治疗后不同时间点HAMD评分比较 (分,±s)Table 2 Comparison of HAMD scores between the two groups before and after treatment at different time points (scores,±s)
注:与组内治疗前比较,aP<0.05;与对照组比较,bP<0.05
组别rTMS组对照组t值P值治疗后8周11.82±2.87ab 15.48±3.09—4.633<0.001 n 28 29治疗前15.07±3.48 15.52±3.10—0.512 0.611治疗结束时9.57±3.05ab 15.41±3.224—7.025<0.001治疗后4周10.14±3.00ab 15.21±2.82—6.565<0.001
2.2 治疗前后2组HAMD 各因子评分比较 rTMS
组与对照组治疗前HAMD各因子评分比较差异无统计学意义(P>0.05)。rTMS组治疗结束时与治疗前相比焦虑躯体化因子、阻滞因子、睡眠障碍因子、认知障碍因子、绝望感因子评分均明显下降(P<0.05),且与对照组比较各因子评分差异有统计学意义(P<0.05),日夜变化因子分值与治疗前及对照组比较差异均无统计学意义(P>0.05)。rTMS 组治疗后4周及8周各因子评分均有所回升,但治疗后4周时焦虑躯体化因子、阻滞因子、睡眠障碍因子、认知障碍因子、绝望感因子评分与治疗前及对照组相应时间点相比差异有统计学意义(P<0.05),日夜变化因子分值与治疗前及对照组比较差异均无统计学意义(P>0.05);治疗后8 周时焦虑躯体化、阻滞、睡眠障碍、认知障碍因子评分与治疗前及对照组相应时间点相比差异有统计学意义(P<0.05),绝望感和日夜变化因子分值与治疗前及对照组比较差异均无统计学意义(P>0.05),而对照组各时间点间HAMD 各因子分值差异无统计学意义(P>0.05)。见表3。
表3 2组治疗前及治疗后不同时间点HAMD各因子评分比较 (分,±s)Table 3 Comparison of HAMD factor scores between the two groups before treatment and at different time points after treatment (scores,±s)

表3 2组治疗前及治疗后不同时间点HAMD各因子评分比较 (分,±s)Table 3 Comparison of HAMD factor scores between the two groups before treatment and at different time points after treatment (scores,±s)
注:与组内治疗前比较,aP<0.05;与对照组比较,bP<0.05
组别刺激组对照组日夜变化0.89±0.74 0.96±0.74 0.93±0.77 0.96±0.74 0.90±0.56 0.90±0.67 0.86±0.64 0.83±0.66时间治疗前治疗结束时治疗后4周治疗后8周治疗前治疗结束时治疗后4周治疗后8周焦虑躯体化3.46±1.58 2.07±1.09ab 2.14±1.18ab 2.64±1.13ab 3.62±1.86 3.69±1.83 3.59±1.68 3.55±1.58阻滞4.21±2.35 2.71±1.98ab 2.82±1.89ab 3.18±2.00ab 4.48±2.05 4.38±2.24 4.28±2.02 4.45±2.15睡眠障碍3.21±1.60 1.82±1.25ab 2.07±1.39ab 2.29±1.38ab 3.14±1.68 3.00±1.69 3.03±1.88 3.17±1.69认知障碍1.50±1.20 0.86±0.80ab 0.93±0.90ab 1.07±0.86ab 1.62±1.12 1.59±1.12 1.55±1.20 1.66±1.08绝望感1.79±1.13 1.14±0.89ab 1.25±0.93ab 1.68±1.12 1.76±1.19 1.86±1.36 1.90±1.32 1.83±1.31
2.3 治疗前后2 组PSQI 评分比较rTMS 组与对照组治疗前PSQI 评分比较差异无统计学意义
(P>0.05),rTMS组治疗结束时与治疗前相比PSQI分值明显下降(P<0.05)。rTMS 组治疗后4 周及8 周PSQI 分值有所回升,但与治疗前相比差异有统计学意义(P<0.05);组间比较发现,rTMS 组治疗结束时、治疗后4周及治疗后8周PSQI分值均低于对照组,差异有统计学意义(P<0.05),而对照组各时间点间PSQI分值差异无统计学意义(P>0.05)。见表4。
表4 2组治疗前及治疗后不同时间点PSQI评分比较 (分,±s)Table 4 Comparison of PSQI scores between the two groups before and after treatment at different time points (scores,±s)

表4 2组治疗前及治疗后不同时间点PSQI评分比较 (分,±s)Table 4 Comparison of PSQI scores between the two groups before and after treatment at different time points (scores,±s)
注:与组内治疗前比较,aP<0.05;与对照组比较,bP<0.05
组别rTMS组对照组t值P值治疗后8周8.57±2.22ab 12.52±2.03—7.012<0.001 n 28 29治疗前12.21±2.95 12.31±2.11—0.141 0.888治疗后7.61±2.25ab 12.24±1.90—8.409<0.001治疗后4周7.96±2.25ab 12.21±1.93—7.638<0.001
2.4 治疗前后2组PSQI量表各因子评分比较rTMS
组与对照组治疗前PSQI各因子评分比较差异无统计学意义(P>0.05),rTMS 组治疗结束时与治疗前相比睡眠质量因子、入睡时间因子、睡眠时间因子、睡眠效率因子、睡眠障碍因子、催眠药物因子评分均明显下降(P<0.05),且组间与对照组各因子评分比较差异有统计学意义(P<0.05),日间功能障碍因子分值与治疗前及对照组比较差异均无统计学意义(P>0.05)。rTMS 组治疗后4 周及8 周各因子评分均有所回升,但睡眠质量因子、入睡时间因子、睡眠时间因子、睡眠效率因子、睡眠障碍因子、催眠药物因子评分与治疗前及对照组相比差异有统计学意义(P<0.05),日间功能障碍因子分值与治疗前及对照组比较差异均无统计学意义(P>0.05),而对照组各时间点间HAMD 各因子分值差异无统计学意义(P>0.05)。见表5。
表5 2组治疗前及治疗后不同时间点PQSI各因子分值比较 (分,±s)Table 5 Comparison of PQSI factor scores between the two groups before treatment and at different time points after treatment (scores,±s)
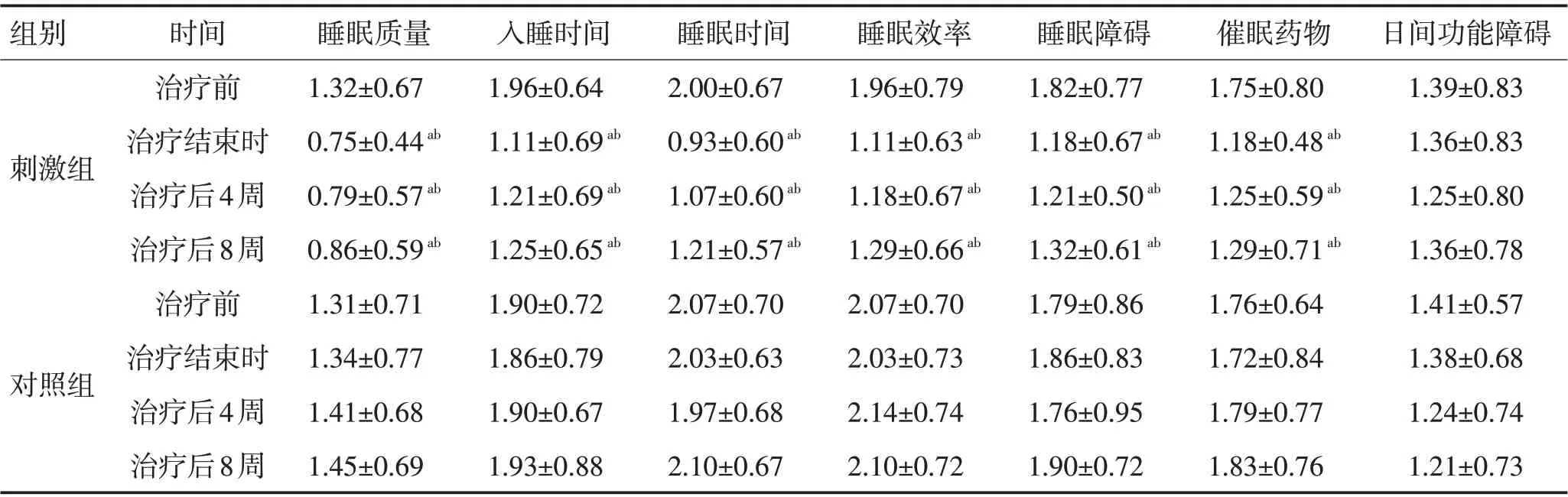
表5 2组治疗前及治疗后不同时间点PQSI各因子分值比较 (分,±s)Table 5 Comparison of PQSI factor scores between the two groups before treatment and at different time points after treatment (scores,±s)
注:与组内治疗前比较,aP<0.05;与对照组比较,bP<0.05
组别刺激组对照组时间治疗前治疗结束时治疗后4周治疗后8周治疗前治疗结束时治疗后4周治疗后8周睡眠质量1.32±0.67 0.75±0.44ab 0.79±0.57ab 0.86±0.59ab 1.31±0.71 1.34±0.77 1.41±0.68 1.45±0.69入睡时间1.96±0.64 1.11±0.69ab 1.21±0.69ab 1.25±0.65ab 1.90±0.72 1.86±0.79 1.90±0.67 1.93±0.88睡眠时间2.00±0.67 0.93±0.60ab 1.07±0.60ab 1.21±0.57ab 2.07±0.70 2.03±0.63 1.97±0.68 2.10±0.67睡眠效率1.96±0.79 1.11±0.63ab 1.18±0.67ab 1.29±0.66ab 2.07±0.70 2.03±0.73 2.14±0.74 2.10±0.72睡眠障碍1.82±0.77 1.18±0.67ab 1.21±0.50ab 1.32±0.61ab 1.79±0.86 1.86±0.83 1.76±0.95 1.90±0.72催眠药物1.75±0.80 1.18±0.48ab 1.25±0.59ab 1.29±0.71ab 1.76±0.64 1.72±0.84 1.79±0.77 1.83±0.76日间功能障碍1.39±0.83 1.36±0.83 1.25±0.80 1.36±0.78 1.41±0.57 1.38±0.68 1.24±0.74 1.21±0.73
3 讨论
PD 患者的非运动症状中抑郁与睡眠障碍发生率很高,且可能加重PD患者的运动症状,给PD患者带来一定的痛苦[14]。目前仍以药物为主,但药物的不良反应及药物对PD 运动症状的可能影响使其有时难以达到满意的效果。rTMS是目前临床中应用较为普遍的一种非侵入性脑电刺激技术,有调节脑内神经活动的作用,其具体作用机制为通过改变刺激部位大脑皮质神经细胞的动作电位,影响神经回路及脑内代谢[15]。以往多用于脑外伤的治疗,最近大家开始关注rTMS 在PD 中的治疗价值,尤其是其在PD非运动症状中的作用,但对于rTMS具体刺激参数及刺激区域的选择仍在探索中。在rTMS 的刺激区域中,DLPFC 区在帕金森病的治疗中是大家关注的重点,以往研究认为左侧DLPFC 区活性减低与帕金森病患者的情绪改变密切相关[9]。不同的研究均证实左侧DLPFC区高频rTMS可以改善PD患者的抑郁症状[16-18],而DORUK 等[19]研究发现,经颅磁刺激右侧DLPFC 区同样可以改善情绪和认知。与左侧DLPFC区相比,右侧DLPFC区研究较少,而对于右侧DLPFC区的研究主要集中在PD早期记忆力、决策力及执行力方面[20]。与其他刺激区域相比,非对称性右侧DLPFC 区rTMS 可以改善PD 患者任务执行能力、空间时间逻辑及抽象逻辑等[21-22]。然而,在PD患者中给予右侧DLPFC 区rTMS 治疗非运动症状的研究较少。既往少量研究发现,右侧DLPFC区rTMS可以改善运动症状,但这种效果并不能持久[11]。一些基础研究提示,PD的睡眠障碍与右侧DLPFC区优先相关[10]。另外,与高频刺激相比,低频刺激可能具有更好的安全性和耐受性,故本研究观察低频(1 Hz)右侧DLPFC区rTMS对PD患者抑郁和睡眠障碍症状的作用。
本研究发现,给予PD 患者为期4 周的低频(1 Hz)右侧DLPFC 区rTMS,治疗后rTMS 组HAMD 和PSQI 评分较治疗前明显下降(P<0.05),且这种变化可以持续到治疗后8周,说明其有相对较持久的治疗作用,与ZHUANG[23]等的研究结果基本一致。同样,CAO 和ZHOU 等[24-25]的 研 究 也 证 实 了 低 频 右 侧DLPFC 区rTMS 可以改善抑郁症状。在此结果基础上进一步分析了低频(1 Hz)右侧DLPFC 区rTMS 对HAMD 和PQSI 各因子评分的影响,发现其可以明显降低HAMD 评分中焦虑躯体化、阻滞、睡眠障碍、认知障碍因子分值(P<0.05),且该作用可以持续到治疗后8周,而绝望感因子评分在治疗结束时及治疗后4 周时有所下降(P<0.05),治疗后8 周时恢复至治疗前水平(P>0.05),日夜变化因子评分在治疗前及治疗后各时间点均无明显变化(P>0.05)。PSQI评分中睡眠质量因子、入睡时间因子、睡眠时间因子、睡眠效率因子、睡眠障碍因子、催眠药物因子评分明显下降(P<0.05),且可以持续到治疗后8 周,其中以睡眠时间因子评分改善最为明显,而治疗前后日间功能障碍因子评分差异无统计学意义(P>0.05)。右侧DLPFC 区低频rTMS 的这些改善作用具体机制仍不十分明确,有些学者认为针对过度活跃的右侧DLPFC区给予低频rTMS可以抑制皮层的过度兴奋,从而引起左侧DLPFC 区兴奋性增高[26]。安全性方面,rTMS组中2例女性患者出现短暂的头痛症状,但很快随着治疗的进展逐步耐受。
右侧DLPFC区低频rTMS对PD患者的抑郁和睡眠障碍有明显改善作用,该作用可以持续到治疗后8周,且具有较好的安全性。本试验也存在一定的局限性,入组样本量较小,以后仍需加大样本量及更全面的临床研究进一步验证,同时也需要进一步的rTMS机制研究。

