帕金森病不同运动亚型白质纤维损害的弥散张量成像研究
刘依然 刘泰松 宋金辉
1)锦州医科大学湖北医药学院附属襄阳市第一人民医院研究生培养基地,湖北 襄阳 44100
2)湖北省帕金森病临床医学研究中心,湖北 襄阳 441000 3)湖北医学院附属襄阳市第一人民医院,湖北 襄阳 441000
帕金森病(Parkinson’s disease,PD)是一种常见的慢性神经退行性疾病[1],主要分为震颤为主型(tremor dominant,TD)和姿势不稳-步态障碍型(postural instability difficulty,PIGD)两种运动亚型。流行病学研究表明,目前中国65 岁以上的老年人患病率1.7%,预计在2030 年PD 的患病率将翻一倍[2]。帕金森病主要病理特征是黑质纹状体通路多巴胺能神经元的进行性丧失,最终导致帕金森病的运动症状[3-4],包括运动迟缓、肌肉强直、姿势不稳和静止性震颤。然而,PD是一种具有多种运动和非运动症状的异质性神经系统疾病,其范围超过多巴胺能神经元的损害[5]。帕金森病引起广泛的脑白质微结构损害在其运动症状出现前就已经发生[6],复杂性在于其临床多样性,不同的临床症状及病情演变提示不同的神经机制[7]。磁共振成像(MRI)技术被用于研究可能存在的组织改变和结构异常,以便更全面地了解PD 的神经基础[8-9]。磁共振弥散张量成像(diffusion tensor imaging,DTI)主要利用人体内水分子在不同方向上自由运动所产生的信号成像,可及时发现灰质和脑白质微观结构变化,能够无创地显示神经纤维形态,反映纤维束的完整性,评估脑内不同区域间的连通性。DTI 越来越多被用来研究微结构的完整性和神经纤维束的变化。各向异性分数(fractional anisotropy,FA)可定量反映脑白质纤维束髓鞘化的程度,是评价脑白质损伤或功能障碍的最敏感参数,纤维束越完整,FA 值越高[10]。既往研究推测DTI 结果的异常与PD 的严重程度和亚型有关,认为DTI 反映的微结构变化可能是一种潜在的生物标志物。以往的DTI对PD的研究都依赖于一种感兴趣区的方法,局限于大脑的某一个区域,容易产生局限性。此外,先前的研究很少探讨随着PD运动症状的加重以及在不同的运动亚型方面微结构变化的分布是不同的。本文通过基于纤维束追踪的空间统计分析方法(tract-based spatial statistics,TBSS)联合确定性纤维追踪技术分析不同运动亚型大脑白质纤维的改变,评价大脑微结构变化的区域分布,并探讨这些区域的微结构变化与PD运动严重程度的相关性,以及在不同运动亚型中微结构改变的差异,希望能够为PD的磁共振生物标志物奠定基础。
1 资料与方法
1.1 一般资料纳入2019-09—2021-03 在湖北医药学院附属襄阳市第一人民医院就诊的PD患者,其中TD组16 例,PIGD组30 例,同期年龄、性别匹配的健康志愿者为对照组(HC 组),3 组一般资料比较见表1。
表1 3组一般资料比较 (±s)Table 1 Comparison of general data between the three groups (±s)
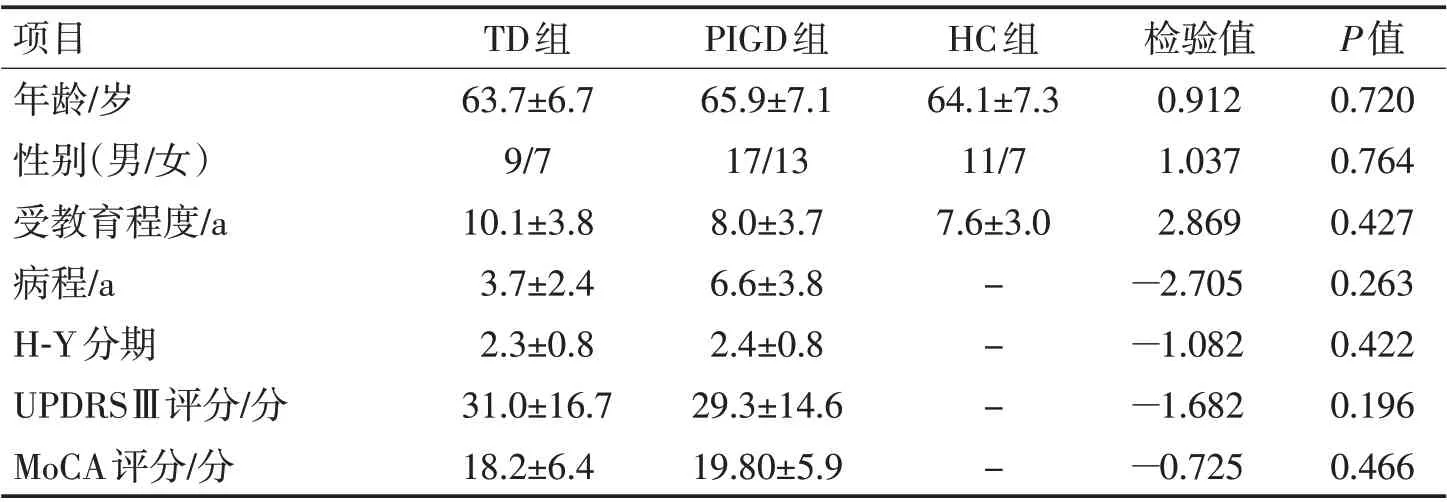
表1 3组一般资料比较 (±s)Table 1 Comparison of general data between the three groups (±s)
项目年龄/岁性别(男/女)受教育程度/a病程/a H-Y分期UPDRSⅢ评分/分MoCA评分/分TD组63.7±6.7 9/7 10.1±3.8 3.7±2.4 2.3±0.8 31.0±16.7 18.2±6.4 PIGD组65.9±7.1 17/13 8.0±3.7 6.6±3.8 2.4±0.8 29.3±14.6 19.80±5.9 HC组64.1±7.3 11/7 7.6±3.0——检验值0.912 1.037 2.869—2.705—1.082—1.682—0.725 P值0.720 0.764 0.427 0.263 0.422 0.196 0.466
PD 患者入组标准:(1)符合2015 国际运动障碍协会(MDS)公布的PD 诊断标准,确诊为PD 患者;(2)年龄50~80 岁;(3)右利手;(4)签署知情同意,能够配合检查并完成研究者。
排除标准:(1)年龄50~80 岁;(2)临床诊断非原发性PD:由神经系统肿瘤、脑卒中、颅脑外伤、药物等原因引起的PD综合征患者;(3)有严重外伤、严重的内科疾病(如脏器功能不全、自身免疫系统疾病、血液系统疾病、肿瘤疾病等);(4)无法配合检查者(如精神状态混乱、明显焦虑抑郁、严重认知功能障碍、磁共振检查禁忌等)。
明确诊断后,所有患者均在关期(脱离药物治疗至少12 h)进行临床评估;采用国际统一帕金森病评分 量 表(united Parkinson’s disease rating scale,UPDRS)中震颤评分与姿势不稳步态障碍评分之比进行分组[11],TD均分/PIGD均分≥1.5为TD组,TD均分/PIGD 均分≤1.0 为PIGD 组,1.0<TD 均分/PIGD<1.5为不确定组,TD均分=0时为PIGD组,PIGD均分=0 时为TD 组。所有研究组病例均进行Hoehn-Yahr(H-Y)分期、MoCA、汉密尔顿焦虑及汉密尔顿抑郁量表评定。健康对照者入组标准:(1)无器质性神经系统疾病,神经系统检查正常;(2)年龄50~80岁;(3)右利手;(4)签署知情同意。3 组间年龄、受教育程度、性别差异无统计学意义(P>0.05);TD 组与PIGD 组间的病程、H-Y分期、MoCA评分、UPDRSⅢ评分差异无统计学意义(P>0.05)。本研究得到医院伦理委员会的批准。
1.2 数据采集所有受试者均采用GE Signa HDxt 3.0T 超导型磁共振进行头部磁共振和8 通道高分辨头颈联合线圈检查,扫描序列包括:(1)T1WI FLAIR:TR 1 750 ms,TE 24.0 ms;(2)T2WI:TR 3 800 ms,TE 120 ms;(3)DTI:TR 6 000 ms,TE 98.6 ms,层间距1.5 mm,层厚5 mm,偏转角度45°,FOV 24 mm,扩散系数b=1 000 s/mm2,扫描时间8 min 23.8 s。
1.3 图像及数据处理在Linux 虚拟机下运用MATLAB R2016a 及PANDA 工具包,首先将DICOM数据转换到NIFTI 格式,去除颅骨和头皮等非脑组织,剪裁掉脑实质以外空间,然后进行头动及湍流校正、图像进行平均化及标准化配准,得到的FA 图制作一个代表所有受试者共同的纤维束的FA骨架,FA骨架的阈值为0.2,以排除FA值较低的体素,个体平均弥散率(mean diffusivity,MD)和FA 数据被投射到这个共同的骨架上。运用约翰霍普金斯大学JHU ICBM-DTI-81 白质图谱标记组间异常差异的纤维骨架。根据JHU ICBM-DTI-81 白质图谱所定义的大脑区域,运用PANDA进行确定性纤维追踪,转角>45°时停止纤维追踪,阈值定在0.2~1.0 mm,可得到全脑48个脑区纤维的FA值。
1.4 统计学分析应用SPSS 23.0 统计软件进行统计分析,年龄、受教育程度间的比较采用单因素方差分析,性别采用χ2检验,病程、H-Y分期、MoCA评分、UPDRS评分间的比较采用Mann-Whitney U检验。利用FSL 中的“randomise”方法检测TD、PIGD、HC 组间在FA、MD 上的差异,该程序使用基于置换的测试,有5 000次排列,并应用无阈值聚类增强(Tfce)进行统计推断。3 组间特定纤维束的FA 比较采用Kruskal-Wallis检验,若发现有显著性差异,则进行两两之间Mann-Whitney U 检验。所有P 值取双侧,由于是多重数据的比较,P值均经Bonferroni校正;各个脑区FA值与H-Y分期、UPDRSⅢ评分、MoCA评分之间的关系采用Pearson相关性分析。
2 结果
2.1 TBSS结果见图1。与HC组和PIGD组比较,TD 组在前放射冠、皮质脊髓束、扣带回、海马回、大钳、小钳、下额枕束、上纵束、钩束、上纵束(颞部)等纤维束的FA 升高,相反PIGD 组在上述纤维束中FA降低。与HC组相比,PIGD组患者FA的降低差异无统计学意义(P>0.05)。3 组间MD 差异无统计学意义(P>0.05)。

图1 FA组间差异Figure 1 Group differences in FA
2.2 确定性纤维追踪结果见表2。与HC组相比,TD 组和PIGD 组在左侧内囊后肢-左侧上放射冠的FA均升高,TD组升高更明显,其余纤维束间FA值差异无统计学意义(P>0.05)。
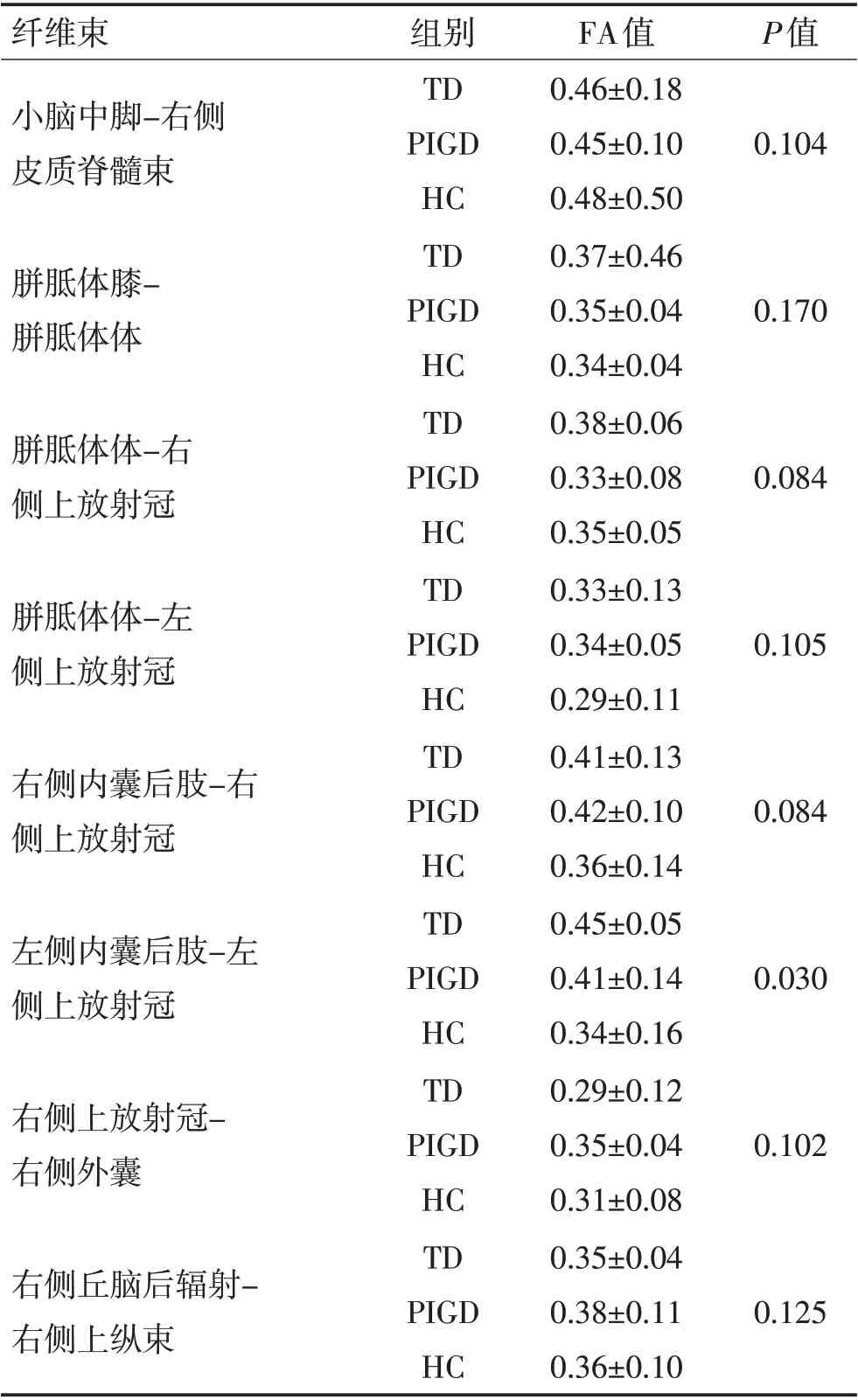
表2 3组间纤维束FA差异Table 2 Group differences in FA of white matter tracts
2.3 相关白质纤维FA 值与H-Y 分期、UPDRSⅢ评分、MoCA评分的相关性小脑中脚-右侧皮质脊髓束、小脑中脚-小脑下脚的FA 值与H-Y 分期呈负相关(图2A、B),小脑中脚-小脑下脚的FA值与UPDRSⅢ评分呈负相关(图2C),右丘脑后辐射-右矢状层的FA值与MoCA评分呈正相关(图2D)。

图2 相关白质纤维FA值与H-Y分期、UPDRSⅢ评分、MoCA评分的相关性Figure 2 Correlation between the FA and H-Y stage,UPDRSⅢscore and MoCA score in related white matter tracts
3 讨论
本研究采用基于纤维束追踪的空间统计分析方法联合确定性纤维追踪技术研究白质纤维束,探讨帕金森病不同运动亚型的白质微结构变化以及随着运动症状的加重,白质结构改变的区域特征。本研究发现TD 患者在一些投射纤维(如前放射冠、皮质脊髓束)的FA升高,表明纤维完整性更高,轴索变性和脱髓鞘更少;PIGD患者虽然在疾病分期和病程上与TD 患者差异不大,但与TD 组和HC 组相比,白质纤维完整性损害更严重,FA下降明显,在小脑中脚、小脑下脚处FA 值与运动程度相关,与H-Y 分期、UPDRS Ⅲ评分呈负相关。
本研究结果似乎与以往研究结果存在些许不同,虽然PIGD患者的FA 降低不明显,但TD患者的纤维完整性更高。既往研究表明,PIGD 患者中白质纤维微小结构的破坏更为广泛,白质纤维存在更多的病理改变,而TD中较少,所以PIGD患者的主要白质纤维束出现FA降低[12-13]。VERVOORT等[14]运用TBSS发现,与对照组相比,PIGD在胼胝体压部、体部和膝部和前放射冠等多处联络纤维束的FA 降低,而TD 患者与HC 组无明显差异;采用纤维追踪方法发现,与HC组比较,TD组和PIGD组MD增加,而FA未发现降低。然而,另一项研究采用两种不同的全脑分析方法指出,早期PD患者中在胼胝体、小钳等投射纤维和上、下纵束等联络纤维上FA升高[15]。ATKINSON-CLEMENT等[16]研究发现PD患者在皮质脊髓束的FA 是增加的。WEN 等[7]也发现TD 患者多个运动脑区FA 值的升高,与本研究结果是相似的。这些存在差异的结果在早期多认为是方法上的不同造成,如不同的磁共振扫描仪、场强、感兴趣区大小、交叉纤维、患者不同的运动和认知特征等[17-18]。而越来越多的研究发现,FA 升高不能仅仅归因于方法上的差异,也可能提示着神经纤维的代偿或兴奋反应。BROTCHIE等[19]提出多巴胺缺乏补偿的一种表现可能是神经回路的结构重塑,FA的增加或MD、RD 的减少可能是对多巴胺能异常调制和左旋多巴摄入的适应性反应,帕金森病的发病到临床症状的发病时间较长,皮质下和皮层运动通路很可能在PD 患者临床诊断之前就已经历了代偿性和适应性的结构和功能重组。本研究结果也支持这一病理改变,尤其是皮质脊髓束对自身发起的运动至关重要,是帕金森病运动迟缓的原因之一[20],所以它会发生改变,以抵消丘脑和基底节区的异常活动。随着症状的加重,代偿反应减弱,FA 降低,MD、RD 则升高,因此在PIGD 中FA 多表现为降低,与本研究结果也一致,所以需要进行更长的随访来研究神经纤维的补偿效应或兴奋效应在PD 进程中的变化和区域分布。
本研究也发现FA值与和H-Y分期、UPDRSⅢ评分呈负相关,与运动症状呈明显相关性,与先前的研究[21]一致。这些发现支持了FA值作为PD病理改变的潜在预测指标,也进一步证明了DTI 可作为PD 进展的一个有价值的生物标志物,有助于区分PD的不同亚型、评估病情以及预测预后,指导临床早期干预。
既往研究[22]表明,这两种亚型不仅在显性运动症状上存在差异,在非运动症状上也存在差异。如与TD 患者相比,PIGD 患者更容易出现认知功能受损、疾病进展更快、生活质量较差的情况。先前的一项研究运用基于全脑体素分析法发现,与HC 组相比,PIGD患者双侧上纵束FA 减少[23],与本研究结果是一致的,上纵束连接顶叶、颞叶和枕叶与同侧额叶皮质,该纤维束内的异常可能损害这些回路之间的通信,这可能是PIGD 表型患者症状更严重、更多样的原因之一。之前的尸检研究表明,TD患者的多巴胺能和非多巴胺能神经回路的细胞损失少于非震颤型PD 患者。本研究结果也倾向于TD 是PD 的一种良性亚型,尽管本研究中白质纤维完整性和连通性的改变似乎与BURKE 等[24]的神经病理学特征无明显相关。然而,无证据表明BURKE 分期与PD 的临床严重程度有直接关系。本研究还发现,小脑中脚、小脑下脚FA值与运动程度呈负相关,最近的证据表明不应忽视小脑在PD中的作用。ZENG等[25]发现小脑结构的改变可以区分PD组与健康对照组,准确率为95%,所以将来有必要对小脑结构进行更精确的划分,研究其在PD中的结构改变,对区别PD的各种亚型进行补充。
由于TBSS会产生部分容积效应,又鉴于大脑中90%的体素都存在交叉纤维,所以联合了确定纤维追踪技术。该方法比TBSS更为敏感,并重建出可靠的白质通路,改进了纤维结构复杂区域及受部分容积影响区域的纤维跟踪。本研究采用两种互补的方法探讨PD的两种不同运动亚型的异质性,更精确地反映了两种不同亚型白质纤维的差异以及在PD 进程中微结构改变的分布。但不可避免的是,某些患者在服药状态下进行运动评估,可能会出现亚型偏倚,以及PD患者中常见的头部运动可能会产生虚假的组间差异。本研究样本量较小,有一定的局限性,因此在未来的研究中需要严格控制这些混杂因素,最好结合磁共振功能成像进一步研究,并详细记录患者病程,对运动亚型进行多次评定,结合病理学检查明确诊断。

