利用HRM标记检测山东省稻瘟病菌群体的交配型分布
房文文,姜艳芳,王海凤,郭涛,薛芳,张焕霞,张士永
(山东省农业科学院湿地农业与生态研究所/山东省水稻工程技术研究中心,山东 济南 250100)
由稻瘟病菌(Pyricularia oryzae)引起的稻瘟病是水稻上的重要病害,危害性大、流行速度快,流行年份可造成严重减产[1]。山东省为黄淮海地区水稻主产区,以粳稻为主,年均种植面积达13万公顷。2014年临沂、日照稻区发生稻瘟病,损失严重[2,3]。目前生产上防治稻瘟病经济有效的措施是种植抗病品种[4],但由于田间稻瘟病菌小种类型多样,易发生变异[5],导致一些抗病水稻品种连续种植3~5年后抗性丧失,田间表现为感病[6,7],造成减产。
高分辨率熔解曲线(high resolution melting,HRM)技术是一种新兴的基因分型方法,能够区分SNP、SSR及Indel等不同变异[8]。此技术无需凝胶电泳,减少了污染;PCR扩增后仅需8~10 min便可以读取96个样品数据,真正实现了快速高通量检测[9]。目前在稻瘟病菌无毒基因pex31(Avr-Pik/kp/km)检测中已有应用[10]。
有性生殖是真菌的一种生殖方式,分为同宗配合和异宗配合。同宗配合真菌通常具有一个交配型基因座,而异宗配合真菌有一对交配型基因座[11]。异宗配合真菌必须由不同交配型的菌丝细胞结合后才能产生子代。稻瘟病菌属子囊菌广大角间座壳属的异宗配合真菌,具有MAT1-1和MAT1-2两种交配型[12],只有两个不同交配型的菌株对峙培养才能诱导产生有性态[13]。目前在自然条件下还没有发现稻瘟病菌的有性生殖,在实验室研究有性生殖较多[14]。MAT交配型基因控制稻瘟病菌等真菌的“性别”,对真菌的遗传进化起着决定性作用。研究稻瘟病菌有性态,有利于解析稻瘟病菌群体遗传多样性,并为群体变异、交配识别等提供理论基础,同时可以获得可育性菌株,为新的无毒基因的研究提供材料。
国内外有关稻瘟病菌有性生殖的研究工作已有大量报道。印度稻瘟病菌存在MAT1-1和MAT1-2两种交配型[11],美国稻瘟病菌仅存在MAT1-1交配型[15],泰国稻瘟病菌仅存在MAT1-2交配型[16]。我国广东省稻瘟病菌交配型MAT1-2占优势[17],宁夏稻瘟病菌都是MAT1-1交配型[14],黑龙江省稻瘟病菌存在MAT1-1和MAT1-2两种交配型,以交配型MAT1-1占优势[18]。迄今未见关于山东省稻瘟病菌株有性态研究报道。因此本研究连续5年收集山东稻区的稻瘟病菌群体,基于高分辨率熔解曲线技术测定菌株群体的交配型,明确交配型在不同稻区的分布及年份间的动态变化趋势,以期为解析稻瘟病菌有性态及遗传多样性提供依据。
1 材料与方法
1.1 试验材料
供试菌株:标准菌株S1528和P131,交配型分别为MAT1-1和MAT1-2[19],均由中国农业大学彭友良教授课题组赠予。于2016—2020年从山东省济南、济宁、临沂、日照、滨州及东营6市水稻产区采集稻瘟病样。
供试培养基:水琼脂培养基(20 g琼脂粉溶于1 L蒸馏水,分装至三角瓶,121℃湿热灭菌20 min);番茄燕麦培养基(30~40 g燕麦片、20 g琼脂粉、150 mL番茄汁、850 mL蒸馏水,分装至三角瓶,121℃湿热灭菌20 min)。
试剂及仪器:盐酸四环素、氨苄青霉素钠、硫磺卡那霉素、次氯酸钠溶液、十六烷基三甲基溴化铵(CTAB),购于生工生物工程(上海)股份有限公司;PCR试剂,北京全式金生物技术(TransGen Biotech)有限公司;EvaGreen qPCR核酸染料,美国Biotium公司。血球计数板(XB-K-25),上海XB-K-25求精生化试剂仪器有限公司;Optika B-383PLi显微镜,意大利M.A.D.公司;Nikon D90相机,尼康光学仪器(中国)有限公司;SPX智能型生化培养箱、RXZ-500C-LED人工气候培养箱,宁波江南仪器厂;BCD-290W 型立式冰箱,青岛海尔股份有限公司;罗氏LightCycler®96实时荧光定量PCR仪,Roche公司。
1.2 试验方法
1.2.1 稻瘟病样本采集及病菌分离、培养 在山东省济南、济宁、临沂、日照、滨州、东营6市代表性地区和多年稻瘟病重发区采集典型稻瘟病样本。挑选单个典型病斑剪成约5 mm大小于次氯酸钠消毒2.5 min,无菌水冲洗干净后平铺至水琼脂平板上。显微镜下将分生孢子稀释至1个视野下2~3个孢子,转移至新的水琼脂平板上。待分生孢子萌发后,镜检挑取单个孢子放至番茄燕麦培养基培养,2~3 d得到单孢菌落。将单孢菌株纯化后,选菌落边缘菌丝点接至铺满滤纸片的番茄燕麦培养基上,培养5~7 d后将滤纸片揭下放入硫酸纸袋内,干燥完全后-20℃保存。将待活化菌株的滤纸片点接到番茄燕麦培养基上,28℃光照培养,5~7 d后取菌丝[20]。
1.2.2 稻瘟病菌交配型分析 采用CTAB法提取稻瘟病菌基因组DNA。参照稻瘟病菌交配型基因序列[19]设计两对引物[生工生物工程(上海)股份有限公司合成,表1]进行PCR扩增。反应体系(10μL):2×EasyTaq®PCR SuperMix 5μL、DNA 3 μL、正反向引物各0.2μL(0.1 mmol/L)、20×Evagreen 0.125μL、ddH2O 1.475μL。扩增程序:94℃预变性3 min;94℃变性10 s,60℃退火30 s,72℃延伸20 s,共40个循环;72℃延伸10 min,4℃保存。熔解曲线分析程序为:95℃变性15 s;60℃退火15 s;以0.07℃/s的速率升温,10次/℃采集荧光信号,至90℃保持1 s。采用软件Light Cycler 96进行熔解曲线分析。
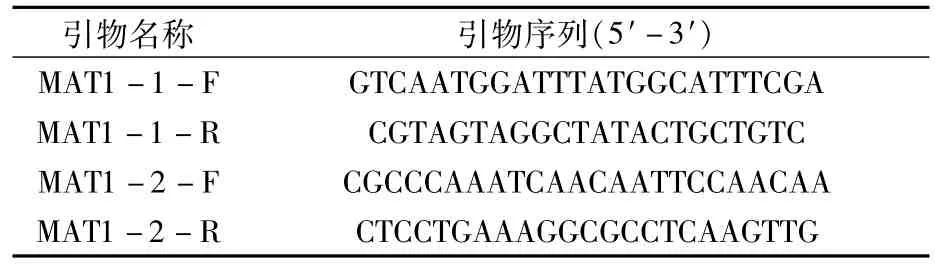
表1 稻瘟病菌交配型基因的引物序列
为了解山东省稻瘟病菌群体交配型,对不同地区间及不同年份间稻瘟病菌交配型多样性分布进行分析[18]。H=N/(N-1)×(1-ΣXi2),式中,H为多样性指数,N为群体总菌株数,Xi为某交配型在其群体中的出现频率。采用Microsoft Excel进行数据处理。
2 结果与分析
2.1 山东省稻瘟病菌的交配型
本试验共分离到稻瘟病菌株415株(表2)。利用两对特异性引物检测稻瘟病菌交配型,对照标准菌株得到的熔解曲线,根据扩增产物双链突变位点的退火温度(Tm值)不同区分不同的基因型,结果(图1)表明,当熔解温度为78~80℃时,稻瘟病菌为MAT1-1交配型;当熔解温度为82~84℃时,稻瘟病菌为MAT1-2交配型。熔解曲线检测结果显示,山东省稻瘟病菌交配型分布不均衡:415株稻瘟病菌株中交配型为MAT1-1的菌株有12株,出现频率为2.89%;交配型为MAT1-2的菌株有329株,出现频率为79.28%;双交配型的菌株有4株,出现频率为0.96%;未检测出交配型的菌株有70株,出现频率为16.87%。

表2 本研究分离稻瘟病菌情况
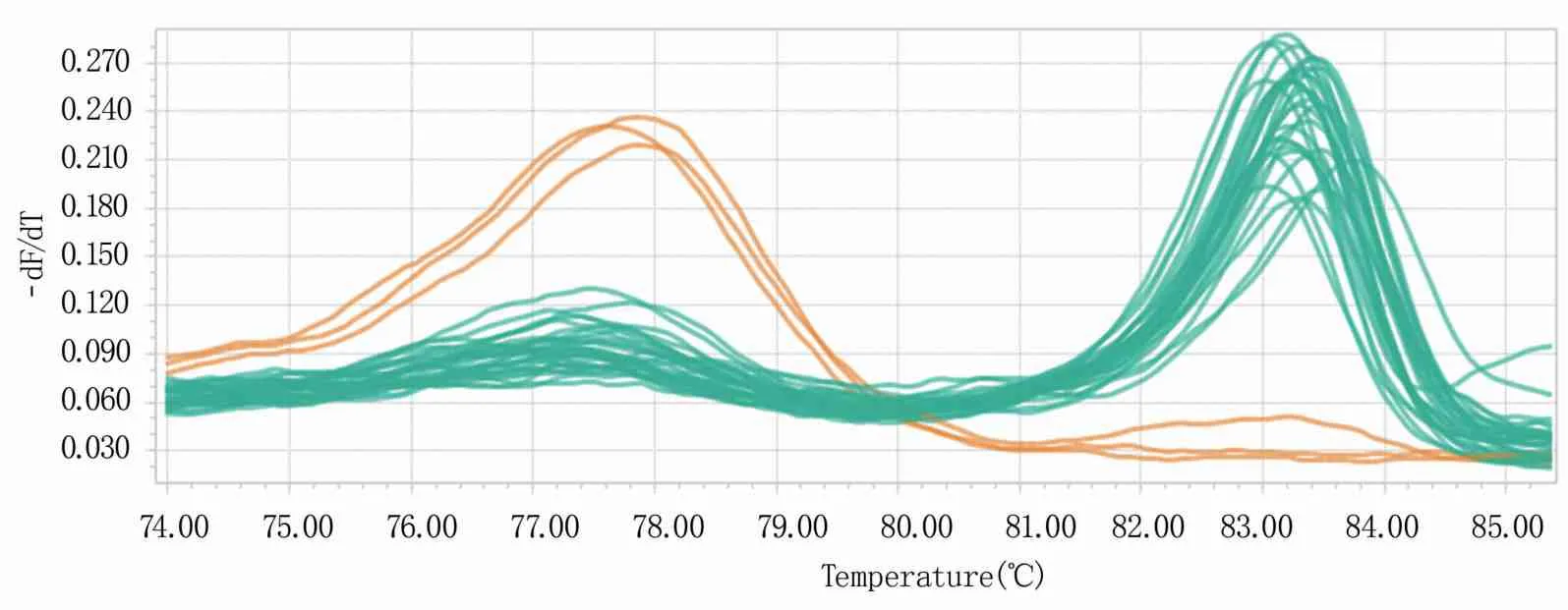
橙色曲线代表MAT1-1交配型,绿色曲线代表MAT1-2交配型。
2.2 不同年份间稻瘟病菌的交配型
由表3可知,2016年供试菌株总计45株,交配型为MAT1-2的菌株有33株,出现频率为73.33%;未检测出交配型的菌株有10株,出现频率为22.22%;交配型为MAT1-1的菌株有2株,出现频率为4.44%;不存在双交配型的菌株。2017年供试菌株总计63株,交配型为MAT1-2的菌株有52株,出现频率为82.54%;交配型为MAT1-1的菌株有6株,出现频率为9.52%;未检测出交配型的菌株有5株,出现频率为7.94%;不存在双交配型的菌株。2018年供试菌株总计108株,交配型为MAT1-2的菌株有71株,出现频率为65.74%;未检测出交配型的菌株有32株,出现频率为29.63%;交配型为MAT1-1的菌株有4株,出现频率为3.70%;双交配型的菌株有1株,出现频率为0.93%。2019年供试菌株总计91株,交配型为MAT1-2的菌株有66株,出现频率为72.53%;未检测出交配型的菌株有22株,出现频率为24.18%;不存在MAT1-1的菌株;双交配型的菌株有3株,出现频率为3.30%。2020年供试菌株总计108株,交配型为MAT1-2的菌株有107株,出现频率为99.07%;未检测出交配型的菌株有1株,出现频率为0.93%;不存在交配型为MAT1-1和双交配型菌株。
2016年山东省稻瘟病菌群体交配型多样性指数为0.471,2017年为0.315,2018年为0.572,2019年为0.478,2020年为0.019。表明2018年稻瘟病菌群体多态性最高,2020年稻瘟病菌群体多态性最低。

表3 2016—2020年山东省稻瘟病菌株交配型测定结果 (株,%)
2.3 各地区稻瘟病菌的交配型
对供试菌株的交配型按照地区进行分析,结果(表4)表明,鲁北地区稻瘟病菌群体中MAT1-2、未检测出交配型、双交配型菌株的出现频率分别为87.40%、11.81%、0.79%,不存在MAT1-1交配型菌株;鲁中地区稻瘟病菌群体中MAT1-2、未检测出交配型、MAT1-1、双交配型菌株的出现频率分别为79.67%、17.07%、2.44%、0.81%;鲁南地区稻瘟病菌群体中MAT1-2、未检测出交配型、MAT1-1、双交配型菌株的出现频率分别为72.73%、20.61%、5.45%、1.21%。
对供试菌株群体交配型进行多样性指数分析,发现山东省供试稻瘟病菌群体交配型多样性指数为0.371。鲁北、鲁中及鲁南地区稻瘟病菌群体交配型多样性指数分别为0.238、0.368、0.471,表明鲁南地区稻瘟病菌群体的多态性比北部和中部地区高。
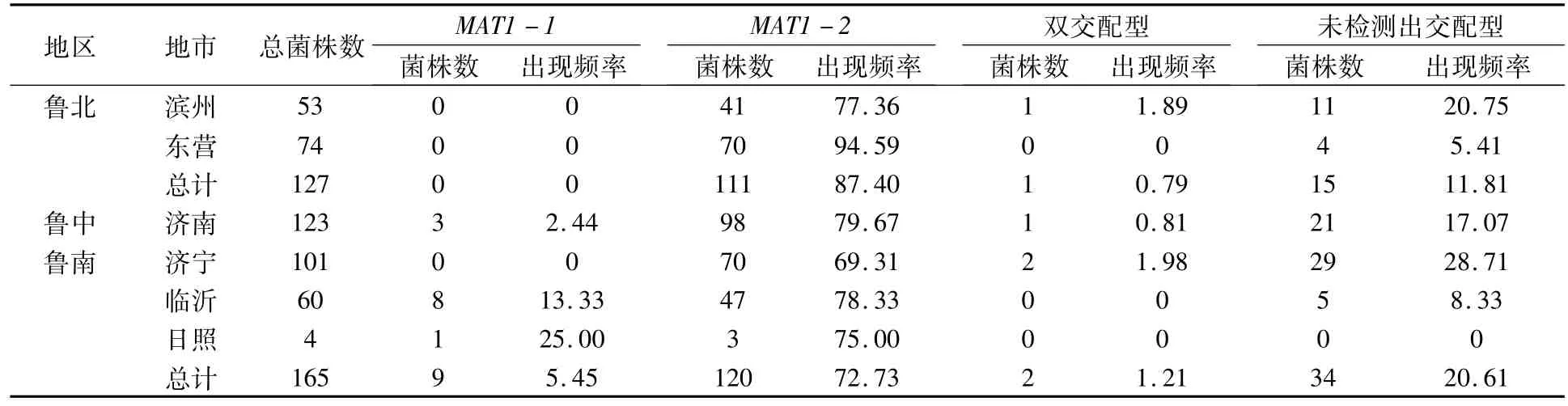
表4 山东省不同地区稻瘟病菌交配型测定结果 (株,%)
3 讨论与结论
目前常规检测交配型的方法主要是PCR扩增后进行琼脂糖凝胶电泳检测,该方法效率较低,难以实现批量化检测。本试验采用高分辨率熔解曲线(HRM)技术测定稻瘟病菌群体交配型,可快速、准确区分交配型基因分型,显著缩短检测所需时间,能够实现大批量稻瘟病菌交配型的快速检测。本试验方法可用于异宗配合的子囊真菌交配型的检测,有利于在丝状真菌交配型检测领域推广应用,对研究真菌遗传变异具有重大意义。
本研究发现山东省水稻种植区的稻瘟病菌群体中存在MAT1-1和MAT1-2两种交配型,且以交配型MAT1-2占优势,出现频率为79.28%,交配型MAT1-1出现频率仅为2.89%。已有研究结果[14-18]也表明,不同地区的稻瘟病菌交配型分布存在差异。在自然条件下山东省稻瘟病菌很难发生有性生殖,是否存在有性生殖还需进一步研究验证。
尽管基于PCR-HRM方法测定了山东稻瘟病菌群体的交配型,但是不能检测菌株的育性,后续将通过对峙培养检测育性,并与PCR方法检测交配型结果进行结合,从而使结论更加准确。
致谢:中国农业大学彭友良教授、赵文生教授、杨俊教授赠予标准菌株P131和S1528,特此致谢!

