荞麦根际微生物的分离及生物活性检测
张婉丽,赵雅慧,吉慧敏,王东胜
(山西师范大学生命科学学院,山西 太原 030031)
荞麦(Fagopyrum esculentum Moench),又称乌麦、三角麦,为蓼科荞麦属草本植物。荞麦原产于中国,主要分布在北方以及西南地区,如陕西、内蒙古、云南、四川。荞麦富含蛋白质、维生素、矿物质、黄酮类物质等,对许多疾病有一定的预防效果,是一种兼备食用与药用的优良作物。随着社会经济的发展,人们保健意识的增强,包括荞麦在内的一些小杂粮需求量不断增大。虽然我国荞麦种植面积居世界前列,但单位面积产量(850 kg/hm2)相较其他国家却很低[1-3]。已有学者通过育种技术[4]以及转基因技术[5]对提高荞麦产量进行研究,但从根际微生物方面改善荞麦生长条件却鲜有报道。
根际概念最早于1904年由德国科学家Lorenz Hiltner提出,指紧贴于根系的薄层土壤,该处土壤由于受到根系生长代谢的影响,表现出与周围土体不同的理化性质。生长在根际土壤中的微生物称为根际微生物[6]。根际是植物与土壤进行交互作用的关键点,根际微生物在植物生长和土壤养分循环中的作用已成为近年来微生物的研究热点[7-9]。大量研究表明,植物-根际微生物互作对植物健康生长起着重要作用,根系通过富集周围土壤的特定菌群,造成根际微生物多样性低于非根际土壤,但数量却高于非根际土壤[10]。植 物 的 类 型[11]、生 育 时 期[12]、生 长 环境[13]均会对根际微生物的种类组成及生态分布产生影响。同时,根际微生物可以通过促生机制、生防机制来促进植物生长。如溶磷菌可以将环境中难溶无机磷转换成植物可吸收形式促进种子萌发,增加干重[14];链霉菌通过拮抗病原菌降低黄瓜立枯病发病率,提高种子发芽率,促进幼苗生长[15];此外,根际微生物还可以影响氮的有效性,将色氨酸转换为吲哚乙酸调控植物开花时间,以此进一步促进植物生长[16]。
目前我国许多地区存在过量及不平衡施肥等问题,一方面会污染环境,使得土壤理化性质发生改变,土体质量下降,农产品品质受到影响,另一方面还会增加农户生产成本(化肥占生产总物资费用50%左右)[17]。根际益生菌是菌肥的主要菌种来源,在可持续农业发展中有着巨大的应用潜力。随着生物技术的发展,将有益微生物制作成菌肥来代替一部分化肥越来越成为可能。马军妮[18]用娄彻氏链霉菌和密旋链霉菌制成放线菌菌剂,可提高幼苗总鲜重、叶片净光合速率和根系诱导酶活性,增强小麦抗逆性、穗粒重等。周冬梅[9]从拟南芥根际中筛选出两株具有抗旱能力的菌株Burkholderia sp.ARD10和Mitsuaria sp.ARD17,均具有产生EPS和ACC脱氨酶的能力,经过对玉米的促生试验发现,在干旱条件下能显著提高叶片含水量、脯氨酸积累量以及过氧化物酶(POD)活性,还可提高玉米在干旱胁迫中的激素含量,从而提高干旱耐受性。目前有关荞麦根际微生物的报道很少,因此本试验以荞麦为研究对象,从其根际土壤筛选出具有抗菌活性、解磷活性及产蛋白酶和淀粉酶能力的菌株,旨在筛选出具有促生功能的有益菌并开发成菌肥,从而促进荞麦增产和绿色农业发展。
1 材料与方法
1.1 试验材料
土样来自晋荞(苦)5号根际,荞麦于2020年10月26日采自于山西省晋中市太谷县侯城乡孟家庄村(112.595583°E,37.439568°N,海拔769~830 m),密度90万株/hm2。样品于-80℃保存。
1.2 试验方法
1.2.1 样品预处理 轻轻抖落掉与荞麦根系附着不紧密的土壤,将根与附着土壤一起称重后,放入90 mL无菌水中洗净捞出,擦干称重,两者重量之差即为根际土壤重量(0.5 g),根际土壤溶液记作10-2。将根际土壤溶液放入锥形瓶摇床振荡30 min使其充分混匀,使用移液管吸取1mL转入装有9 mL无菌水试管中,记作10-3,依次稀释为10-4、10-5。
1.2.2 根际微生物的分离纯化 采用稀释平板涂布法进行分离。细菌涂布于牛肉膏蛋白胨培养基(BPA)[19],放线菌涂布于高氏一号(GA)[19]、TWYE[20]、ISP2[21]培养基,稀释梯度均选取10-3、10-4、10-5。真菌接种于马铃薯葡萄糖培养基(PDA)[19],稀释梯度选取10-2、10-3、10-4。每个梯度3个重复,共45(5×3×3)个平板。置于28℃恒温箱中,细菌培养2~3 d,真菌培养3~4 d,放线菌培养7~8 d。挑取形态、大小不同的菌株采用平板划线法进行纯化,重复2~3次,直至出现单菌落。编号后于斜面中保藏备用。
1.2.3 生物活性检测
(1)菌株活化:将保藏真菌接种于PDA培养基中进行活化;细菌、放线菌分别涂布于BPA、GA培养基中进行活化,完成后用6 mm直径打孔器打孔备用。
(2)抗菌活性检测:供试病原菌均由山西师范大学微生物实验室提供,分别为大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、青霉菌(Penicillium sp.)、酵母菌(Saccharomyces cerevisiae)。在接种靶标菌的试管中注入适量无菌水,轻轻抽提搅拌,制成悬菌液。使用移液管将病原细菌悬菌液滴至BPA培养基中,病原真菌滴至PDA培养基中,用涂布器均匀涂开。
放线菌和真菌采用琼脂块法[19]:28℃培养1~2 d,观察是否产生透明圈,并记录透明圈直径。细菌采用对峙法[22]:28℃培养1 d,观察十字交叉处靶标菌的生长情况。
(3)酶活性检测:培养基为H1-1培养基[23],放线菌和真菌采用琼脂块法,28℃培养2~3 d;细菌采用点接法[24],37℃培养1~2 d。检测蛋白酶活性时,可直接观察透明圈;检测淀粉酶活性时,滴加适量碘液后观察菌落周围是否产生透明圈。
(4)解磷活性检测:采用点接法,培养基为磷酸钙固体培养基[25],28℃培养3~4 d,观察透明圈。
1.2.4 菌种鉴定 对所筛选广谱活性菌株进行鉴定,由上海派森诺基因科技有限公司完成。将所测真菌序列利用NCBI数据库进行BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,所获细菌、放线菌序列利用EzBioCloud(https://www.ezbiocloud.net/)数据库进行比对,筛选相似度较高序列通过MEGA 10.2.5软件进行系统发育分析。
2 结果与分析
2.1 荞麦根际微生物的种类及数量
荞麦根际土壤中富含大量微生物,共分离出72株菌,其中放线菌39株、真菌18株、细菌15株。从表1可看出根际微生物中细菌数量最多,约为6.2×108cfu/g,其次是放线菌,约为(3.7~7.1)×107cfu/g,真菌数量最少,约为3.7×105cfu/g。GA培养基分离得到的放线菌种类最多,占放线菌总数目的43.6%;ISP2培养基的分离种类最少。
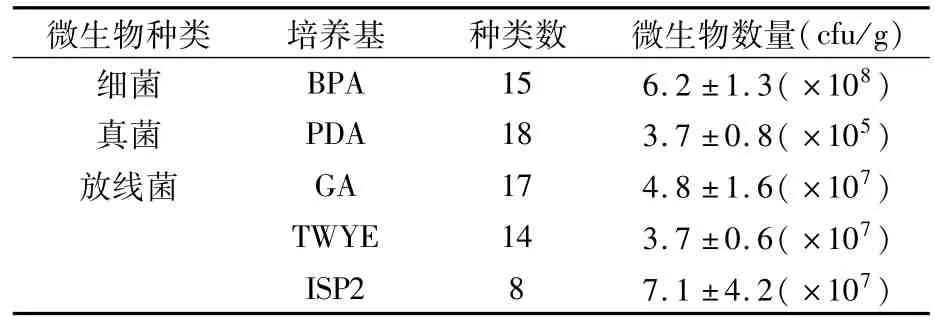
表1 荞麦根际土壤微生物数量
2.2 荞麦根际微生物的抑菌活性
由表2可知,对酵母菌、青霉、大肠杆菌、金黄色葡萄球菌具有拮抗活性的分别有23、5、3、25株。放线菌的拮抗活性较好,在拮抗各靶标菌总数中分别占82.6%、100.0%、66.7%、76.0%。透明圈直径(D)与菌落直径(d)比值越大,透明度越高,证明其拮抗活性越好,其中4株放线菌SI16、SG15、SG22、ST1-1的抗菌活性较好,均具有3种抗菌活性(表3)。
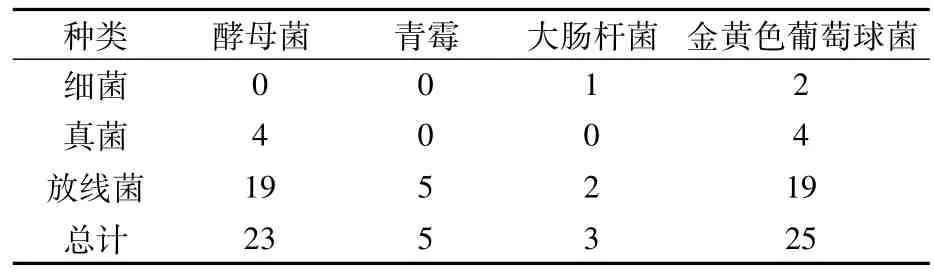
表2 不同种类菌株拮抗活性筛选结果

表3 4株放线菌对4种靶标菌的拮抗能力
2.3 荞麦根际微生物的酶活性
以可溶性淀粉、脱脂奶作为筛选底物,对72株菌进行功能酶活性筛选,其中有15株菌具有蛋白酶活性,占比20.8%;14株菌有淀粉酶活性,占比19.4%;同时具有两种酶活性的有4株,占比5.6%。对具有蛋白酶活性的菌株测量其透明圈,D/d值越大,透明度越高,证明其活性越高。从表4中可看出SB1、SG13、SG15的蛋白酶活性较好,从表5中可看出SI21、SG2-2、SG15、ST1-1、ST1-2的淀粉酶活性较好。

表4 荞麦根际微生物蛋白酶活性筛选结果
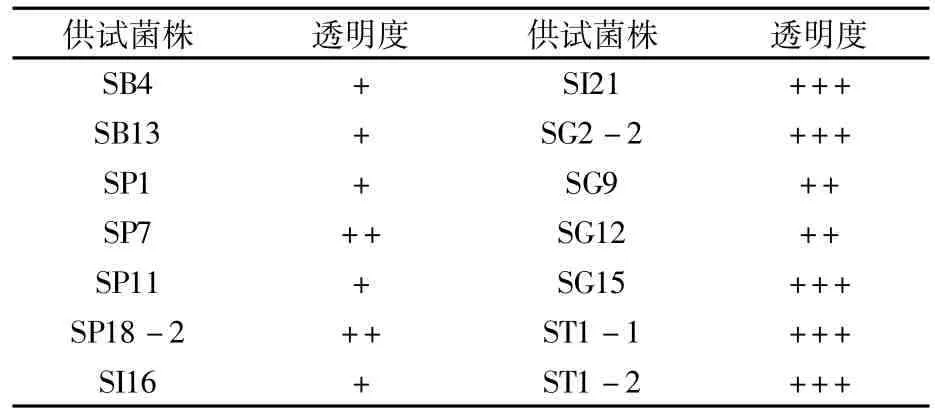
表5 荞麦根际微生物淀粉酶活性筛选结果
2.4 荞麦根际微生物的解磷活性
以Ca3(PO4)2作为难溶性磷酸源,筛选具有解磷活性的菌株,试验共发现10株菌(细菌、真菌)具有解磷活性,占比13.9%。从表6中可看出,菌株SB16、SB3-2、SP5解磷效果较好。

表6 荞麦根际微生物解磷活性筛选结果
2.5 广谱活性菌株的鉴定
通过对72株菌进行生物活性检测,发现SG15的活性最好,具有5种活性;有3株菌(SI16、SG9、ST1-1)具有4种活性,7株菌(SB2、SP1、SP12、SG2-2、SG16、SG22、ST1-2)具有3种活性,18株菌具有2种活性,20株菌具有1种活性,分别占比1.4%、4.2%、9.7%、25.0%、27.8%(图1)。三种菌中,放线菌的生物活性最好,有活性菌株占总放线菌株的82.1%,占总活性菌株的65.3%,因此放线菌是一类重要的微生物资源。将具有3种及以上活性的菌株列为广谱活性菌株,对细菌、真菌和活性最强的5株放线菌进行鉴定,结果(图2)表明,放线菌均为链霉菌属,SI16、ST1-1、SG9、SG15、SG22分别与Streptomyces acidiscabies(D63865)、Streptomyces parvus(AB184756)、Streptomyces canus(KQ948708)、Streptomyces coacervatus(AB500703)、Streptomyces paradoxus(AB184628)相似度为99.79%、99.86%、99.86%、98.51%、100.00%。细菌SB2为芽孢杆菌属,与Bacillus inaquosorum(AMXN01000021)相似度为99.65%。系统发育分析显示真菌SP1、SP12聚为一簇,均为镰刀菌属,但其形态明显不同,所以可能为不同亚种,还需进一步研究(图3)。
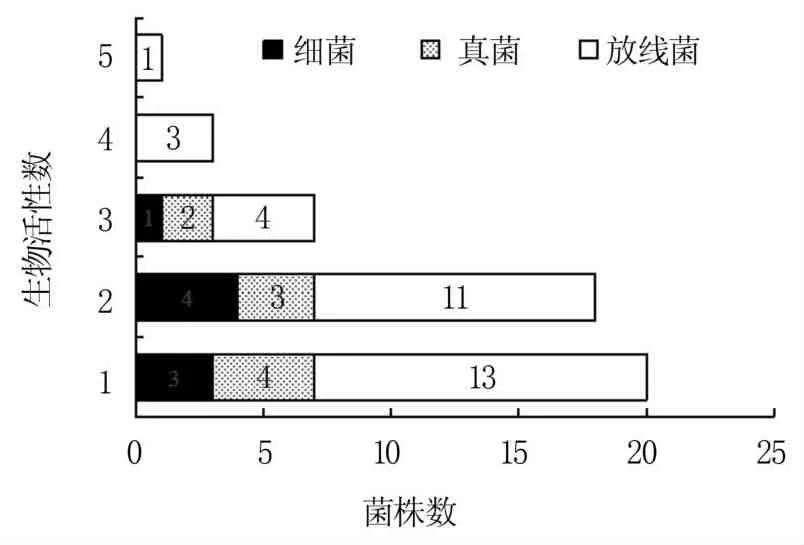
图1 荞麦根际72株菌的生物活性筛选结果

图2 基于16S rRNA基因序列的N-J系统发育树
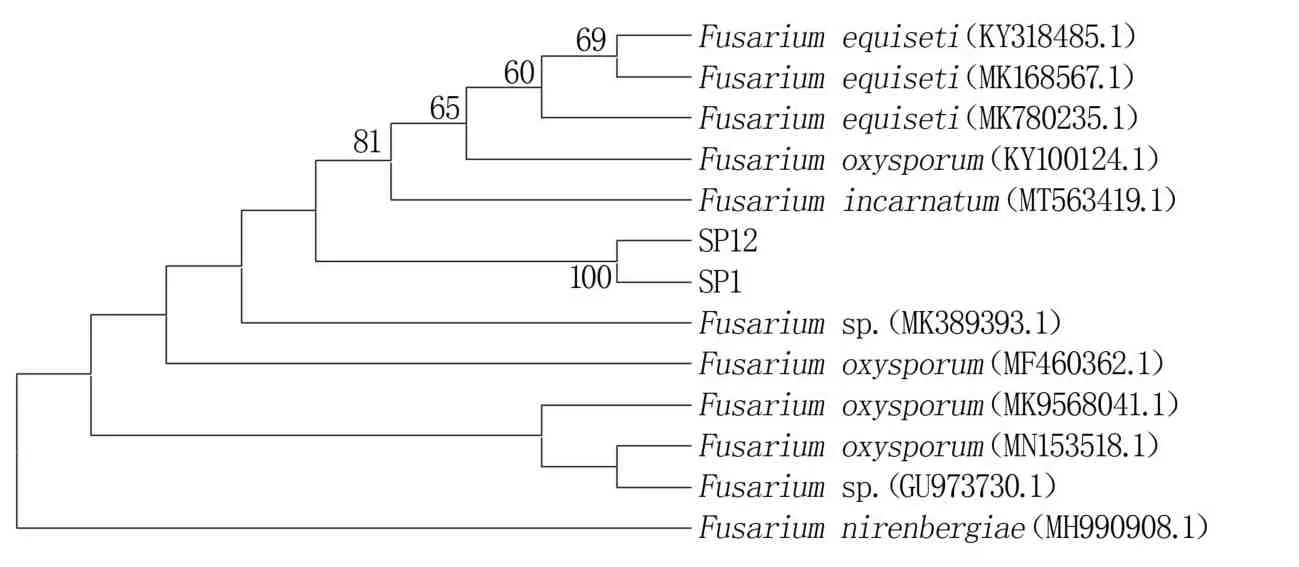
图3 基于ITS序列的N-J系统发育树
3 讨论与结论
自然界土壤中富含大量微生物,实验室条件下的可培养微生物只占很小一部分,未来可通过共培养技术、改善生长条件等获取更多的微生物资源。植物-有益微生物互作对双方均是有利的,根系分泌物可为微生物提供营养来源,而微生物可通过拮抗病原菌、固氮、解磷、解钾、产酶、产植物激素等帮助植物改善生长条件,获取更多养分。不同植物种类、土壤环境、大气条件都可对根际微生物产生影响[9,26]。将有益微生物应用于农业生产有利于改善生态环境及提高经济效益,因此开发未知微生物资源十分重要。
本研究发现放线菌与细菌、真菌相比,生物活性较好,有活性菌株占放线菌总数82.1%,可见放线菌是一类具有重要价值的微生物资源。GA、ISP2、TWYE三种培养基分离的放线菌数量与种类有所不同,ISP2培养基分离数量最多,GA培养基分离的种类最多,因此改变培养基成分可能会对分离效果产生影响。王东胜等[27]向GA培养基添加CaCl2,结果发现某些土样放线菌数量显著减少,但新种类有所增加。因此后期试验可通过改变培养基成分获取荞麦根际更多的放线菌资源。
对于拮抗活性检测,放线菌的抑菌效果最为显著,有活性菌株占放线菌总数69.2%,占荞麦根际总菌株37.5%,且筛选到4株菌同时具有3种拮抗活性。这可能与放线菌可产生大量抗生素有关,抗生素可通过干扰病原菌细胞壁合成、改变细胞内部代谢等来拮抗病原菌。事实上,大部分抗生素都是由放线菌产生的,朱荣贵等[28]从塔里木盆地分离得到18株稀有放线菌,其中14株具有抗生素合成基因。放线菌对革兰氏阳性菌(金黄色葡萄球菌)比对革兰氏阴性菌(大肠杆菌)的抑制力要强,这可能是因为革兰氏阴性菌存在外排泵可降低细胞内抗生素含量,从而降低其敏感性[29]。枯草芽孢杆菌因其天然无害、性能优良,已大量应用于动物饲料中[30]。本试验中芽孢杆菌SB2可拮抗金黄色葡萄球菌、大肠杆菌,与已有报道一致[31];另外菌株SB2还具有良好的解磷活性。微生物来源的蛋白酶与淀粉酶因其种类丰富、生长条件易控等特点在工业上得到广泛应用[32,33]。放线菌SG15的蛋白酶与淀粉酶活性均较好,具有较高的应用潜力。具有解磷活性的菌株中,细菌占比最多(占总解磷菌株70.0%),真菌次之,未检测到有放线菌具有解磷活性,与前人报道[34]相似,具体解磷机制尚不清楚。有研究显示以磷酸钙作为磷源,溶磷圈直径大小并不能代表菌株真实解磷能力[35],因此试验还需进一步对解磷菌株在液体培养基中的解磷能力进行测定。
荞麦根际存在丰富的微生物资源,本研究筛选到11株具有广谱生物活性的微生物菌株,后续可用于开发功能菌肥。

