影响感染科患者发生抗生素相关性腹泻的危险因素分析
胡彩虹 饶先林 吴红娣 陆增生
[摘要] 目的 探讨感染科患者发生抗生素相关性腹泻(AAD)的发病机制及其危险因素,为临床早期预防提供依据。方法 选取2018年6月至2020年10月浙江省立同德医院感染科收治的283例患者进行随访调查,依据其住院期间是否发生AAD将其分为AAD组(77例)和非AAD组(206例);分析感染科患者住院期间的AAD发生率,比较两组患者间的各因素分布差异性,并采用逐步logistic回归法筛选影响感染科患者发生AAD的相关危险因素。结果 283例感染科患者住院期间AAD发生率为27.21%(77/283);影响感染科患者住院期间发生AAD的危险因素包括年龄(OR=3.117)、营养风险(OR=4.035)、病情危重(OR=4.586)、联用抗生素(OR=4.175)、抗生素使用时间(OR=2.807)、住院时间(OR=2.246),而使用微生态制剂(OR=0.483)则为保护性因素。结论 感染科患者住院期间的AAD发生率高达27.21%,应摸清AAD的发病机制及其相关高危因素,早期采取预防措施,降低感染科的AAD发生率,改善患者的预后。
[关键词] 感染科;抗生素相关性腹泻;菌群失调;危险因素
[中图分类号] R969.3 [文献标识码] B [文章编号] 1673-9701(2022)13-0000-04
[Abstract] Objective To explore the pathogenesis and risk factors of antibiotic-associated diarrhea (AAD) in patients with infectious diseases, and to provide evidence for early clinical prevention. Methods A follow-up survey was conducted on 283 patients admitted to the Department of Infectious Disease of Tongde Hospital of Zhejiang Province from June 2018 to October 2020. They were divided into the AAD group (77 patients) and the non-AAD group (206 patients) according to whether AAD occurred during hospitalization. The incidence of AAD during hospitalization was analyzed. The differences in the distribution of various factors were compared between the two groups. The stepwise logistic regression method was used to screen the relevant risk factors of AAD in infectious diseases. Results The incidence of AAD during hospitalization of 283 patients in the Department of Infectious Disease was 27.21% (77/283). The risk factors of AAD during hospitalization in patients in the Department of Infectious Disease included age (OR=3.117), nutritional risk (OR=4.035), critical illness (OR=4.586), combination use of antibiotics (OR=4.175), length of antibiotic use (OR=2.807), and hospitalization length (OR=2.246). The use of probiotics (OR=0.483) was a protective factor. Conclusion The incidence of AAD during hospitalization in the Department of Infectious Disease is as high as 27.21%. The pathogenesis of AAD and related high-risk factors should be investigated. Early preventive measures should be taken to reduce the incidence of AAD in the Department of Infectious Disease and improve the prognosis of patients.
[Key words] Department of Infectious Disease; Antibiotic-associated diarrhea; Flora imbalance; Risk factor
抗生素相關性腹泻(antibiotic-associated diarrhea,AAD)是指患者使用抗生素后发生的一种腹泻,是临床使用抗生素最为常见的不良反应,几乎所有的抗生素都可能引起AAD。AAD在成年人群中的发生率高达5%~30%[1],已逐渐成为感染科室治疗继发性感染的一大难题。AAD类型包括单纯性腹泻、伪膜性肠炎、结肠炎等,如果未及时发现并治疗,可引起严重的并发症,而且病死率高达15%~24%[2]。感染科患者由于发生不同程度的感染,人群分布以中老年患者为主,其身体抵抗力较差,使用抗生素后容易引起菌群失调而导致腹泻;AAD不仅会加重病情、提高病死率,而且会增加患者的经济负担[3];因此,探讨感染科患者AAD的发病机制及其危险因素,为临床早期采取预防对策提供依据十分重要。为此,本研究对浙江省立同德医院收治的283例感染科患者进行随访调查,现报道如下。
1 对象与方法
1.1 研究对象
选取2018年6月至2020年10月浙江省立同德医院感染科收治的283例患者进行随访调查。纳入标准[4]:①年龄≥18岁;②均进行抗生素治疗,且治疗时间≥3 d;③均进行静脉滴注治疗;④均配合随访调查;⑤随访调查资料完整。排除标准[5]:①未进行抗生素治疗者;②接受肠内营养治疗者;③住院期间反复转入重症监护中心者;④入院前就经常发生腹泻者;⑤其他原因导致腹泻者。本随访调查研究得到浙江省立同德医院医学伦理委员会的审批,住院患者对本次随访调查知情同意。进行随访的283例患者中,男154例,女129例;年龄19~89岁,平均(61.43±12.59)岁;高血压81例,糖尿病28例,心脑血管疾病90例;依据患者住院期间是否发生AAD,将其分为AAD组77例、非AAD组206例。
1.2 调查方法
对283例感染科患者在住院期间进行随访调查,收集的资料包含性别、年龄、高血压、糖尿病、心脑血管疾病、营养风险、病情危重、肠外营养、低蛋白血症、联用抗生素、抗生素使用时间、使用第三代头孢、使用微生态制剂(双歧三联活菌胶囊)、使用质子泵抑制剂、住院时间、是否发生AAD等。AAD的诊断标准[6]:入院前无腹泻症状,在使用抗菌药物后,出现了腹泻且次数≥3次/d,并伴有血便、水样便、黏液脓血便或者斑块条索状伪膜等大便,有时伴有发热且体温≥38℃,伴有腹痛、腹部压痛后反跳痛,白细胞计数升高;而大便涂片检查有菌群失调或培养有优势菌群(如金葡球菌、白色念珠菌、梭菌等);纤维结肠镜检查可发现肠壁充血、出血、水肿等。
1.3 统计学方法
选用SPSS 22.0统计学软件进行数据分析,计数资料以[n(%)]表示,采用χ2检验,多因素分析采用逐步logistic回归法,P<0.05为差异有统计学意义。
2 结果
2.1 影响感染科患者发生AAD的单因素分析
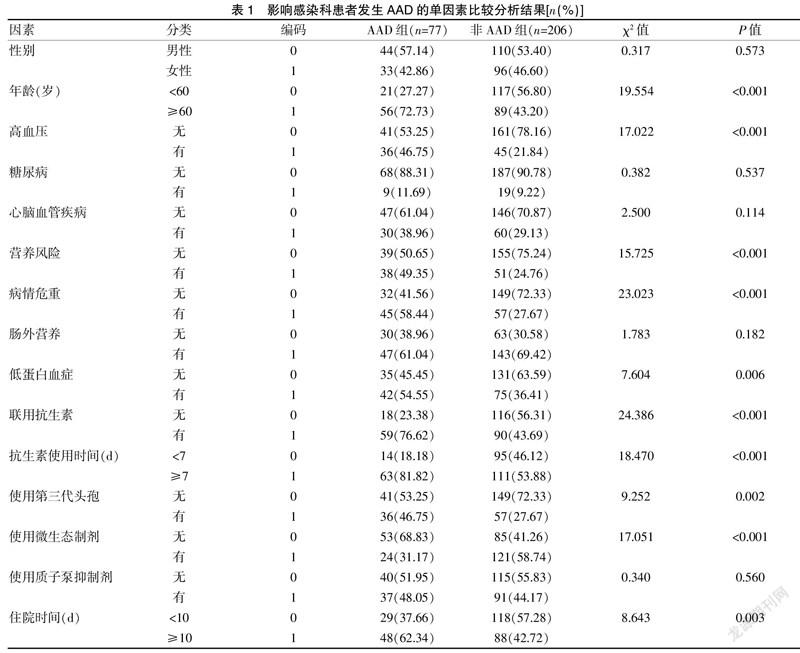
对283例感染科住院患者进行随访调查,住院期间发生AAD的有77例,其发生率为27.21%(77/283)。两组间的年龄、高血压、营养风险、病情危重、低蛋白血症、联用抗生素、抗生素使用时间、使用第三代头孢、使用微生态制剂、住院时间比较,差异有统计学意义(P<0.05),而两组间的性别、糖尿病、心脑血管疾病、肠外营养、使用质子泵抑制剂等比较,差异无统计学意义(P>0.05)。见表1。
2.2 影响感染科患者发生AAD的多因素分析
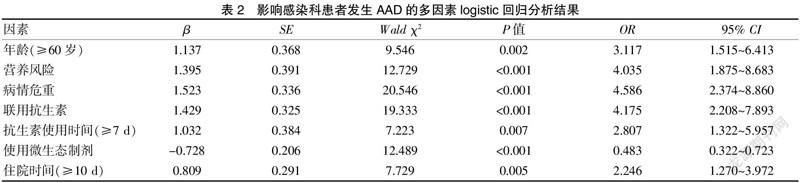
根据感染科患者住院期间是否发生AAD为因变量(非AAD组=0,AAD组=1),将单因素分析有统计学意义的10个因素作为自变量,实施多因素逐步logistic回归分析。影响感染科患者住院期间发生AAD的危险因素包括年龄(≥60岁)、营养风险、病情危重、联用抗生素、抗生素使用时间(≥7 d)、住院时间(≥10 d),而使用微生态制剂则为保护性因素。见表2。
3 讨论
AAD是临床上使用抗生素后发生的一种医源性腹泻,逐渐成为治疗原发性和继发性感染性疾病的一项难题,大多数抗生素药物可导致AAD,并且以克林霉素、第三代头孢、氟喹诺酮类、碳青霉烯类等抗生素最为常见[7],而引起AAD的病原菌以金葡球菌、艰难梭菌、肺炎克雷伯菌、产气荚膜梭菌、白色假丝酵母菌等较为常见[8]。AAD发病机制可能包括如下:①抗生素的直接作用[9]:由于抗生素易引起机体变态反应和毒性作用,均可直接作用肠黏膜损害、肠道上皮纤毛萎缩,从而引起细胞内酶的活性下降,导致肠道黏膜吸收障碍性腹泻。②肠道菌群紊乱[10]:抗生素可破坏人体的肠道正常菌群分布,引起肠道菌群失调,其为导致AAD最为常见的病因,Ⅰ度失调可抑制或者杀灭一部分正常细菌,促进一部分病原菌快速生长,造成了正常菌群在数量上和组成上的异常变化或者移位,而Ⅱ度失调是不可逆性的比例失调,而Ⅲ度失调具体表现为大部分正常菌群被抑制,而少数机会病原菌成为優势状态。③糖代谢和胆汁酸代谢[11]:由于生理性细菌明显减少,使得由糖发酵成短链脂肪酸减少,而没有发酵的糖不容易被吸收,滞留在肠道而诱发渗透性腹泻。本研究显示,283例感染科患者住院期间的AAD发生率为27.21%,这与曾芹静等[12]报道行肠外营养治疗的住院患者AAD发生率为28.24%的结果较为接近,由此可见,AAD应在感染科引起重视。
本研究显示,影响感染科患者发生AAD的危险因素包含如下:①年龄:感染科老年患者较多,由于其生理器官组织结构发生退化,免疫功能下降,胃肠黏膜逐渐发生萎缩,使得胃肠蠕动功能下降且紊乱,患者遭受感染打击后,其机体免疫力会发生进一步下降,再加上广谱抗生素的使用,促使患者肠道菌群失调[13],从而易诱发老年患者发生AAD。②营养风险:患者住院期间进行营养风险评估,其评分低于98分者提示存在营养风险,此类患者存在低蛋白血症、免疫力较低等,在抗生素的作用下,肠道糖代谢和胆汁酸代谢受到抑制,从而引起渗透性AAD[14]。③病情危重:肠外营养是病情危重患者的重要营养治疗方式,长期肠外营养易引起肠道功能损伤、肠道免疫受到抑制、胃肠黏膜受损、肠道通透性增加等[15],加上抗生素的使用可引起患者肠道菌群紊乱,易导致AAD的发生和发展。④联用抗生素:对于危重症感染患者,尤其是脓毒症患者,临床上常常联合使用广谱抗生素、加酶抑制剂类抗生素等,会抑制肠道多数正常菌群,促使耐药菌株的快速繁殖,从而出现菌群紊乱和肠道功能紊乱[16-17],从而导致AAD的发生。⑤抗生素使用时间:感染科患者由于存在各种原发性感染,绝大多数患者需要使用抗生素来抑制感染,对于病情危重患者,使用抗生素的时间越长、抗生素种类越多,这会损伤机体的免疫功能[18],而且易破坏肠道菌群平衡,增加患者AAD发生的风险。⑥使用微生态制剂:微生态制剂又被称为活菌制剂或生菌剂,利用对宿主有益无害的益生菌来促进正常菌群生长,其目的是调整肠道微生态失调,保持肠道生态平衡[19],可起到预防AAD的效果。⑦住院时间:患者住院时间越长,反映患者病情较重,住院期间使用的抗生素的类型较多、时间越长、侵入性操作也越多等[20],导致肠道黏膜受损、肠道功能紊乱等,从而易发生AAD。
综上所述,感染科患者AAD发生率较高、病因机制较为复杂、高危因素较多,为了降低感染科患者的AAD发生率,建议采取如下防治措施:积极控制原发性感染,治疗基础疾病,加强营养,提高自身机体免疫力;严格把握抗菌药物应用指征,合理选择抗生素,在抗感染治疗过程中应根据病情及时调整抗生素,当感染控制及病情好转及时停用抗生素,避免长期联用广谱抗生素;预防性给予微生态制剂治疗,维持肠道正常菌群的平衡,抑制致病菌或腐败菌的生长;采用综合康复治疗措施,促进病情快速恢复,缩短住院时间,减少院内感染风险。
[参考文献]
[1] 王悦之,赵坚,张玉.高龄老年患者抗生素相关性腹泻的临床观察及易感因素分析[J].胃肠病学和肝病学杂志,2020,29(12):1391-1394.
[2] Squellati R. Evidence-based practice in the treatment for antibioticassociated diarrhea in the intensive care unit[J].Crit Care Nurs Clin North Am,2018,30(1):87-99.
[3] Shen NT,Maw A,Tmanova LL,et al. Timely use of probiotics in hospitalized adults prevents clostridium difficile infection: A systematic review with Meta-regression analysis[J].Gastroenterology,2017,152(8):1889-1900.
[4] Singer P,Blaser AR,Berger M,et al. ESPEN guidenline on clinical nutrition in the intensive care unit[J].Nutr,2019,38(1):48-79.
[5] 王硕,张志华.抗生素相关性腹泻病原菌的检测方法[J].临床荟萃,2020,35(4):369-372.
[6] 中华人民共和国卫生部.医院感染诊断标准[J].中华医学杂志,2001,81(5):314-320.
[7] Shimizu Y. Gut microbiota in common elderly diseases affecting activities of daily living[J].World J Gastroenterol,2018,24(42):4750-4758.
[8] Mcfarland LV,Ozen M,Dinleyicie C,et al. Comparison of pediatric and adult antibiotic-associated diarrhea and Clostridium difficult infections[J].Aliment Pharmacol Ther,2016,43(10):1025-1034.
[9] 赵小利,连亚楠,李萌,等.多药耐药菌混合感染重症患者的个体化抗感染治疗研究[J].中华医院感染学杂志,2017,27(13):3002-3005.
[10] 岳灵.基于16S rDNA测序研究电针大肠俞募穴调整功能性腹泻大鼠肠道菌群紊乱的作用机制[D].成都:成都中医药大学,2019.
[11] 武楠,阮小蛟,胡婉珍,等.胆汁酸途径可能介导胃旁路术改善糖代谢[J].中华肥胖与代谢病电子杂志,2020,6(4):243-246.
[12] 曾芹静,严向锋,张海萍,等.行肠外营养治疗的ICU重症患者发生抗生素相关性腹泻的影响因素分析[J].中华实用诊断与治疗杂志,2021,35(1):52-55.
[13] 马晓妍,于娜,张静,等.老年患者发生抗生素相关性腹泻的易感因素分析[J].重庆医学,2017,46(20):2829-2830.
[14] 陈启仪,田宏亮,杨波,等.菌群移植联合肠内营养治疗顽固性腹泻伴重度营养不良71例疗效分析[J].中国实用外科杂志,2019,39(11):1199-1202,1215.
[15] 任会娜,黄文祥.肠外营养相关性肝病的研究进展[J].中华肝脏病杂志,2017,25(7):557-560.
[16] Liu Y,Jin G,Sun JJ,et al. Recombinant human thrombopoietin in critically ill patients with sepsis-assocciated thrombocytopenia: A clinical study[J].Int J Infect Dis,2020,98(1):144-149.
[17] 吳朝,董晓琴,赵鸿,等.脓毒症及脓毒性休克诊断与治疗研究进展[J].中华实用诊断与治疗杂志,2018,32(11):1126-1128.
[18] 岑丽莲,李南洋,黄玉环,等.老年重症细菌性肺炎患者抗生素相关性腹泻影响因素分析[J].内科,2019,14(4):487-489.
[19] 王威,岳妍,郝莉莉,等.微生态制剂治疗抗生素相关性腹泻临床研究[J].中华医院感染学杂志,2016,26(6):1258-1260.
[20] 郑晓青,祝焕杰,赵骏,等.呼吸内科住院患者抗生素相关性腹泻的临床特征及危险因素分析[J].浙江医学,2020, 42(18):1981-1983,1987.
(收稿日期:2021-05-10)

