曲安奈德外用对特应性皮炎-哮喘模型小鼠MIF、IgE表达及气道高反应性的影响
戚敏敏 宁维翾 应航宇
[摘要] 目的 探讨曲安奈德(TAA)外用对特应性皮炎(AD)-哮喘模型小鼠巨噬细胞移动抑制因子(MIF)、免疫球蛋白E(IgE)表达及气道高反应性的影响。 方法 制备AD-哮喘模型,成模小鼠随机分为模型(M)组、TAA组,另选取用生理盐水处理的小鼠为正常对照(NC)组,每组各12只。酶联免疫吸附试验(ELISA)检测血清及肺泡灌洗液(BALF)中白细胞介素-4(IL-4)、干扰素-γ(IFN-γ)、IgE及MIF表达水平。 结果 与NC组比较,M组小鼠气道高反应性、BALF细胞总数、嗜酸性粒细胞数、血清及BALF中IL-4、MIF、IgE水平均增加(P<0.05),BALF中淋巴细胞、单核细胞数、血清及BALF中IFN-γ水平减少(P<0.05);与M组比较,TAA组小鼠气道高反应性、BALF细胞总数、嗜酸性粒细胞数、血清及BALF中IL-4、MIF、IgE水平均降低(P<0.05),BALF中淋巴细胞、单核细胞数、血清及BALF中IFN-γ水平增加(P<0.05)。 结论 TAA可减轻AD-哮喘模型小鼠皮肤炎症及气道高反应性,可能与调节Th1/Th2平衡和降低MIF、IgE表达有关。
[关键词] 曲安奈德;特应性皮炎;巨噬细胞移动抑制因子;免疫球蛋白E
[中图分类号] R246.7 [文献标识码] A [文章编号] 1673-9701(2022)13-0020-05
[Abstract] Objective To explore the effect of external use of triamcinolone acetonide (TAA) on the expression of MIF and IgE and airway hyperresponsiveness in atopic dermatitis-asthma model mice. Methods The AD-asthma model was prepared. The model mice were randomly divided into the model (M) group and the TAA group, and other mice treated with saline were selected as the normal control (NC) group, with 12 mice in each group. Enzyme-linked immunosorbent assay (ELISA) was used to detect the expression levels of interleukin-4 (IL-4),interferon-γ(IFN-γ),IgE and MIF in serum and bronchoalveolar lavage fluid (BALF). Results Compared with the NC group, the airway hyperresponsiveness, total number of BALF cells, number of eosinophils, and levels of IL-4,MIF and IgE in serum and BALF were increased in the M group (P<0.05),and the number of lymphocytes and monocytes in BALF,and IFN-γ level in BALF were decreased in the M group(P<0.05).Compared with the M group, the airway hyperresponsiveness, total number of BALF cells, number of eosinophils, and levels of IL-4,MIF,and IgE in serum and BALF were decreased in the TAA group(P<0.05), and the number of lymphocytes and monocytes in BALF,and IFN-γ level in serum and BALF were increased in the TAA group(P<0.05). Conclusion TAA can reduce skin inflammation and airway hyperresponsiveness in AD-asthma model mice,which may be related to regulating Th1/Th2 balance and reducing the expression of MIF and IgE.
[Key words] Triamcinolone acetonide; Atopic dermatitis; Macrophage migration inhibitory factor; Immunoglobulin E
特應性皮炎(atopic dermatitis,AD)是一种慢性过敏性疾病,易复发且伴随剧烈瘙痒症状,严重影响患者的生活质量,近年来AD发病率呈持续增长趋势[1]。值得关注的是AD在青少年及成人阶段常并发哮喘或过敏性鼻炎等炎症性气道过敏性疾病,多项研究发现,AD是哮喘发生的重要危险因素,但其发病机制尚不明确[2]。AD是皮肤科常见难治性疾病,并发哮喘更是增加治疗难度,目前临床尚无特效疗法。研究发现,AD-哮喘多以2型辅助性T细胞(T helper 2type cell,Th2)介导的免疫应答为主,存在免疫球蛋白E(immunoglobulin E,IgE)及Th2型细胞因子分泌升高,嗜酸性粒细胞增多[3],而巨噬细胞移动抑制因子(macrophage migration inhibition factor,MIF)在哮喘等自身免疫性疾病发生过程中发挥重要促炎、免疫抑制作用[4-5]。曲安奈德(triamcinolone acetonide,TAA)是一种具有抗炎、抗过敏及免疫抑制作用的中效型糖皮质激素,具有皮肤渗透性,且局部用药可避免全身激素应用副作用,可用于治疗各种皮肤病及口腔溃疡等疾病[6-8],对儿童AD治疗有一定效果[9],但目前关于TAA对AD-哮喘的作用尚无报道。因此本研究通过建立AD-哮喘小鼠模型,拟探究TAA外用涂抹局部皮损处的治疗作用及对AD-哮喘模型小鼠MIF、IgE表达及气道高反应性的影响,以期揭示其作用机制,为临床AD-哮喘治疗提供新的方案及实验依据。C5BBB0AC-E93A-4337-8604-5BEA963A4FF7
1 材料与方法
1.1 实验动物
6 周龄雄性SPF级BALB/c小鼠,体重16~18 g,由广东省医学实验动物中心提供,动物许可证号:SYXK(粤)2018-0002。本研究经医院动物伦理委员会批准通过。
1.2 主要试剂及仪器
曲安奈德益康唑乳膏,规格:曲安奈德1 mg,硝酸益康唑10 mg,国药准字H20074155,购自华润三九(南昌)药业有限公司;卵清蛋白(ovalbumin,OVA,货号:A5503)、二硝基氯苯(dinitrochlorobenzene,DNCB,货号:101397)、乙酰甲胆碱(methacholine,Mch,货号:PHR1943)均购自Sigma-Aldrich公司;白细胞介素-4(interleukin-4,IL-4)ELISA试剂盒(货号:ab221833)、干扰素-γ(interferon-γ,IFN-γ)ELISA试剂盒(货号:239425)、IgE ELISA试剂盒(货号:ab157718)及MIF ELISA试剂盒(货号:ab209885)均购自英国Abcam公司;Flexivent小动物肺功能仪购自法国EMKA公司;FC型酶标仪购自美国Thermo Fisher公司等。
1.3 方法
1.3.1 造模及分组 BALB/c小鼠适应性饲养1周后,参照文献制备AD-哮喘模型小鼠[10],具体方法:小鼠进行背部脱毛,面积约2 cm×3 cm,实验前2 d小鼠背部脫毛区涂抹25 ml 7% 二硝基氯苯DNCB,第6~8天小鼠背部脱毛区涂抹40 ml 1% DNCB,其中每4 d涂抹40 ml OVA(40 g OVA)诱导特应性皮炎。21~27天小鼠通过气道雾化吸入1% OVA,30 min/d,诱导哮喘模型。成模小鼠随机分为模型(M)组、曲安奈德(TAA)组,另选取用生理盐水处理的小鼠为正常对照(NC)组,每组各12只。NC组、M组小鼠正常饲养无任何治疗,TAA组小鼠在21~27 d通过气道雾化吸入1% OVA后1 h,背部脱毛区进行TAA膏涂抹,每天1次。末次涂抹治疗48 h后评估各组小鼠气道高反应,采集血清、皮损处组织、肺泡灌洗液(bronchoalveo larlavage fluid,BALF)、肺组织标本进行相关指标检测。
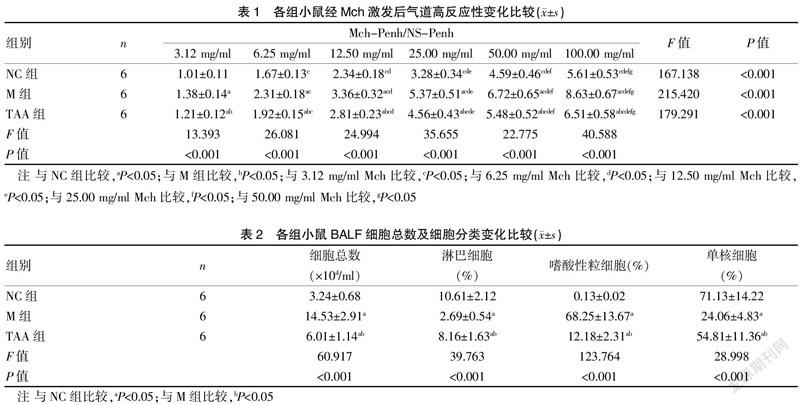
1.3.2 气道高反应性测定 治疗结束后48 h,采用小动物肺功能仪测定小鼠气道阻力,记录小鼠气道阻力基础值1 min后,测定30 ml生理盐水(normal saline,NS)和30 ml不同浓度(3.12 mg/ml、6.25 mg/ml、12.50 mg/ml、25.00 mg/ml、50.00 mg/ml、100.00 mg/ml)乙酰甲胆碱(Mch)雾化激发后小鼠气道阻力变化,每次雾化1 min,记录3 min。以NS增强的呼吸间歇(enchanced pause,Penh)为标准值,以Mch-Penh/NS-Penh比值作为评价气道高反应性的统计指标。
1.3.3 皮损组织炎症评估 观察小鼠皮损处外观表现。麻醉处死各组小鼠,采集皮损组织置于10%甲醛中进行固定、石蜡包埋,切片后进行苏木精-伊红染色法(hematoxylin-eosinstaining,HE)染色,光镜下观察皮损病理学变化。
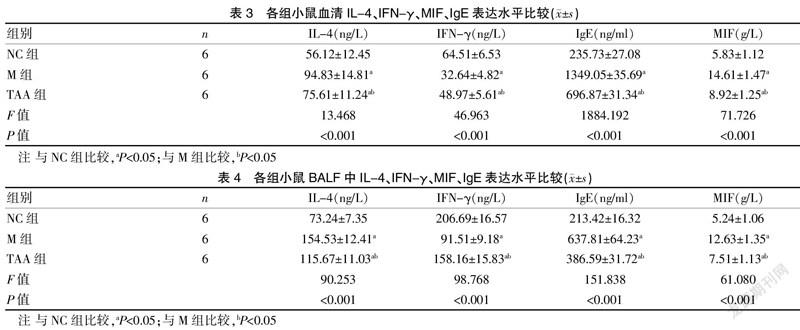
1.3.4 BALF中细胞计数及分类 处死小鼠后,行气管插管,用预冷8 ml PBS灌洗,收集BALF,取1 ml进行500 r/min离心5 min,吸取细胞沉淀,PBS重悬后进行总细胞计数,部分细胞悬液甩片后吉姆萨染色,进行细胞分类计数。
1.3.5 肺组织病理学变化检测 留取右肺组织,10%甲醛固定、石蜡包埋、切片后进行HE染色,于光镜下观察肺组织病理学变化。
1.3.6 血清及BALF中IL-4、IFN-γ、MIF、IgE水平检测 采集各组小鼠动脉血,常规离心后留取血清。采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清及BALF中IL-4、IFN-γ、MIF、IgE表达水平,具体步骤严格按照试剂盒说明书进行。
1.4 统计学方法
采用SPSS 25.0统计学软件对实验数据进行分析。计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,任意两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠皮肤组织病理学变化
NC组小鼠背部皮肤基本正常,HE染色无明显病理改变;M组小鼠背部皮肤可见明显红斑、鳞屑,HE染色发现皮损处组织表皮角化不全、棘细胞层明显增厚,有大量炎性细胞浸润;TAA组小鼠皮肤外观及HE染色病理变化较M组减轻。见封三图10~11。
2.2 各组小鼠肺组织病理学变化
NC组小鼠肺组织无明显病理变化,M组小鼠可见支气管周围及肺泡间隔区均有大量炎性细胞,TAA组炎性细胞明显减少。见封三图12。
2.3 各组小鼠气道高反应性变化
给予不同浓度Mch吸入后,NC组、M组、TAA组小鼠气道高反应性均呈上升趋势(P<0.05)。同一浓度Mch作用下,与NC组比较,M组小鼠气道高反应性显著升高(P<0.05);与M组比较,TAA组小鼠气道高反应性显著降低(P<0.05)。见表1。
2.4 各组小鼠BALF细胞总数及细胞分类变化
与NC组比较,M组小鼠BALF细胞总数、嗜酸性粒细胞数显著增加,淋巴细胞、单核细胞数显著减少(P<0.05);与M组比较,TAA组小鼠BALF细胞总数、嗜酸性粒细胞数显著减少,淋巴细胞、单核细胞数显著增加(P<0.05)。见表2。C5BBB0AC-E93A-4337-8604-5BEA963A4FF7

