超声检查与SPECT/CT显像在分化型甲状腺癌术后残留甲状腺组织诊断中的应用价值比较
戚新春,朱 洁
(1.陕西省肿瘤医院头颈肿瘤科,陕西 西安 710061;2.延安大学附属医院CT诊断科,陕西 延安 716099)
甲状腺癌为比较常见的恶性肿瘤,也是头颈部常见的恶性肿瘤之一,在所有恶性肿瘤中构成比为1.4%左右[1-2]。分化型甲状腺癌(Differentiated thyroid carcinoma,DTC)为甲状腺癌的主要类型之一,当前其发病率持续上升。DTC保留了甲状腺滤泡上皮细胞的部分功能,如钠碘转运体表达及摄碘能力、分泌甲状腺球蛋白(Thyroglobulin,Tg)能力、依赖促甲状腺激素生长表达等,预后相对比较好,在病理类型上包括甲状腺乳头状癌和滤泡状癌[3-4]。手术为甲状腺乳头状癌的主要治疗方法,绝大多数患者通过手术治疗能获得良好的预后,但也有部分患者出现术后残留甲状腺组织,导致甲状腺癌转移或复发,影响患者的预后及生存[5]。早期检测与诊断为术后残留甲状腺组织,能够及时进行对症处理,对改善患者预后具有重要价值[6]。超声为甲状腺癌的主要诊断方法,但是手术可导致病灶结构紊乱,且超声的组织分辨率比较低,因此对于术后残留甲状腺组织的诊断比较困难[7-8]。SPECT/CT显像为当前比较先进的诊断方法,也为一种全身平面显像方法,具有低辐射、不干扰后续治疗的优点,能清晰显示残留甲状腺组织与性质,还可显示平面显像中由于重叠灶而不能显示的病灶,从而为患者的早期诊断提供参考[9-10]。本研究具体探讨超声与SPECT/CT显像在DTC术后残留甲状腺组织中的应用价值,希望为患者的早期临床诊断提供参考。
1 资料与方法
1.1 一般资料 选择2018年9月至2021年5月在本院完成手术治疗的DTC患者82例为研究对象,其中男性22例,女性60例;年龄16~68岁,平均(54.01±4.09)岁;左侧42例,右侧42例;平均体重指数(23.83±1.22)kg/m2;甲状腺全切除术65例,甲状腺次全切除术17例;平均病灶直径(3.49±0.14)cm;甲状腺乳头状癌72例,滤泡状癌10例。病例纳入标准:临床资料完整;病理诊断为DTC;顺利完成手术,术中无严重并发症;签署了知情同意书;年龄16~70岁;单侧手术患者。排除标准:临床资料不完整者;认知功能障碍或精神疾病者;处于妊娠期、哺乳期及短期内计划妊娠者;无法依从辐射隔离防护指导者;合并其他肿瘤或者其他严重疾病者;髓样癌、胸腺样癌及其他未分化类型的甲状腺癌者。医院伦理委员会批准了本研究。
1.2 研究方法
1.2.1 超声检查:所有患者在术后6个月采用GE512彩色多普勒超声(探头频率4~5 MHz)给予检查。患者取仰卧位姿势,检查患者甲状腺部位,观察甲状腺的结构、内部回声、大小、形态、位置等特征,同时通过多切面血流状况分析其钙化情况。
1.2.2 SPECT/CT显像:所有患者在超声后采用Philips公司Precence型SPECT/CT给予检查,其中CT为32层螺旋CT,配置高能平行孔准直器。显像剂为碘(131I)化钠口服溶液,购自成都中核高通同位素股份有限公司。患者口服131I 30~150 mBq,7 d后进行显像。检查时取下金属及高密度物品,排空尿液。SPECT/CT显像参数:电流2.5 mA,电压140 kV,矩阵256×1024,窗宽20%,扫描速度10 cm/min。对患者颈部先使用SPECT平面显像,再使用SPECT/CT融合显像,最后对患者的平面显像和断层融合显像进行后融合处理。
1.3 观察指标 ①以术后病理检查作为金标准,判断术后残留甲状腺组织发生情况,并据此将患者分为残留组与非残留组。由2名有经验的核医学医师判读SPECT/CT融合显像,意见不一致时,协商直至达成一致。术后残留甲状腺组织标准:放射性药物聚集于CT 所示甲状腺床部位。由2名有经验的超声医师判断超声图像,意见不一致时,协商直至达成一致。②比较两组患者131I剂量与血清促甲状腺激素(TSH)、Tg水平。③比较残留组与非残留组两种检查方法的准确率。④分析超声检查与SPECT/CT显像在DTC术后残留甲状腺组织中的诊断价值。
1.4 统计学方法 采用SPSS 28.00统计学软件分析资料,计量与计数资料分别采用均数±标准差、[例(%)]表示,行t检验与卡方检验。诊断价值分析采用受试者工作特征(ROC)曲线分析。检验水准α=0.05。
2 结 果
2.1 术后残留甲状腺组织发生情况 在82例患者中,术后发生残留甲状腺组织12例(残留组),发生率为14.6%,未发生残留甲状腺组织70例(非残留组)。
2.2 残留组与非残留组患者131I剂量及TSH、Tg水平比较 见表1。残留组131I剂量及TSH、Tg水平高于非残留组(均P<0.05)。
表1 残留组与非残留组131I剂量及TSH、Tg水平比较
2.3 残留组与非残留组两种检查方法准确率比较 见表2。在12例患者中,超声诊断为术后残留甲状腺组织8例,SPECT/CT显像诊断为术后残留甲状腺组织11例。SPECT/CT显像诊断术后残留甲状腺组织的准确率高于超声检查(χ2=3.556,P=0.038)。
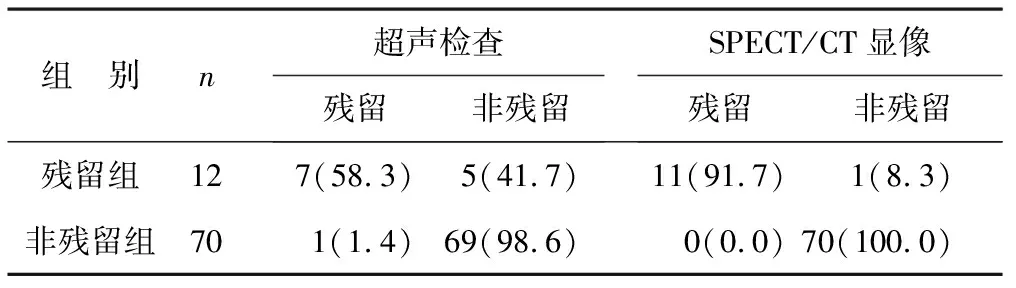
表2 残留组与非残留组两种检查方法准确率比较[例(%)]
2.4 超声与SPECT/CT对DTC术后残留甲状腺组织的诊断价值 见图1。ROC曲线分析显示,超声与SPECT/CT显像诊断DTC术后残留甲状腺组织的曲线下面积分别为0.635和0.899,约登指数分别为0.625和0.833。
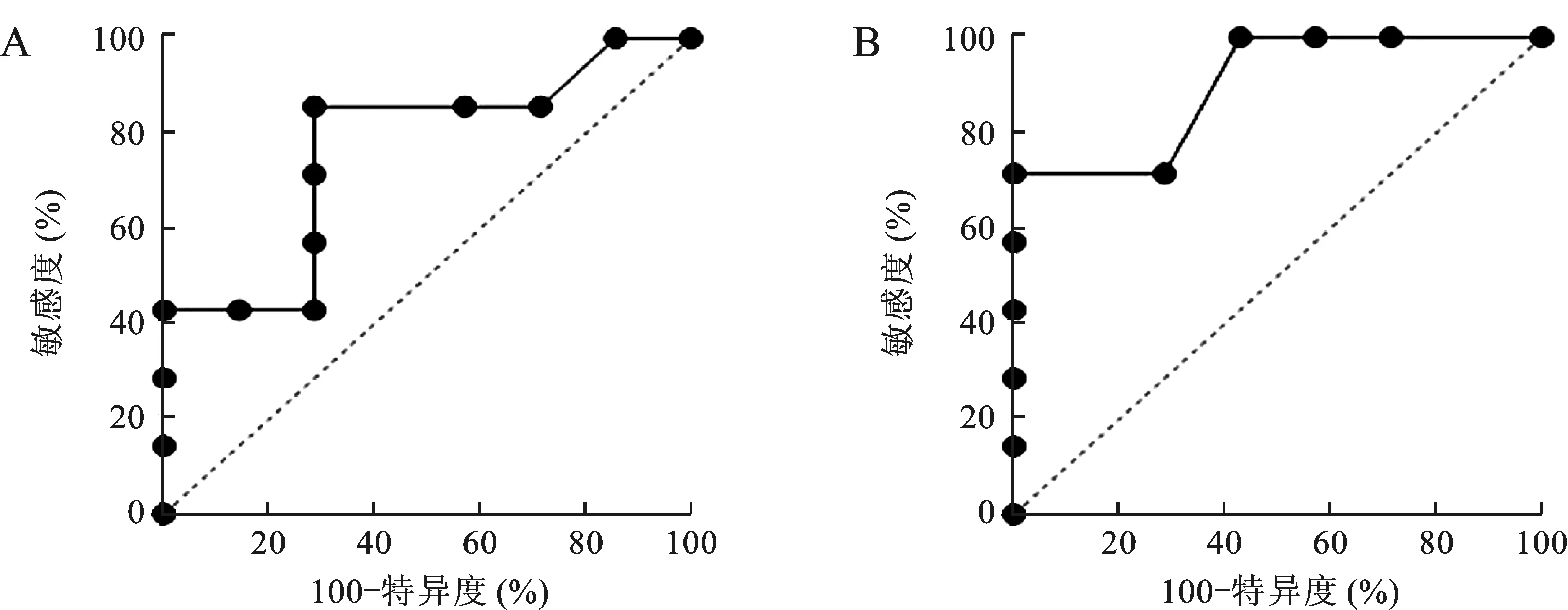
图1 超声(A)和SPECT/CT显像(B)诊断DTC术后残留甲状腺组织ROC曲线
3 讨 论
DTC是头颈部常见恶性肿瘤,女性发病率明显高于男性,男女比例约1∶3。手术为DTC的主要治疗方法,可根据患者的病情选择甲状腺全切除术、甲状腺次全切除术等,能显著提高患者的预后生存率,但是仍有20.0%的患者在治疗后出现复发或残留,其中有10.0%的患者死于复发或残留[11]。有研究[12]显示,远处转移是甲状腺癌患者病死的主要原因,包括淋巴结转移、全身转移与骨转移。DTC患者转移率及病死率均呈上升趋势。颈部淋巴结残留是造成甲状腺癌患者术后复发的主要原因,年龄、淋巴结转移、肿瘤外侵程度、首次手术方式、肿瘤分期等因素与复发率密切相关,多数患者在术后3个月至3年内复发[13-14]。本研究显示,在82例患者中,术后发生残留甲状腺组织12例,发生率为14.6%。当前也有研究[15]建议甲状腺癌患者术后定期复诊1~3年,以便快速了解病灶复发情况,及时接受治疗,改善患者的预后。
手术病理为诊断DTC术后残留甲状腺组织的金标准,但是属于创伤性检查,且诊断时间比较长。超声诊断根据多种征象可对术后残留甲状腺组织进行诊断,但具有一定的漏诊率,且超声操作医师的主观判断性比较强[16]。SPECT/CT显像可追踪显示颈部放射性示踪剂的分布,评估术后残存甲状腺组织情况,还可反映甲状腺的摄取功能[17-18]。本研究显示,残留组患者131I剂量与血清TSH、Tg水平高于非残留组;超声诊断术后残留甲状腺组织的准确率为58.3%,SPECT/CT显像诊断术后残留甲状腺组织的准确率为98.6%,后者明显高于前者。从机制上分析,SPECT/CT显像可帮助发现具有摄碘功能的颈部淋巴结或远处转移病灶,从而帮助患者进行复发风险及再分期分层,为后续治疗及病情随访计划的制订提供更可靠的依据[19]。DTC患者由于肿瘤细胞的分化程度较高,因此长期存活率比较高[20]。但是滤泡状癌是典型的具有包膜的孤立结节,容易发生全身转移;乳头状甲状腺癌易发生淋巴结转移。早期发现甲状腺组织残留非常重要,明确诊断对改善患者预后有重要价值[21-22]。ROC曲线分析显示,超声与SPECT/CT显像诊断DTC术后残留甲状腺组织的曲线下面积分别为0.635和0.899,约登指数分别为0.625和0.833。超声诊断颈部淋巴结扫描范围较窄,又因肉芽肿及局部水肿的出现导致局部结构紊乱,病灶扫描缺失,因此会降低诊断效果。SPECT/CT显像常可灵敏、准确地显示残余甲状腺组织及转移灶,有利于早期发现复发或新的转移病灶。不过部分癌灶隐匿且较小,分辨率低的仪器可能无法发现有摄碘能力的小癌灶;很多131I被残余甲状腺组织摄取,转移灶摄取较少,不易被发现,并且体内稳定碘影响了癌灶摄取131I的能力[23-24]。
综上所述,相对于超声,SPECT/CT显像对DTC术后残留甲状腺组织的诊断价值更高,能及时发现残留部位。

