5-脂氧合酶激活蛋白在食管鳞状细胞癌组织中的表达及临床意义
李 玲,白春英,张俊毅,史铁伟,马迎平
(1.锦州医科大学赤峰学院研究生培养基地,内蒙古 赤峰 024099;2.赤峰市医院感染科,内蒙古 赤峰 024099;3.内蒙古人类遗传病研究重点实验室,内蒙古 赤峰 024099;4.赤峰学院附属医院病理科,内蒙古 赤峰 024099;5.赤峰市医院肝胆外科,内蒙古 赤峰024099)
手术虽是食管鳞状细胞癌(Esophageal squamous cell carcinoma,ESCC)的首选治疗手段,但仅可清除ESCC患者已生成的肿瘤组织,术后仍有较高的转移、复发风险,不仅影响整体的手术治疗效果,部分患者甚至面临二次手术风险,治疗难度加大,可增加患者病死风险[1-2]。研究[3]证实,多数ESCC患者预后欠佳,生存率低下,且患者的预后和生存情况与其TNM分期、淋巴结转移等密切相关。因而,早期预估复发转移风险并指导治疗对减少复发转移、改善预后意义重大。有研究[4]指出,花生四烯酸与白三烯等脂类物质代谢异常在ESCC的发生、发展中发挥关键性作用,脂代谢通路上的酶及其代谢产物可介导炎症反应、促进肿瘤细胞增殖等因素均可能参与了ESCC发生的病理过程。5-脂氧合酶激活蛋白(Five lipoxygenase activating protein,FLAP)是花生四烯酸与白三烯等脂类物质代谢通路中关键的酶[5]。有研究[6]指出,FLAP的基因位点突变与肿瘤的发生密切相关,同样,FLAP的表达抑制也可诱导肿瘤细胞发生凋亡。结合上述信息,推测FLAP在ESCC患者中也有一定的表达,且可能与疾病临床病理特征有一定关系。因此,本研究主要观察ESCC患者癌组织内FLAP表达情况,分析FLAP表达与ESCC及其临床病理特征的关系及临床意义。
1 资料与方法
1.1 一般资料 收集2007年1月至2011年1月期间就诊于赤峰学院附属医院并经胃镜、手术病理等检查确诊为ESCC的297例患者癌组织标本,并选取其中66例患者的癌旁相对正常的食管组织标本。297例患者中,男性232例,女性65例;年龄57~61岁,中位数59(58,60)岁;肿瘤直径2.4~11.25 cm,平均(6.87±1.03)cm;TNM分期[7]中,Ⅰ期28例,Ⅱ期136例,Ⅲ期133例,Ⅳ期0例;高分化45例,中分化227例,低分化25例;发生淋巴结转移147例。病例纳入标准:①符合《中国早期食管鳞状细胞癌及癌前病变筛查与诊治共识(2015年·北京)》[8]中ESCC相关诊断标准,并均经影像学、病理学检查确诊;②均接受手术治疗;③预计生存时间>3个月。排除标准:①其他恶性肿瘤者;②术前接受放、化疗者;③既往有胸部手术史,且有胸腔粘连者;④有精神障碍或心理疾病,无法配合研究内相关检查者;⑤合并全身感染性、自身免疫性疾病者;⑥伴有中枢神经系统广泛性转移者。所有患者对本研究知情且同意。本研究已通过医院伦理委员会审批。
1.2 研究方法
1.2.1 标本制备:全部患者均通过手术采取食管癌组织及癌旁组织标本(即距肿瘤边缘>5 cm的食管组织)。将选取的石蜡切片连续切片(4 μm),每张石蜡块切4张片,经苏木精染色,漂白后干燥。
1.2.2 免疫组织化学染色:使用FLAP抗体(批号:CA92124,美国abgent公司,稀释滴度为1∶100)、超高分子检测试剂盒和液体基质试剂盒(美国Invitrogen公司)进行免疫组化染色。石蜡切片脱蜡至水,使用3%过氧化氢-甲醇封闭30 min,并采用柠檬酸缓冲液进行漂洗。漂洗10 min后进行抗原修复。使用3%过氧化氢溶液处理10 min,去除内源性过氧化物酶,在FLAP抗体湿盒中孵育过夜,二氨基联苯胺显色,再使用苏木精复染,最后使用光学显微镜进行观察及显微图像摄影。判定标准包括依据染色强度和依据癌组织中阳性细胞数两种。依据染色强度:无染色,0分;弱染色,1分;中度染色,2分;强染色,3分。依据癌组织中阳性细胞数:<5%,0分; 5%~25%,1分; 26%~50%,2分; 51%~75%,3分;>75%,4分。将染色强度和癌组织中阳性细胞数的分数相乘得出最终评分:0~2分表示FLAP低表达,即阴性;3~12 分表示FLAP高表达,即阳性。

2 结 果
2.1 ESCC患者癌旁组织和癌组织FLAP阳性率比较 297份ESCC组织标本中,有223例FLAP呈阳性表达,阳性率为75.08%;66份癌旁组织标本中,有13例FLAP呈阳性,阳性率为19.70%。ESCC组织标本FLAP阳性率高于癌旁组织标本(χ2=72.830,P<0.05)。ESCC患者癌旁组织和癌组织免疫组化染色结果见图1。
2.2 不同临床病理特征ESCC患者FLAP阳性率比较 见表1。肿瘤细胞转移扩散患者的FLAP阳性率高于肿瘤细胞未转移扩散患者,TNM Ⅲ期患者的FLAP阳性率高于Ⅰ-Ⅱ期患者,低分化患者的FLAP阳性率低于中、高分化患者(均P<0.05)。中、高分化患者间以及Ⅰ、Ⅱ期患者间的FLAP阳性率比较,差异无统计学意义(均P>0.05)。
2.3 FLAP阳性表达与ESCC患者不同临床病理特征的相关性分析 见表2。经Kendall相关性检验, ESCC患者肿瘤细胞转移扩散、TNM分期与FLAP阳性表达呈正相关,分化程度与FLAP阳性表达呈负相关(均P<0.05)。

A:FLAP在癌旁组织中阳性表达;B:FLAP在ESCC组织中弱阳性表达;C:FLAP在ESCC组织中阳性表达;D:FLAP在ESCC组织中强阳性表达
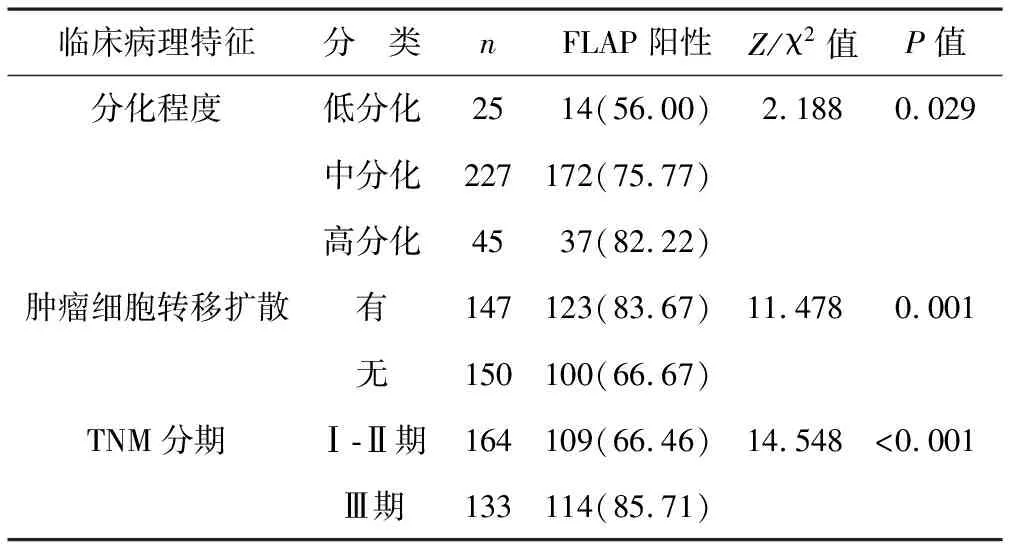
表1 不同临床病理特征ESCC患者FLAP阳性率比较[例(%)]

表2 FLAP阳性表达与ESCC患者不同临床病理特征的相关性
3 讨 论
文献[9]指出,ESCC患者术后生存率较低,原因可能与术后肿瘤细胞复发、转移和扩散等有关。因此,寻找可反映ESCC预后的相关指标对指导后期治疗方案的拟定、改善预后、延长生存时间具有积极意义。
研究[10-11]发现,ESCC的发生、发展与炎症反应、酶代谢通路等相关。花生四烯酸代谢通路的代谢产物为白三烯。白三烯是一种炎症刺激因子,不仅可促进黏液分泌,还可促进平滑肌收缩,增加血管通透性,同时可使白细胞聚集,促进纤维细胞的增殖,在炎症反应过程中发挥关键性作用[12]。FLAP是花生四烯酸代谢通路中的一个关键酶,可借助激活5-脂氧合酶(5-LO),同时给5-LO提供底物,将花生四烯酸呈递给5-LO,继而生成5-氢过氧化二十碳四烯酸,促进白三烯A4的合成与分泌,同时可通过水解酶和合成酶作用产生白三烯B4、 白三烯C4、白三烯D4和白三烯E4[13-14]。并且FLAP可诱导细胞内蛋白酪氨酸磷酸化,促进肿瘤细胞增殖病情进展[15]。同时,MEK/MAPK信号途径可抑制细胞凋亡,而FLAP可通过磷酸化MEK/MAPK促进肿瘤细胞增殖,进一步促进病情进展[16]。结合FLAP的特点,推测FLAP与ESCC的发生、发展存在某种关系。
本研究结果显示,ESCC组织标本中的FLAP阳性率高于癌旁组织标本,肿瘤细胞转移扩散和TNMⅢ期患者的FLAP阳性率均高于肿瘤细胞未转移扩散和Ⅰ-Ⅱ期的患者,低分化患者的FLAP阳性率低于中高分化患者,初步提示FLAP阳性表达在ESCC患者不同组织间存在差异,且FLAP阳性表达与肿瘤细胞转移扩散、TNM分期及分化程度相关。究其原因,FLAP可提高基质金属蛋白酶-2活性,促进血管内皮生长因子表达,从而刺激新生血管形成,促进肿瘤的发生、发展[17]。并且,FLAP可促进白三烯A4、白三烯B4等代谢产物的合成与分泌,继而增强细胞的氧化应激,促进炎症反应,进一步促进肿瘤的发生与发展[18-19]。但研究结果显示,随着分化程度的降低,FLAP的阳性表达升高,该结果与FLAP在高分期、肿瘤细胞转移扩散中的强阳性表达有一定差异,可能与本研究纳入患者的分化情况多集中于中、高分化有关,因此关于FLAP在不同分化程度ESCC患者中的表达情况仍需未来进一步开展研究进行分析[20-21]。最后,本研究分析了FLAP与ESCC不同临床病理特征的关系,双变量Kendall直线相关性检验结果显示,ESCC患者的肿瘤细胞转移扩散和TNM分期与FLAP阳性表达均呈正相关,分化程度与FLAP阳性表达呈负相关,从而证实了前述猜测。
综上所述,与癌旁组织相比,FLAP在ESCC组织中的表达显著增强,且ESCC患者癌组织中的FLAP阳性表达与TNM分期、肿瘤细胞转移扩散及分化程度有关。因此,建议临床可通过穿刺活检测定ESCC患者癌组织中FLAP表达,以辅助评估患者分期、转移及分化等情况。

