口服胰岛素曙光初现
郗恒 郑雅娴
我是一名臨床药师,最近那个让我头疼的病人又回来住院了。他是一位大学老师,我叫他李老师。他这次住院是因为视力急剧下降,而视力下降源自于糖尿病。李老师的糖尿病症状很严重,以至于从他身边走过,你就能闻到一股烂水果味儿,这是他不好好吃药导致的。本着对患者负责的职业操守,主管医生让我再跟他聊一聊,希望能够让他接受胰岛素注射。
经过接触,我才知道李老师平时工作很忙:他上午在教室授课,下午在实验室指导学生做实验。忙碌的他总是在学校食堂吃中饭。在被诊断为糖尿病的最初几个月里,他也尝试按照医嘱,定时在三餐前注射胰岛素。但现实情况让他很难做到餐前30分钟注射,因为每次注射都不得不中断教学工作。
因为不规律使用胰岛素,李老师的血糖浓度不仅没有得到良好控制,而且他的肚子上还因为注射胰岛素出现了不美观的“硬结”。种种因素导致李老师在餐前注射胰岛素这件事上三天打鱼两天晒网,并进一步导致他的血糖浓度持续波动,久而久之,各种并发症就接二连三地找上门来。李老师感慨道:要是口服降糖药能够达到注射胰岛素的效果就好了!
为啥长期以来胰岛素无法口服?
遗憾的是,像胰岛素这类多肽蛋白类药物,口服后易被胃肠道的胃酸和酶类降解,从而失去药效。此外,这类药物分子量大、亲水性强,较难跨过肠上皮细胞,仅极少部分药物能完整进入血液循环发挥药效,这在很大程度上限制了这类药物的口服生物利用度。
蛋白多肽类药物是极具前景的创新药物之一。这类药物具有分子专属性强、体外活性高、副作用小等特点,在多种疾病治疗和预防中发挥着重要作用。然而,多肽蛋白类药物往往都是注射给药。
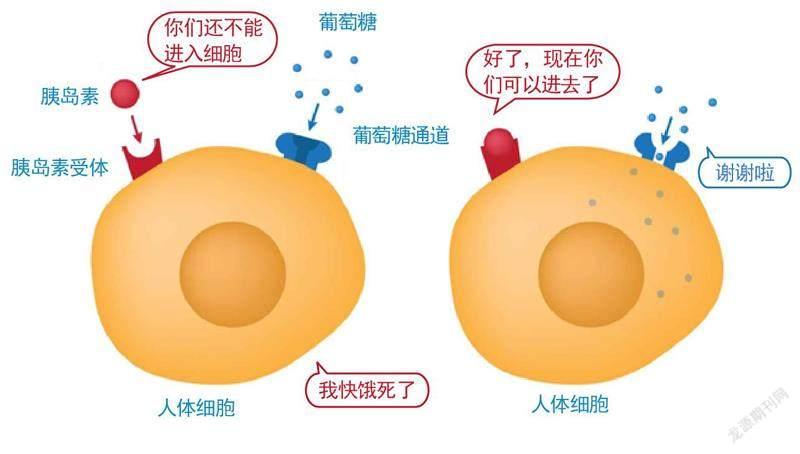
胰岛素作用机制
说到打针,许多患者就不乐意接受,而且患者也很难自己注射。即便愿意注射,也存在一系列安全隐患。例如,糖尿病患者长期注射胰岛素后,注射部位会出现结痂、疼痛和红肿等情况。这些问题看似不严重,却阻碍了大多数患者长期坚持注射胰岛素。
多肽蛋白类药物的口服制剂研发面临诸多挑战:既要保证它们在肠道中的药物稳定性,不至于被分解,也要能让它们被吸收而进入血液循环,还要有较高的可利用率。为了让多肽蛋白类药物能够口服起效,科学家做了种种努力。
一些科学家开始在药物辅料上动脑筋。药物辅料能保护药物免受人体内酶的降解,促进药物的吸收。一些吸收促进剂能赋予药物特定的跨细胞转运通路,或者打开肠道细胞间的紧密连接,促进药物进入血液循环发挥疗效。例如癸酸钠和SNAC这两类吸收促进剂,其安全性和有效性都得到了验证。
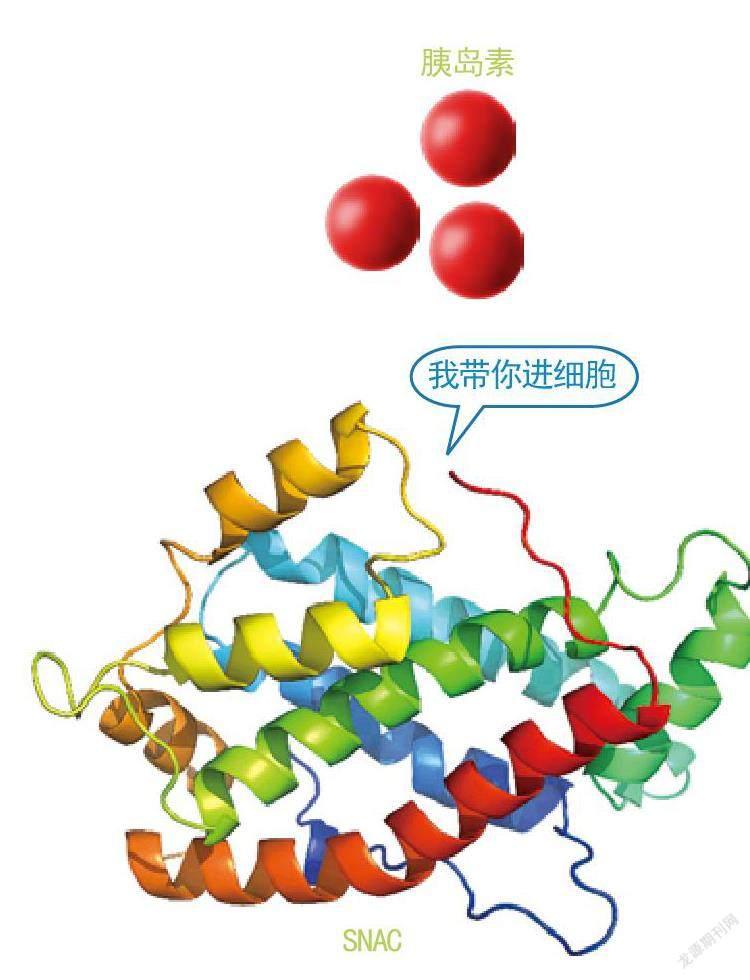
吸收促进剂能使胰岛素更容易进入细胞
肠溶衣保护 在酸性的胃部环境中,胃蛋白酶能降解多种蛋白多肽类药物,使药物失去药效。正因如此,蛋白类药物长期以来无法口服。不过,科学家发现,如果将药片表面包裹上一层耐酸的肠溶衣,就可以有效延缓药片在胃中溶解的速度。而当药片离开胃到达小肠后,小肠中的碱性环境能让药片表面的肠溶衣溶解,使药物释放。
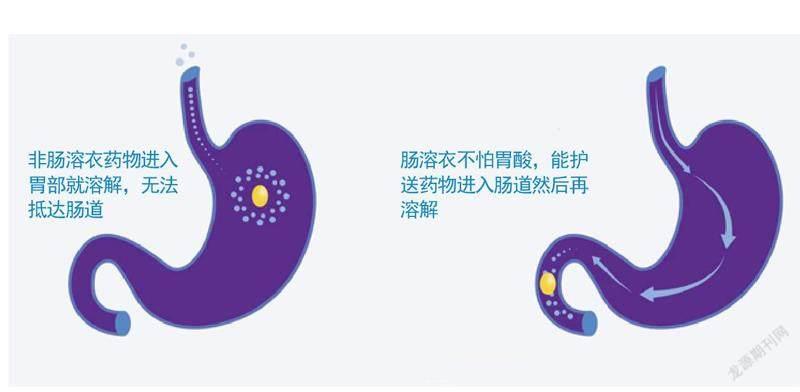
肠溶衣的作用
改变局部pH值 肠道中肠酶和胰酶也能快速降解蛋白质类药物。通过药物制剂改变释药部位的局部pH值以提高药物的稳定性,也是目前研究者们常用的方法。例如,肠道中酶的最适宜pH值为中性或碱性,在片剂中加入柠檬酸会导致局部的、短暂的pH值降低,从而抑制酶的降解活性,使多肽蛋白类药物暂时不被酶类降解。目前有研究通过将柠檬酸与口服鲑鱼降钙素联合使用,以降低局部胰蛋白酶的活性,从而有效提高药物的口服生物利用率。


口服用药好处多多
为了减少患者用药的麻烦和痛苦,也为了进一步提高药物利用率,人类迄今一直在研发各种药物制剂。在我国古代,医者通常会将药物捣碎敷于患处,或者将药物煎煮制成汤剂服用以治疗疾病。西汉时的《五十二病方》和更早的《山海经》等著作中就有将中药加工成汤剂、酒剂、膏剂等剂型的记录。
随着科学技术的发展,药物制剂研究也得到迅速发展,片剂、胶囊剂、注射剂等常见药剂被广泛用于疾病的预防和治疗。适当的药剂既能提高药物的疗效,也能增加患者用药的顺应性和安全性。但为药物“量身打造”一种新剂型并不容易:如何保持治疗效果,又不具有太明显的毒副作用,同时还能提高患者用药的意愿,是让药物研发工作者头疼的问题。
口服給药是应用最广的给药方式,而且具有多方面的优势。一方面,患者(尤其是慢性病患者)对口服药接受度高,口服药造成的疼痛和感染风险也小;另一方面,某些治疗糖尿病的药物,如胰高血糖素样肽1(GLP-1)类似物,口服后经肠道吸收,能更好模拟肠道分泌GLP-1的天然生理过程,能在很大程度上避免因药物吸收速度过快而导致的体重增加和低血糖等风险。因此,在医学领域流传着“能肌注不输液,能口服不肌注”的说法。
在研究药物的过程中,科学家受神奇的大自然启发,研发出了一些既富有想象力、又具有转化前景的新型药物剂型。
在人的肠腔表面,有一层呈凝胶网状结构的肠道黏液,能阻拦一些细菌、病毒侵入血液,但同时也使一些口服的药物颗粒被困住。随着黏液更新,这些药物颗粒也被清除。不过,有研究表明,某些极小粒径、表面带有等量正负电荷的病毒能顺利穿过肠道黏液,而不易随着黏液的更新被排出体外。
这个发现启发了一些科学家,他们在此基础上开发出表面带有等量正负电荷、仅有一百纳米直径的载药颗粒(纳米粒)。这些纳米粒能携带口服胰岛素快速穿过黏液,并能被肠道上皮细胞高效摄取。纳米粒给药不仅具有显著的降血糖效果,还将胰岛素的口服生物利用率提高了10多倍。
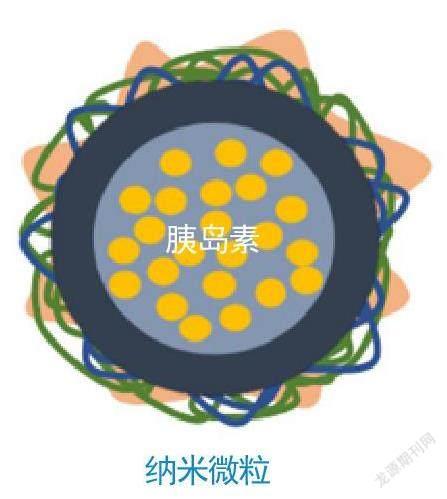
带电纳米粒的工作原理
另有研究发现,李斯特氏菌和霍乱弧菌等具有较强侵袭能力的肠道细菌的外形都呈杆状。这个相同点不由得让科学家猜测:杆状的细小药粒或许能进一步提高口服药物的递药效率。实验证实了这个猜测:在具有网状结构的肠道黏液中,杆状药物颗粒能通过特有的旋转-跳跃的运动方式,快速穿过黏液,相比球形的药物颗粒具有更强的黏液扩散能力和吸收效果。
不仅是病毒和细菌,自然界的小动物也给了科学家药物研发的灵感。科学家最近开发出了一种载大分子药物的口服胶囊。他们根据豹龟独特的龟壳形状,设计了龟壳状的口服胶囊。龟壳造型能让它们即便翻身后也能很容易再翻回来。
这款口服胶囊具有类似豹龟壳的特殊重心布局。胶囊内部装有用胰岛素压制的针头,胶囊的重心则集中于胶囊下方(这样的胶囊是不是有点像不倒翁?)。患者服用后,口服胶囊能在胃肠道中主动调整自身姿态,便于将针头从胶囊下方插入胃壁中,使胰岛素能以可控速率释放进入血液循环,起到良好的降血糖效果。目前该药物正处于实验阶段,并有望在不远的将来投入临床应用。
据权威机构统计,全中国目前有1.3亿糖尿病患者,并且还有不少人正在朝糖尿病发展。然而,仅有2%的糖尿病患者能够坚持注射胰岛素控制血糖。有科学家曾断言,在未来30~50年,糖尿病治疗仍然会以胰岛素为中心。因此,在人类开发出更有效的糖尿病药物之前,让胰岛素给药方式从打针变为吃药,无疑会造福亿万糖尿病患者。
口服药的外形也会影响药剂的吸收效果


