单糖/双糖对近中性p H下共轭亚油酸囊泡影响的比较
李 磊,方 云,夏咏梅,薄纯玲,樊 晔
(1.江南大学食品科学与技术国家重点实验室,2.化学与材料工程学院,合成与生物胶体教育部重点实验室,无锡 214122)
脂肪酸囊泡(Fatty acid vesicles,FAV)是脂肪酸分子及离子在其pKa附近通过氢键作用形成“脂肪酸二聚体”,继而自组装形成的封闭双层膜结构[1~3],其对研究原始细胞膜模型[4~6]有重要理论意义,并在微反应器[7]、荧光纳米点[8]和潜在的药物传输系统[9,10]等方面有重要应用价值,但脂肪酸仅在其pKa附近1~2个pH单位范围内形成囊泡[11].研究者们已经添加其它双亲分子与脂肪酸共组装[2],或将脂肪酸进行化学改性[3],即通过改变FAV的囊泡砌块增强FAV的稳定性.较之上述共组装和化学改性方法[1-3],添加多官能团小分子成为拓宽其pH窗口或增加其稳定性的更简单方法.初步发现一些二元醇和丙三醇可以使油酸FAV的pH窗口双向拓宽[12],而二乙烯三胺只能使其向碱性拓宽[13],说明多羟基结构对拓宽FAV的近中性pH窗口有利.文献还报道单糖[14,15]、碱基[14]、氨基酸[16]、核苷[17]及二肽[18]可增加癸酸FAV的稳定性,但尚未关注它们对FAV的pH窗口的影响.共轭亚油酸(Conjugated linoleic acid,CLA)作为一种天然存在的人体必需脂肪酸[19],利用其共轭双键自交联可以帮助稳定FAV,因而有利于透射电子显微镜(TEM)表征[20].因此,本文选取CLA为FAV的囊泡砌块,考察了乳糖等3种典型双糖和核糖作为典型单糖及其复配物对CLA形成FAV的pH窗口的影响.
1 实验部分
1.1 试剂与仪器
共轭亚油酸(CLA,纯度>95%),大连医诺生物股份有限公司;D-(+)-海藻糖(T,纯度≥99%)、蔗糖(S,A.R.级)、D-(-)-核糖(R,纯度98%)、D-(+)-葡萄糖(G,A.R.级)、D-(+)-氨基葡萄糖(A,纯度≥99%),上海阿拉丁生化科技股份有限公司;乳糖(L,A.R.级)、2-异丙基硫杂蒽酮(ITX,A.R.级),国药集团化学试剂有限公司;N,N-二羟乙基甘氨酸(Bicine,纯度≥99%,Ruibio进口分装),合肥博美生物科技有限公司;其它试剂均为分析纯.实验用水均为超纯水,电阻率为18.2 MΩ·cm.
FE-20型pH计,梅特勒-托利多仪器(上海)有限公司;VHX-1000C型超景深三维显微镜,Keyence(香港)有限公司;JEOL-JEM 2100型透射电子显微镜,日本电子株式会社;ALV/DLS/SLS-5022F型激光光散射仪,德国ALV公司;TU1950型双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司;PowerArc UV 100型紫外点光源固化系统,河北蓝天特灯发展有限公司;MicroCal VP-ITC型等温滴定量热仪,英国Malvern Panalytical仪器有限公司.
1.2 FAV的制备及其p H窗口的判断
将氢氧化钠的无水乙醇溶液在磁力搅拌下缓慢滴加入等摩尔CLA的无水乙醇溶液中,经皂化反应得到共轭亚油酸钠,脱除溶剂后真空干燥以方便称量及配制水溶液.用0.01 mol/L的NaOH(含0.09 mol/L的NaCl)溶液为溶剂分别配制各种糖-CLA系列储备液,其中CLA的浓度均为3 mmol/L,激光丁达尔效应实验过程及判断pH窗口方法参照文献[12].
1.3 FAV的形貌及平均粒径表征
用磷酸盐缓冲液重新配制1.2节中的溶液,经紫外光引发交联后获取FAV的透射电子显微镜(TEM)影像[21];经动态光散射(DLS)获取平均粒径(Dh)[21];超景深光学显微镜方法参照文献[12].
1.4 FAV的耐温变性及耐盐性测试
采用pH为8.5的Bicine-NaOH缓冲液(0.1 mol/L)配制3 mmol/L的CLA溶液作为储备液,并以此为溶剂配制各种糖-CLA样品;同时配制含NaCl(0.2 mol/L)的样品.静置24 h后置于60℃水浴中30 min,待溶液恢复至室温后,在25℃下测定400 nm处的吸光度(A1).以不含糖的CLA溶液在25℃下400 nm处的吸光度(A0)为参照值,采用公式R=(A0-A1)/A0×100%求取各体系恢复至25℃后吸光度降低的百分数(R,%),据此判断混合溶液中FAV的耐温变和耐盐性,该值越大,表示FAV的耐温变或耐盐性越好.
1.5 等温滴定量热测试
在样品池中注入1.4 mL的CLA(6 mmol/L)缓冲溶液,参比池中注入同体积的超纯水,在307 r/min及(25±0.1)℃下采用28滴(10μL)自动加样滴定(两滴间隔为240 s)模式加入各种糖溶液(除了糖R和A浓度为15 mmol/L,其余糖溶液均为60 mmol/L).滴定对应pH值的缓冲液获得稀释热,各体系量热实验数据扣除相应稀释热后得到各种糖-CLA的相互作用热数据.采用结合模型对数据进行拟合,获得相互作用热力学参数.
1.6 结合能计算
采用Gaussian 16软件[22]对双糖L或单糖R与CLA分子/离子之间弱相互作用进行理论计算,其中几何结构及频率优化采用杂化泛函B3LYP方法结合6-311G(d,p)基组及D3(BJ)色散校正,以频率优化无虚频为优化结果稳定性判断依据.结合能计算采用M06-2X-D3/6-311+G(2d,p)//B3LYP-D3(BJ)/6-311G(d,p)级别,并进行基组叠加误差(BSSE)校正.
2 结果与讨论
2.1 双糖或单糖对FAV的pH窗口的影响
采用激光丁达尔效应[12]观察各种糖-CLA分散液的相变,其中CLA及L-CLA分散液的典型实验结果见图1,分散液随pH降低呈透明-乳光-浑浊-油滴分别对应胶束-囊泡-乳液-分相的相态变化.图1(A)得到CLA形成FAV的pH窗口为7.8~9.2[23];图1(B)得出L-CLA形成FAV的pH窗口为7.3~9.4,向近中性及碱性双向均有拓宽,且误差小于0.1 pH单位.
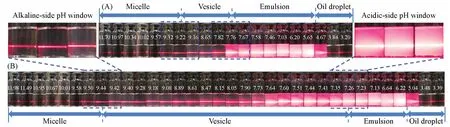
Fig.1 Determination of the p H window for FAV of CLA(A)and L⁃CLA(B)and other phase boundaries of the suspensions corresponding to p H variation by aid of the laser Tyndall effect observation
上述两个体系的相边界被标记在各自的pH滴定曲线上[图2(A)和(B)].由于生理环境下形成FAV的pH窗口更受关注[10,18,24],由图2(C)的TEM照片观察到L-CLA体系在近中性pH窗口端有较多囊泡;图2(D)显示其平均粒径为20.6 nm;图2(E)的DLS结果表明,其Dh为22.5 nm.上述结果均列于表1,印证了用激光丁达尔效应判断FAV的pH窗口的准确性.等温滴定量热法(ITC)可以进一步揭示溶液中的非共价键合作用[25~27],L-CLA溶液体系的等温滴定曲线如图2(F)所示,其热力学参数见表1,ΔG<0且ΔS>0说明L与CLA之间的非共价键合过程为自发的熵驱动过程,而ΔH<0且ΔS>0说明焓和熵对结合过程均有贡献[25,26],该相互作用涉及氢键和疏水相互作用[26].
另外,两种双糖T-CLA和S-CLA分散液的结果(见本文支持信息图S1)与图1和图2具有相似趋势,其各项数据也列于表1.故本文所考察的3种双糖均可以使FAV的pH窗口较CLA本身双向拓宽,但与二元醇或甘油[12]相比未见明显优势,初步说明并不是分子中羟基越多越有益.典型的单糖R-CLA形成FAV的结果[23]也列于表1,其拓宽FAV的pH窗口(7.0~9.5)的能力显然强于3种双糖,进一步说明多羟基分子结构虽然是拓宽FAV的近中性pH窗口的必要条件,但并不是唯一决定因素,还可能与这类分子在FAV表面的作用位点数有关.推测双糖的双环结构可能比单糖的单环结构更易与FAV表面多位点结合,从而减少了其与环境水分子缔合的剩余羟基数(与2分子R比较),因而减效.
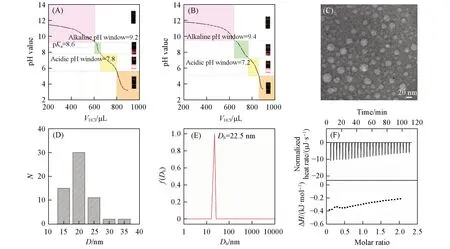
Fig.2 p H⁃V HCl curve and the laser Tyndall effect proofs corresponding to different phase regions(inset)of CLA(A)and L⁃CLA(molar ratio 0.1∶1.0)(B),TEM image(C),apparent particle size distribution using TEM(D),average hydrodynamic diameter(D h)using DLS for L⁃CLA(molar ratio 0.1∶1.0)(E),and ITC determination of L titrating FAV in buffer solution at pH=7(F)
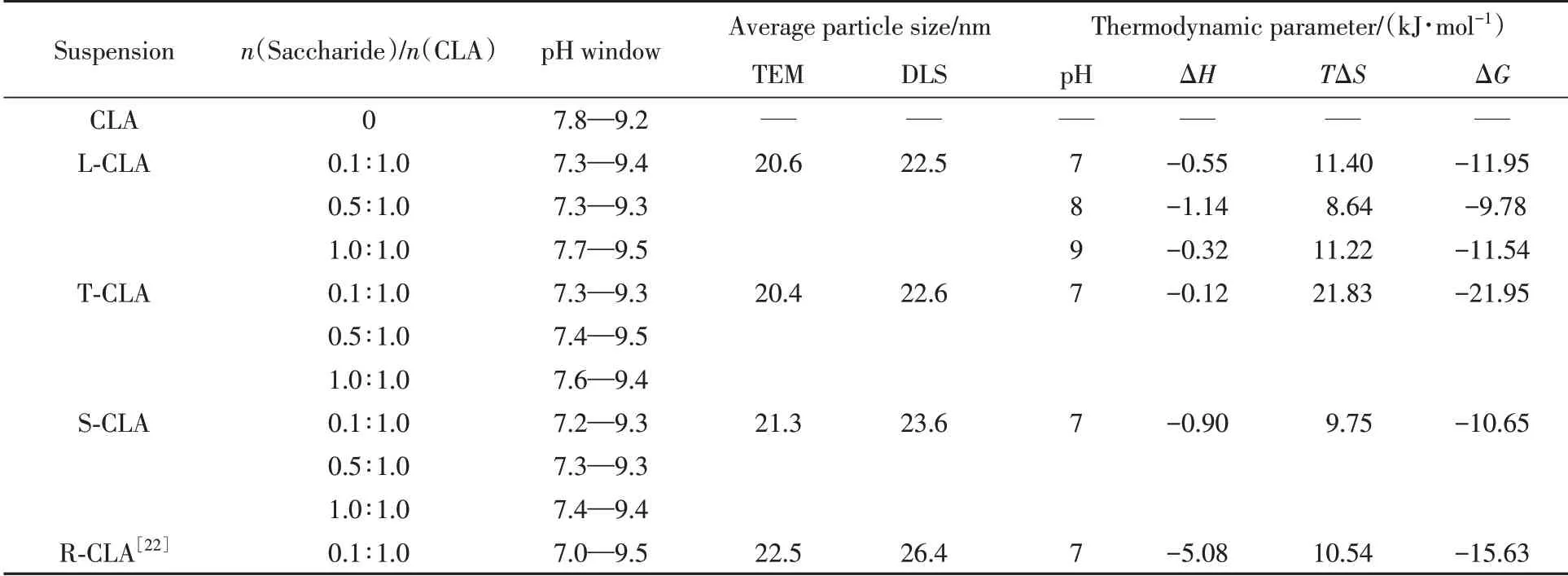
Table 1 pH window for FAV formation,average particle size at the near neutral-side p H window,and thermodynamic parameter of disaccharide(or monosaccharide)-CLA suspensions
2.2 双糖/单糖或单糖/单糖复配物对FAV的pH窗口的微调作用
为了进一步证实上述推测,首先以L/R-CLA分散液为例考察了双糖/单糖复配物,图3(A)显示其pH窗口为7.1~9.3,图3(B)显示近中性pH窗口端同样有较多囊泡,图3(C)~(E)显示了该体系的其它性质.T/R-CLA和S/R-CLA分散液的结果(见本文支持信息图S2)与图3类似,将3种双糖/单糖复配物的数据均列于表2,可见单糖对双糖-CLA形成FAV的pH窗口有微调作用,且更接近单糖R-CLA的结果,说明单糖在FAV表面存在比双糖更强的竞争吸附,推断单糖优先结合可能减弱了双糖吸附的多位点效应.
进一步考察了单糖/单糖复配物对FAV的pH窗口的影响.图4(A)表明,A/R-CLA可使FAV的近中性pH窗口端拓宽至6.5,图4(B)~(E)显示了该体系的其它性质.A/R-CLA及G/R-CLA两种单糖复配物数据见表2.在具有等量糖元的基础上进行比较,由于两种单糖/单糖复配物对近中性pH窗口的微调作用均强于表1中的3种双糖,且等于或优于R本身,支持双糖更倾向于在FAV表面多位点结合的推测,因此单糖可提供更多与环境水分子缔合的自由羟基,比双糖更有利于拓宽FAV的近中性pH窗口.
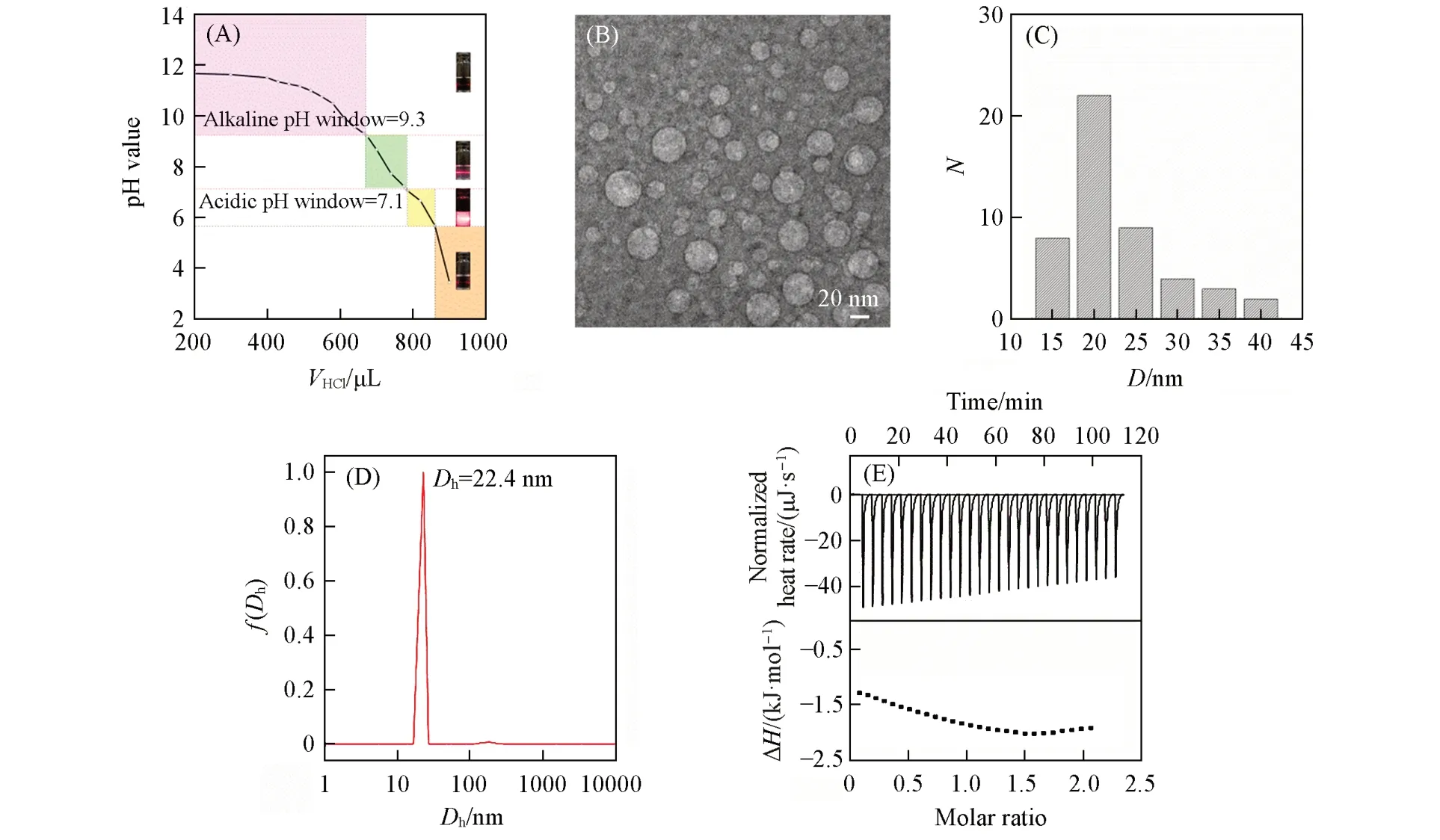
Fig.3 p H⁃V HCl curve and the laser Tyndall effect proofs corresponding to different phase regions(inset)of L/R⁃CLA(molar ratio 0.1∶0.1∶1.0)(A),TEM image(B),apparent particle size distribution using TEM(C),average hydrodynamic diameter(D h)using DLS for L/R⁃CLA(molar ratio 0.1∶0.1∶1.0)(D),and ITC determination of L/R mixture titrating FAV in buffer solution at pH=7(E)

Fig.4 p H⁃V HCl curve and the laser Tyndall effect proofs corresponding to different phase regions(inset)of A/R⁃CLA(molar ratio 0.1∶0.1∶1.0)(A),TEM image(B),apparent particle size distribution using TEM(C),average hydrodynamic diameter(D h)using DLS for A/R⁃CLA(molar ratio 0.1∶0.1∶1.0)(D),and ITC determination of A/R mixture titrating FAV in buffer solution at pH=7(E)

Table 2 p H window for CLA-FAV formation,average particle size at the near neutral-side pH window and thermodynamic parameter of disaccharide/R(or monosaccharide/R)-CLA suspensions
2.3 FAV的耐温变性及耐盐性
温度或盐度变化均会引起FAV表面波动[28]而致解体,若糖与FAV表面有非共价键合作用,并与水有缔合作用就会减缓其解体[14,15].如表3所示,各种糖-CLA体系在升降温循环后,吸光度均表现出不同程度降低,说明与FAV表面均存在非共价键合作用,不同程度地增强了FAV的环境稳定性.
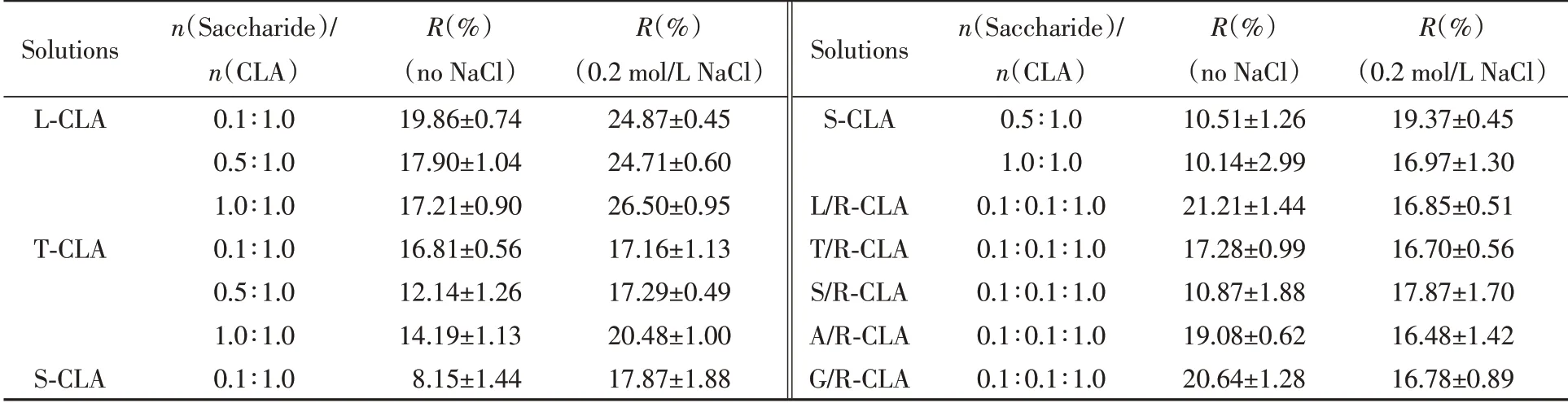
Table 3 Values of R(%)influenced by disaccharide-CLA,disaccharide/R(or monosaccharide/R)-CLA suspensions
图5通过超景深显微镜观察到各种糖-CLA体系存在微米级的多层囊泡(Multilamellar vesicles,MLV)[29],说明糖分子还可以通过插入多层囊泡层间并与相邻双分子层共同结合的方式增强FAV的环境稳定性[12].

Fig.5 Optical micrographs of disaccharide⁃CLA(molar ratio 0.1∶1.0),disaccharide/ribose⁃CLA and monosaccharide/ribose⁃CLA(molar ratio 0.1∶0.1∶1.0)solutions at the alkaline⁃side p H window(pH=9.4)composed of L(A),T(B),S(C),L/R(D),T/R(E),S/R(F),A/R(G)and G/R(H)
2.4 双糖或单糖及其复配物与FAV表面的相互作用
上述实验结果表明,双糖或单糖及其复配物均可以拓宽CLA形成FAV的近中性pH窗口,且按照双糖<单糖≈双糖/单糖≤单糖/单糖顺序依次增强,已经表明这是由单糖竞争吸附以及推断糖分子与FAV表面的作用位点数不同导致.图6(A)列出了典型双糖L或典型单糖R与CLA分子/离子或水分子[23]的结合能计算结果,主要为氢键(4~120 kJ/mol)或离子-偶极(50~200 kJ/mol)相互作用范围[30],结合能强度符合L-CLA<R-CLA和L-Water<R-Water两个规律.前一个规律与单糖对FAV表面的竞争吸附强于双糖的实验结果相吻合;这两个规律均与单糖比双糖分子更易拓宽FAV的近中性pH窗口的实验事实相符,也支持双糖可能与FAV表面多位点结合的推测.图6(B)据此给出了双糖或单糖及其复配物与FAV表面结合的可能机理及其比较拓展近中性pH窗口能力的示意图,可以解释本文实验结果.
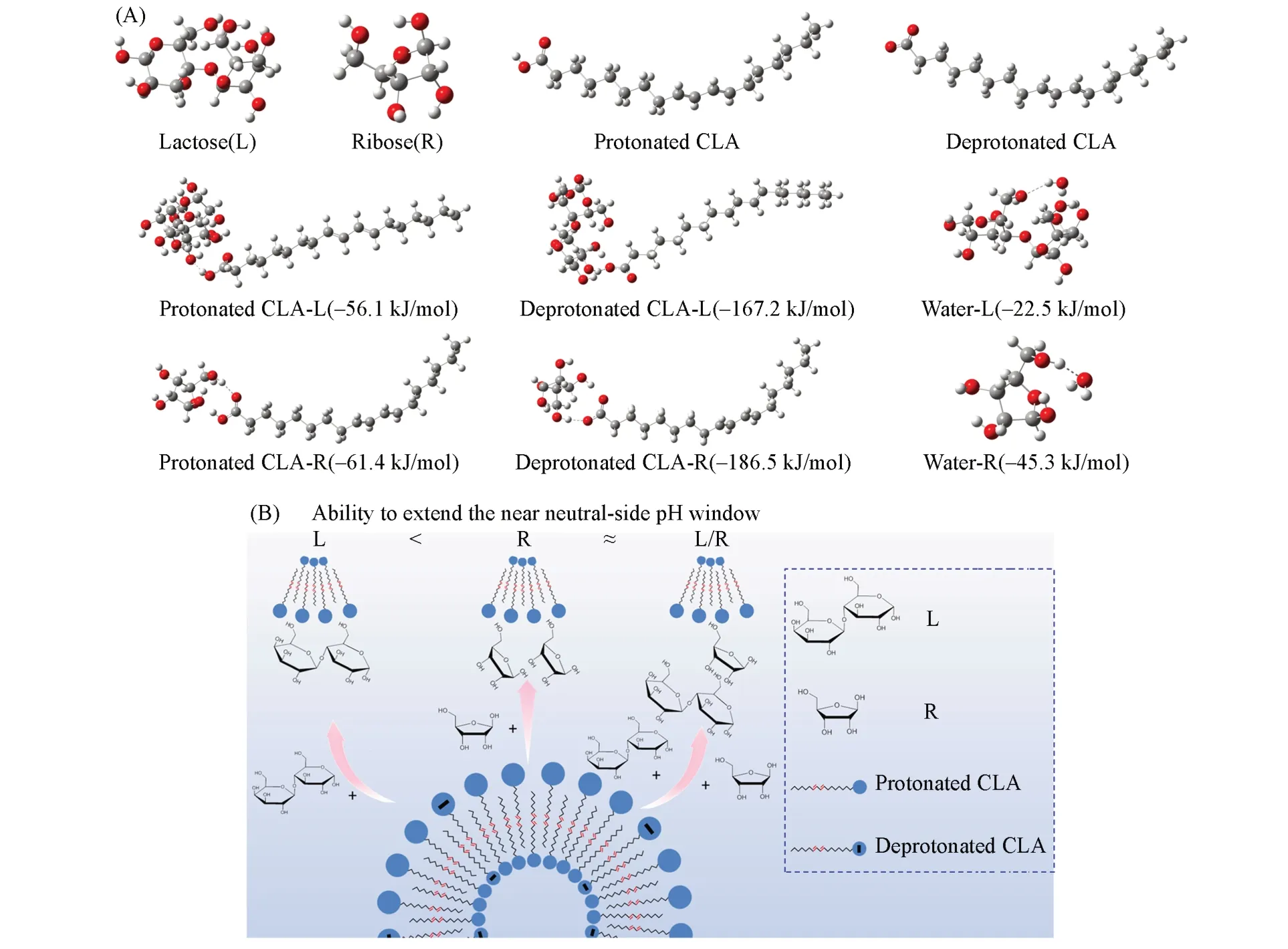
Fig.6 Comparison of binding energies between saccharides and protonated/deprotonated CLA or water(A),and schematic illustration of the binding mechanism of saccharides on the FAV surface(B)
3 结 论
选取CLA为FAV的囊泡砌块,考察乳糖等3种典型双糖或核糖等3种典型单糖及其复配物对CLA形成FAV的pH窗口的影响.采用激光丁达尔效应观察各种糖-CLA分散液的相变,并确定形成FAV的pH窗口.实验结果表明,双糖或单糖及其复配物均可以拓宽CLA形成FAV的近中性pH窗口,且按照双糖<单糖≈双糖/单糖≤单糖/单糖的顺序依次增强,说明多羟基分子结构虽然是拓宽FAV的近中性pH窗口的必要条件,但并不是唯一决定因素,还可能与这类分子在FAV表面的作用位点数有关.实验和计算结果均表明,单糖在FAV表面存在比双糖更强的竞争吸附,单糖优先结合可能减弱了双糖吸附的多位点效应,因此单糖可以提供更多与环境水分子缔合的自由羟基,比双糖更有利于拓宽FAV的近中性pH窗口.本文为进一步选择多羟基小分子作为FAV的调节剂提供了理论依据,也为开发生物相容性的FAV型缓释载体提供了参考.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20210860.