吩噻嗪席夫碱可见光引发剂的合成与性能
徐丹丹,邹修成,罗 静,刘 仁
(江南大学化学与材料工程学院,光响应功能分子材料国际联合研究中心,无锡 214122)
长波光聚合因使用生物安全、低污染的发光二极管(LED)可见光或近红外光而广泛应用于生物医学[1,2]、食品包装[3]及牙科材料[4]等领域.长波可见-近红外光还有助于解决紫外(UV)光穿透性差的问题[5,6].因此,基于可见光引发剂的设计合成成为研究的热点.目前,关于可见光引发剂的研究主要集中在以下3个方面:(1)通过引入杂原子或助色团,增强n→π*跃迁来实现波长的红移[7~11];(2)通过引入共轭结构,增强π→π*跃迁,从而使波长向长波方向移动[12~15];(3)通过发光中间体,如上转换发光纳米材料(UCNPs),将近红外光转换成传统引发剂可利用的紫外-可见光[16].
基于推-拉电子结构设计D-A或D-π-A型分子也是构建可见光引发剂的有效策略[17~19]:分子内供体和受体相互作用,在分子骨架结构上产生电荷离域,从而构建在可见光区域具有强分子内电荷转移吸收带(ICT)的化合物.此外,紫外吸收波长范围不仅由供体-受体对的相对强度决定,还与供体-受体间的π共轭间隔长度有关,因此可以通过调节电子供体、电子受体能力以及共轭π结构的长度,调节光引发剂的吸收波长范围[20].
吩噻嗪基团具有良好的光学性能,分子内同时含有N和S杂原子,经常作为电子给体构建各种功能性染料,多被用于太阳能电池[21]及生物医药[22]等领域,其分子中的N原子很容易被氧化形成稳定的自由基阳离子,从而增强传输正电荷的能力[23].目前关于吩噻嗪敏化碘鎓盐的研究已有报道.Crivello等[24]研究了各种吩噻嗪衍生物敏化碘鎓盐的机理.Yagci等[25]还报道了使用吩噻嗪作为光敏剂用于硫鎓盐的光解.Wang等[23]以吩噻嗪为供电子生色团,成功合成了D-D-A型染料,并将其与碘鎓盐复合用作自由基光聚合和阳离子光聚合中的光引发剂.由于这些分子的合成大多需要较昂贵的催化剂和冗长的合成步骤,在一定程度上限制了其发展.
席夫碱的合成条件温和,并且其C=N双键可发挥与C=C双键相似的作用[26],可用于构建共轭π骨架结构.本文基于D-π-A结构的设计,通过反应条件温和的席夫碱共轭结构,设计合成了4种具有不同受体官能团的吩噻嗪席夫碱光引发剂,通过实验测试及模拟计算对其光吸收及光引发丙烯酸酯自由基及环氧单体阳离子的聚合行为进行探究,通过光解、电子自旋共振自由基捕捉实验和循环伏安(CV)实验对其机理进行了研究.
1 实验部分
1.1 试剂与仪器
吩噻嗪和碘乙烷,分析纯,安耐吉试剂有限公司;叔丁醇钾、N,N-二甲基甲酰胺(DMF)、三氯氧磷(POCl3)、苯胺、对氨基苯甲酸、对三氟甲基苯胺、对氰基苯胺、二苯基碘六氟磷酸盐(Iod)和N-叔丁基苯硝酮(PBN),分析纯,上海Adamas试剂有限公司;甲醇、无水四氢呋喃(THF)、无水硫酸钠、乙酸乙酯、二氯甲烷和甲苯,分析纯,国药集团化学试剂有限公司;异丙基-9H-噻吨-9-酮(ITX),分析纯,无锡广信感光新材料股份有限公司;三羟甲基丙烷三丙烯酸酯(TMPTA)、1,6-己二醇二丙烯酸酯(HDDA)、二缩三丙二醇二丙烯酸酯(TPGDA)和3,4-环氧环己基甲基-3,4-环氧环己基甲酸酯(EPOX),工业级,溧阳开磷瑞阳化工股份有限公司;脂肪族聚氨酯三丙烯酸酯(GU4300N),工业级,深圳国精化学股份有限公司;环三羟甲基丙烷甲缩醛丙烯酸酯(CTFA),工业级,致德化学(上海)有限公司.
Nicolet 6700型傅里叶变换红外光谱仪(FTIR),扫描速率为4 scans-1,采集速率为4 cm-1,美国赛默飞世尔科技有限公司;AvanceⅢHD 400 MHz型核磁共振波谱仪(1H NMR),瑞士Bruker公司;UV-1900i型紫外-可见分光光度计(UV-Vis),岛津(中国)有限公司;EMXplus-10/12型电子自旋共振波谱仪,德国布鲁克科技有限公司;UVP60型LED光源,上海润铸电子科技有限公司;UPLC-TQD型超高效液相色谱串联四极杆质谱联用仪(HRMS,电喷雾离子源,ESI),美国沃特世有限公司;CARY Eclipse型荧光分光光度计,美国瓦里安有限公司;UV Power PuckⅡ型紫外能量计,美国EIT公司;STAR型热重分析仪(TG),瑞士Mettler Toledo公司;LK3200A型电化学工作站,天津兰力科化学电子高技术有限公司.
1.2 吩噻嗪席夫碱可见光引发剂的合成与性能研究
新型D-π-A型吩噻嗪席夫碱类可见光引发剂的合成路线如Scheme 1所示:
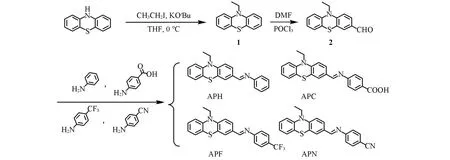
Scheme 1 Synthesis routes of the phenothiazine⁃based schiff bases photoinitiators(APH,APC,APF,APN)
1.2.1N-乙基吩噻嗪(1)的合成 将1.992 mg(10 mmol)吩噻嗪和1.68 g(15 mmol)叔丁醇钾溶于30 mL四氢呋喃中,于0℃下搅拌15 min,然后将0.930 mL(30 mmol)碘乙烷加入到反应体系中,并保持此温度下搅拌反应12 h;用300 mL去离子水淬灭反应,经二氯甲烷萃取(50 mL×3)、去离子水洗涤、无水硫酸钠干燥及旋转蒸发干燥后得到粗产物,粗产物经柱层析[V(PE)∶V(DCM)=20∶1]提纯后得到白色针状固体2.2 g,产率96%.
1.2.2 3-醛基-N-乙基吩噻嗪(2)的合成 在0℃冰水浴及N2气保护下,将2 mL POCl3缓慢滴入2 mL无水DMF中,加入25 mL烧瓶中,搅拌30 min后得到橙红色黏稠液体,缓慢滴加化合物1的DMF溶液[将1.362 g(6 mmol)化合物1溶解在8 mL无水DMF中],于60℃下搅拌反应14 h;反应完全后,将反应体系冷却至室温,倾倒入100 mL冰水中,用10%(质量分数)的氢氧化钠溶液调节pH值至5,用氯仿萃取3次(15 mL×3),再用去离子水洗涤3次(15 mL×3),经无水硫酸钠干燥、旋转蒸发干燥后得到粗产物,粗产物经柱层析[V(PE)∶V(EA)=15∶1)]得到淡黄色固体1.377 g,产率90%.1H NMR(400 MHz,DMSO-d6),δ:9.78(s,1H),7.71(dd,J=8.5,2.0 Hz,1H),7.57(d,J=1.9 Hz,1H),7.22(ddd,J=8.5,7.3,1.6 Hz,1H),7.14(dd,J=7.8,1.6 Hz,2H),7.07(dd,J=8.3,1.2 Hz,1H),6.99(td,J=7.5,1.2 Hz,1H),3.98(q,J=6.9 Hz,2H),1.32(t,J=6.9 Hz,3H).
1.2.3 1-(10-乙基-10H-吩噻嗪-3-基)-N-苯基甲亚胺(APH)的合成 在N2气保护下,将225 mg(1 mmol)化合物2和93 mg(1 mmol)苯胺溶于15 mL甲醇中,加入25 mL烧瓶中,于65℃下搅拌回流反应12 h,然后静置12 h;有固体析出.将该固体用冰的无水甲醇洗涤3次(10 mL×3),于60℃真空干燥12 h得到黄色液体产物210 mg,产率64%.1H NMR(400 MHz,DMSO-d6),δ:8.48(s,1H),7.74(dd,J=8.5,2.0 Hz,1H),7.66(d,J=1.9 Hz,1H),7.44~7.36(m,2H),7.26~7.19(m,4H),7.16(dd,J=7.7,1.5 Hz,1H),7.12(d,J=8.5 Hz,1H),7.07(dd,J=8.3,1.1 Hz,1H),6.98(td,J=7.5,1.2 Hz,1H),3.98(q,J=7.0 Hz,2H),1.33(t,J=6.9 Hz,3H).HRMS(ESI),m/z,C21H18N2S理论值:331.1191[M+H]+,实测值331.0945[M+H]+.
1.2.4 4-{[(10-乙基-10H-吩噻嗪-3-基)亚甲基]氨基}苯甲酸(APC)的合成 在N2气保护下,将225 mg(1 mmol)化合物2和137 mg(1 mmol)对氨基苯甲酸溶于15 mL甲醇中,加入25 mL烧瓶中,于65℃下均匀搅拌回流反应12 h,然后静置12 h,有固体析出;将该固体用冰的无水甲醇洗涤3次(10 mL×3),于60℃真空干燥12 h得到黄色固体产物220 mg,产率60%.1H NMR(400 MHz,DMSO-d6),δ:12.68(s,1H),8.50(s,1H),8.05~7.90(m,2H),7.82~7.54(m,2H),7.32~7.25(m,2H),7.25~6.94(m,5H),3.98(q,J=6.9 Hz,2H),1.33(t,J=6.9 Hz,3H).HRMS(ESI),m/z,C21H18N2O2S理论值:375.1089[M+H]+,实测值:375.1136[M+H]+.
1.2.5 4-(10-乙基-10H-吩噻嗪-3-基)-N-[4-(三氟甲基)苯基]甲亚胺(APF)的合成 在N2气保护下,将225 mg(1 mmol)化合物2和161mg(1 mmol)对三氟甲基苯胺溶于15 mL甲醇中,加入25 mL烧瓶中,于65℃下搅拌回流反应12 h,然后静置12 h,有固体析出;将该固体用冰的无水甲醇洗涤3次(10 mL×3),于60℃真空干燥12 h得到黄色针状固体产物258 mg,产率65%.1H NMR(400 MHz,DMSO-d6),δ:8.50(s,1H),7.75(dd,J=8.5,3.0 Hz,3H),7.67(d,J=1.9 Hz,1H),7.38(d,J=8.2 Hz,2H),7.25~7.19(m,1H),7.17~7.10(m,2H),7.09~7.04(m,1H),6.98(td,J=7.5,0.9 Hz,1H),3.98(q,J=6.9 Hz,2H),1.33(t,J=6.9 Hz,3H).HRMS(ESI),m/z,C22H17F3N2S理论值:399.1065[M+H]+,实测值:399.0767[M+H]+.
1.2.6 4-{[(10-乙基-10H-吩噻嗪-3-基)亚甲基]氨基}苄腈(APN)的合成 在N2气保护下,将225 mg(1 mmol)化合物2和118mg(1 mmol)对氰基苯胺溶于15 mL甲醇中,加入25 mL烧瓶中,于65℃下搅拌回流反应12 h,然后静置12 h,有固体析出;将该固体用冰的无水甲醇洗涤3次(10 mL×3),于60℃真空干燥12 h得到亮橙色针状固体产物248 mg,产率70%.1H NMR(400 MHz,DMSO-d6),δ:8.49(s,1H),7.86(d,J=8.5 Hz,2H),7.79~7.63(m,2H),7.36(d,J=8.5 Hz,2H),7.26~6.92(m,5H),3.98(q,J=6.9 Hz,2H),1.33(t,J=6.9 Hz,3H).HRMS(ESI),m/z,C22H17N3S理论值:356.1143[M+H]+,实测值:356.1017[M+H]+.
1.3 性能测试与表征
1.3.1 量子化学计算 所有计算均使用Gaussian 16软件包进行.根据密度泛函理论,使用B3LYP/Def2-SVP的理论方法和基组,得到优化的基态几何构型,随后对其进行振动分析,得到无虚频的稳定构象.基于优化的基态结构,以相同方法和基组进行TDDFT计算,包括能量最低的20个激发态的信息.最终使用GaussView 6.0程序将分子结构和前线轨道可视化[27].
1.3.2 稳态光解测试 将光引发剂溶于二氯甲烷中制成1.25×10-4mol/L的溶液,测试在405 nm LED光源辐照下不同辐照时间的紫外-可见光吸收光谱.测试光强为28 mW/cm2.
1.3.3 实时红外聚合测试 将相应质量的吩噻嗪光引发剂和Iod加入选定的光固化单体中,通过机械搅拌和超声混合,得到均匀的光固化树脂.将光固化树脂涂抹在一片KBr盐片上,用另一块KBr盐片盖住样品,在405 nm LED(光强:10 mW/cm2)和450 nm LED(30 mW/cm2)点光源辐照下,对待测样品特征官能团的变化进行实时监测,用OMNIC 7.5软件进行数据处理,双键峰面积区间取1650~1585 cm-1,环氧峰面积区间取850~750 cm-1.官能团转化率(Conversion,%)根据下式进行计算:

式中:At为在t时刻双键的特征峰面积,A0为初始峰面积.
1.3.4 电子自旋共振波谱测试 避光条件下,在2 mL样品瓶中配制光引发剂APN和Iod(摩尔比1∶10,引发剂浓度为2×10-3mol/L)的甲苯溶液,加入7 mg自由基捕捉剂PBN,用干燥N2气鼓气20 min,经405 nm LED光源辐照10 min(光强为100 mW/cm2)后,得到电子自旋共振实验图谱,通过软件拟合得到模拟实验图谱以及捕获到的自由基的超精细裂分常数.
1.3.5 电化学实验 配制含有待测引发剂和辅助电解质六氟磷酸四丁基铵的DMF溶液,其中光引发剂浓度为1 mmol/L,电解质浓度为1 mmol/L,待测物的氧化电位和还原电位通过循环伏安法(CV)测定,参比电极为饱和甘汞电极(SCE),电极通过含有电解质的多孔玻璃桥连接到样品溶液中,以铂电极为辅助电极,玻碳电极作为工作电极.
基于Rehm-Weller公式,以吩噻嗪席夫碱光引发剂作为电子给体,Iod作为电子受体,根据下式计算吩噻嗪席夫碱和Iod发生光致电子转移反应的自由能变化(ΔGet,eV):
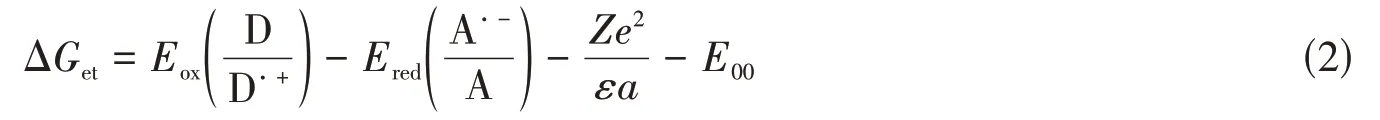
式中:Eox(D/D·+)(V)为吩噻嗪席夫碱光引发剂作为电子供体的氧化电位,Ered(A·-/A)(V)为Iod电子受体的还原电位;Ze2/εa(eV)为库仑能量,相对于ΔGet(eV)的整体大小可以忽略不计,其中Z为核电荷数,e为元电荷,ε为真空介电常数,a(nm)为溶液中粒子间距离.根据下式计算电子给体的单重态激发态能量(E00,eV):

式中:h(6.626×10-34J·s)为普朗克常数,c(3×108m/s)为光速;λ(nm)为激发光谱和荧光发射光谱交叉点处对应的波长.
2 结果与讨论
2.1 光引发剂的吸收和发射行为
图1(A)给出吩噻嗪席夫碱可见光引发剂的紫外-可见吸收光谱.可见,4种光引发剂的吸收波长范围均在350~450 nm,在可见光区域内表现出良好的光学吸收性能.与APH相比,末端基团为强吸电子基团(羧基、三氟甲基和氰基)的引发剂APC,APF和APN的最大吸收波长都发生红移,分子呈现D-π-A构型.其中APN最大吸收波长最长,达到403 nm(表1),与405 nm的LED可见光源匹配性最好.席夫碱末端基团不仅影响紫外吸收行为,而且影响荧光发射行为.图1(B)为光引发剂溶解在二氯甲烷中的荧光发射光谱,其荧光发射行为与紫外吸收规律一致,其中引发剂APN的斯托克斯位移最高,达50000 cm-1.

Fig.1 Absorption of photoinitiators(1.25×10-4 mol/L,A)and fluorescence emission spectra of photoinitia⁃tors(1×10-5 mol/L,B)in dichloromethane

Table 1 Absorption and fluorescence emission of photoinitiators*
2.2 量子化学计算
利用B3LYP/Def2-SVP程序对引发剂分子的几何构型进行优化.图2给出4种吩噻嗪光引发剂的优化结构及前线分子轨道.4种引发剂结构的最高占据分子轨道(HOMO)及最低未占分子轨道(LUMO)均相似.其中,HOMO轨道电子主要分布在吩噻嗪生色团中心结构上,而LUMO轨道电子则分布在共轭结构和末端基团上.当分子受到激发后,电子云通过席夫碱C=N键向末端吸电子基团方向移动,表现出分子内电荷转移(ICT)特性.计算结果表明,EHOMO-ELUMO的大小顺序为:APH>APF>APC>APN,因此APH的最大吸收波长最短,而APN的最大吸收波长最长,与实验测得的紫外-可见吸收光谱结果一致.
此外,根据时间依赖DFT方法获得的紫外-可见光谱(图3)与实验结果非常相似.

Fig.2 HOMO and LUMO orbitals of the phenothiazine⁃based schiff bases photoinitiators

Fig.3 Calculated UV⁃Vis spectra of the photoinitiators
2.3 光引发剂的稳态光解
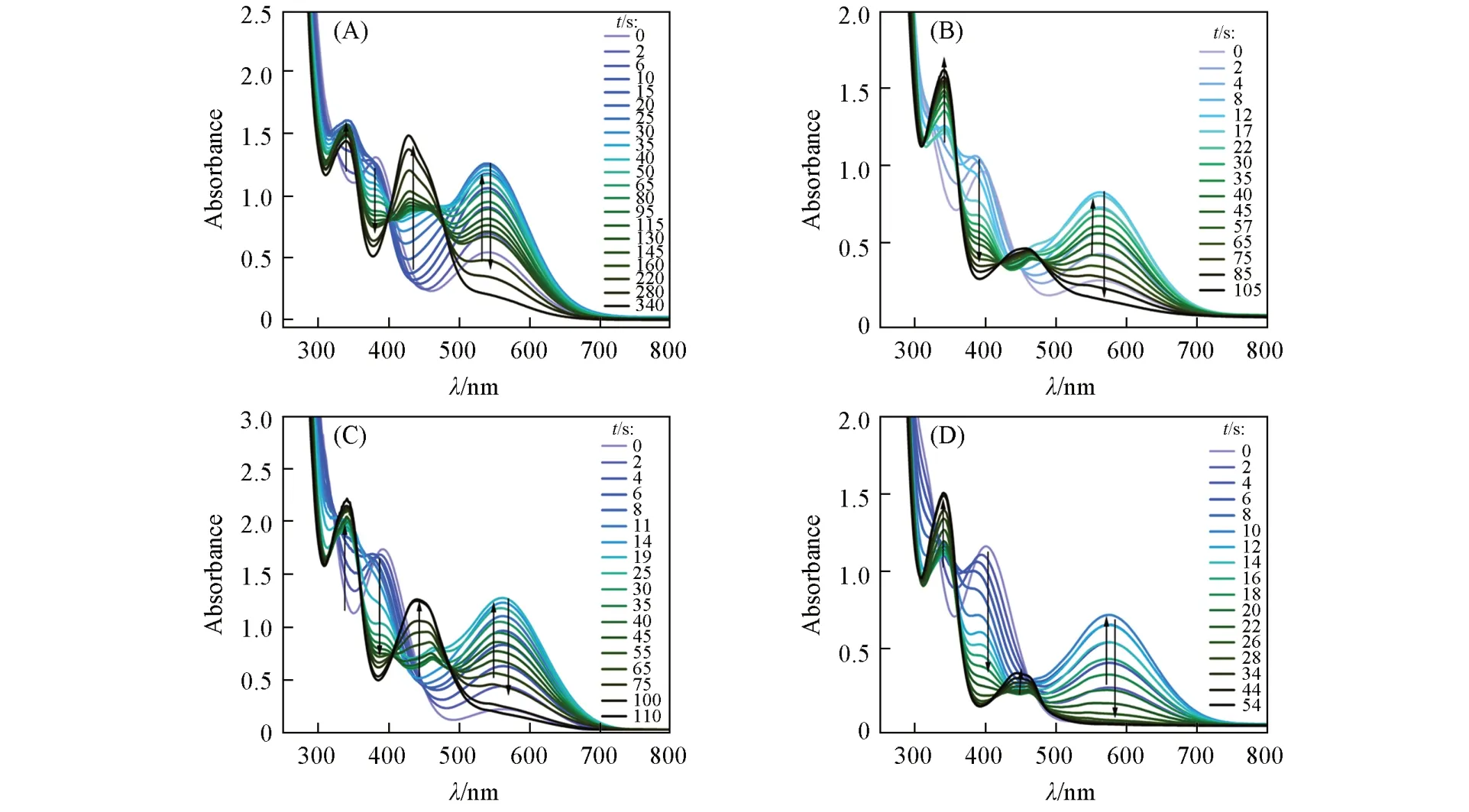
Fig.4 Steady⁃state photolysis of APH/Iod(A),APC/Iod(B),APF/Iod(C)and APN/Iod(D)in dichloro⁃methane under the irradiation of 405 nm LED light(28 mW/cm2)
通过光解实验对光引发剂的光激发性能进行评估.图4给出4种吩噻嗪光引发剂与Iod组成的光引发体系在405 nm(28 mW/cm2)LED光源辐照下的稳态光解图.在光源辐照下,光引发体系在350~420 nm处的主吸收峰持续减弱,这是由于吩噻嗪席夫碱化合物与Iod之间发生了电子转移;与此同时,在500~700 nm区域的吸收峰增强,这是因为吩噻嗪席夫碱与Iod生成的活性物质具有较长的吸收波长,随着辐照时间的延长,该活性物质发生二次反应,从而快速湮灭,使得该波长区域吸收峰强度下降.其中,APN的光解速率最快,仅辐照54 s后光引发体系的吸收峰就不再变化,表明其已完全光解.
2.4 光聚合动力学
通过实时红外光谱对反应性官能团进行实时监测,研究了反应体系的动力学变化.Scheme 2给出自由基光固化单体TMPTA、阳离子光固化单体EPOX及商品化光引发剂ITX的结构.分别研究了光引发剂结构、光源波长、光引发剂浓度及Iod浓度对引发活性的影响.
Scheme 2 Structures of commercial PIs and monomers used in the photopolymerization
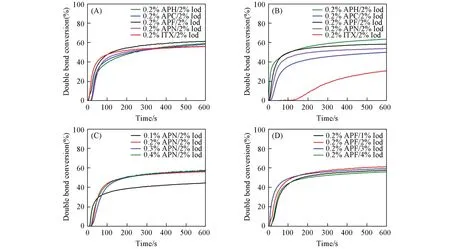
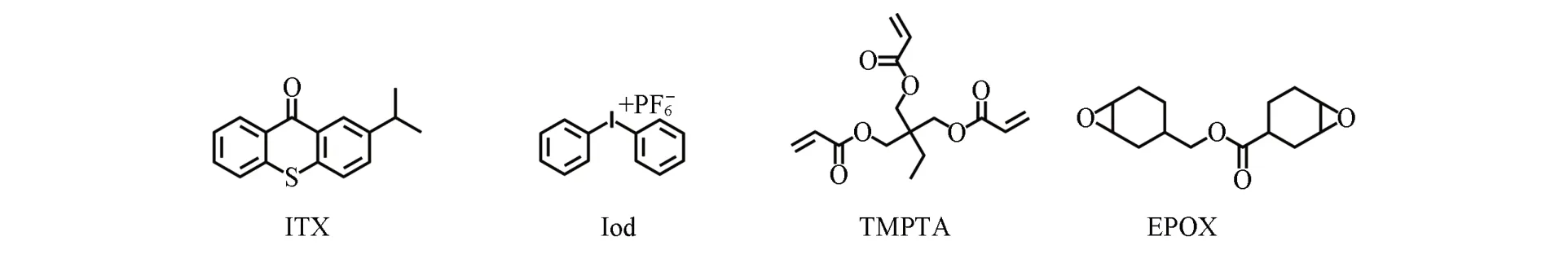
Fig.5 Double bond conversion of TMPTA with different phenothiazine⁃based schiff bases photoinitiators under different irradiation
2.4.1 自由基聚合 图5(A)给出在405 nm LED光源辐照下,不同结构吩噻嗪光引发剂及ITX引发TMPTA聚合的双键转化率曲线.由稳态光解图可知,吩噻嗪席夫碱类光引发剂和Iod组成的双组分引发体系在60 s内就能光解完全,在100 s内可实现TMPTA的快速固化,说明该光引发体系在较短时间内就能产生大量自由基.其中APF/Iod与商品化光引发剂ITX/Iod均没有诱导期,添加吩噻嗪席夫碱类光引发剂时的最终转化率均略高于添加ITX时的.改变光源波长为450 nm LED,不同引发体系引发TMPTA聚合的双键转化率曲线如图5(B)所示.由图5(B)可见,ITX/Iod引发活性明显较低,并且具有超过100 s的诱导期,这是由于吩噻嗪席夫碱类光引发剂的吸收波长与450 nm光源更匹配,证明吩噻嗪席夫碱光引发剂在较宽的可见光范围内具有光响应.由图5(C)可知,控制Iod添加摩尔分数为2%,将光引发剂APN的添加摩尔分数从0.1%增加到0.2%时,双键转化速率明显提升,当继续增加APN的量时,最终双键转化率总体差别并不显著,均在55%左右.由图5(D)可知,控制光引发剂APF的添加摩尔分数为0.2%,随着Iod的添加摩尔分数从1%增加到3%,聚合速率仅略有提升,当Iod的摩尔分数增加到4%后,由于Iod的溶解性较差,导致聚合速率略有下降.其中,Iod添加量为2%时的最终转化率最高.以上研究表明,当光引发剂摩尔分数为0.2%、Iod摩尔分数为2%时,引发效果最好.
2.4.2 阳离子聚合 图6(A)给出在405 nm LED低光强光源辐照下,不同结构的吩噻嗪类光引发剂及ITX引发EPOX聚合的环氧官能团转化率曲线.研究结果表明,APN/Iod固化速率最快,转化率也比ITX/Iod的高.控制Iod的添加摩尔分数为2%,将光引发剂APN的摩尔分数从0.1%增加到0.2%时,环氧官能团转化率如图6(B)所示,辐照600 s时的最终转化率随光引发剂含量的增加而由10%提高到60%.当引发剂的添加摩尔分数从0.2%增加到0.4%时,聚合速率及转化率反而下降.由图6(C)可知,控制光引发剂APF的添加摩尔分数为0.2%,环氧官能团转化率随Iod光引发剂添加量的增加而提高.这是由于引发活性物种由Iod产生,活性物种浓度随Iod添加量的增加而增加,从而导致引发效率提高.
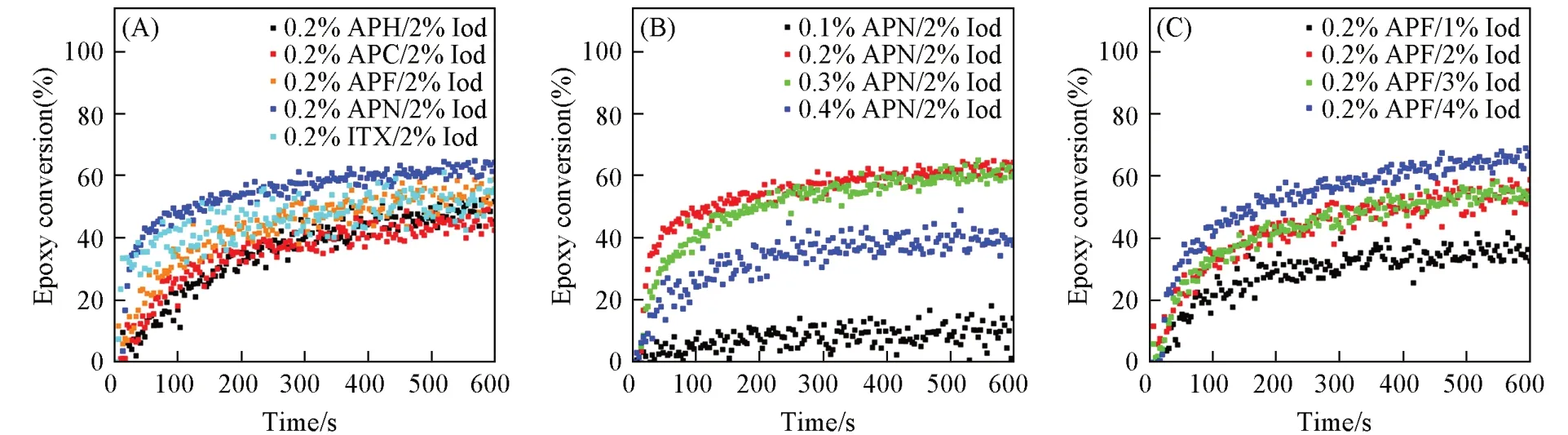
Fig.6 Epoxy conversion of EPOX with different phenothiazine⁃based schiff bases photoinitiators under irradiation of 405 nm LED lamp(10 mW/cm2)
2.5 机理研究
通过实时红外聚合实验可知,APN/Iod能有效引发自由基单体和阳离子单体发生聚合反应,引发活性与商品化引发剂ITX相当.首先,采用循环伏安法测定光引发剂的氧化电位(Eox,oxidation potential)和Iod的还原电位(Ered),以证明光引发剂与Iod之间遵循光致电子转移(PET)的机理.Iod在DMF中的还原电位为-0.88 V,计算得出的自由能变化(ΔGet)值列于表2.由表2可见,光引发剂和Iod之间的电子转移反应自由能变化为负值,这表明光致电子转移的机理在热力学上是有利的.
Table 2 Parameters characterizing the reactivity of the photoinitiators*
以APN/Iod光引发体系为例,提出了光聚合的机理.首先,在光源辐照下,光引发剂跃迁到激发态(单线态或三线态)[Scheme 3(1)],随后与Iod发生电子转移,产生APN·+及Ph2I·,其中Ph2I·不稳定,会发生快速裂解,产生苯基自由基,引发丙烯酸酯单体发生自由基聚合反应[Scheme 3(2)].使用ESR对光解后的产物进行表征.图7为PBN捕捉到的自由基的电子自旋共振谱图,其超精细裂分常数为aN(mT)=1.441740,aH(mT)=0.219849,证明了光解过程中自由基的产生.
APN·+能够与体系中的氢供体发生夺氢反应,产生引发阳离子聚合的路易斯酸H+PF6-[Scheme 3(3)].另外,APN·+能够与阳离子单体直接反应,生成聚合物[Scheme 3(4)].此外,根据文献[18],吩噻嗪自由基阳离子还能够发生二聚反应,同时产生路易斯酸H+P,引发阳离子聚合反应[Scheme 3(5)].

Scheme 3 Mechanism of free radical and cationic polymerization initiated by APN/Iod

Fig.7 ESR spectra of the radicals of APN/Iod trapped by PBN in toluene

Fig.8 Hollow pyramid of DLP 3D printing picture with APN/Iod as the initiator system
2.6 数字光处理(DLP)3D打印测试
实时红外聚合实验表明,光引发剂摩尔分数为0.2%,Iod摩尔分数为2%时,引发自由基单体固化效果最好.利用DLP 3D打印评价了吩噻嗪类光引发剂的光引发活性.选择APN(0.2%,摩尔分数)和Iod(2%,摩尔分数)作为光引发剂,树脂配方为m(GU4300N)∶m(TPGDA)∶m(CTFA)=2∶1∶1.
使用DLP打印机(每层曝光时间:3 0 s,层厚:0.5 mm,底层数:10,底层曝光时间:60 s)可打印出肉眼观测精度较高的镂空金字塔3D模型.图8(A)和(C)分别为打印镂空金字塔在365 nm LED灯照射下和日光下拍摄的数码照片,由图8(B)扫描电镜拍摄图可观察到清晰的层层打印边缘.图8(A)表明APN打印材料在光源辐照下发出黄色荧光,通过DLP 3D打印技术可用于构筑高精度的光致发光结构,其在发光聚合物和发光器件制造领域具有潜在的应用价值.
3 结 论
通过席夫碱反应,合成了4种吩噻嗪席夫碱可见光引发剂,其在350~450 nm区域具有较强吸收.其中APC和APN的末端基团参与分子内的电子转移,因此吸收波长较长,与商用的405 nm LED光源具有最佳的匹配度.稳态光解实验及电化学实验证明光引发体系遵循光致电子转移的机理.在405 nm LED光源辐照下,光解产生的苯基自由基可以高效引发自由基单体TMPTA的固化,同时能够产生高效引发阳离子单体EPOX固化的活性物种,引发活性可以与商品化引发剂ITX相当.实时红外实验结果表明,当PI/Iod/单体的摩尔比为0.2∶2∶100时固化效果最好.此外,在450 nm LED辐照下,4种引发剂引发自由基单体固化的引发活性均高于ITX,表明其在较宽可见光范围具有较高的光引发活性.通过优化DLP打印参数,使用实时红外聚合测试确定的树脂配方进行了光致发光材料的层层打印,证明所研究的光引发剂在3D打印光致发光器件领域具有潜在的应用前景.