p H/酶/光热多重响应的金纳米笼/透明质酸核壳结构纳米载体的制备与性能
樊晓慧,汪 洋,杨园园,张玉红
(省部共建生物催化与酶工程国家重点实验室,湖北大学化学化工学院,武汉 430062)
刺激响应型纳米载体通常具有增强药物渗透性、延长循环时间和降低药物不良毒性等特点[1,2],在药物递送和控释领域引起了广泛关注[3,4].但大多数载体不具备特异性识别能力,不能精准地将药物递送到病灶部位,而且由于单一化疗载体载药能力的限制,大大制约了其治疗效果[5,6].有机-无机核壳结构纳米载体是一类以无机纳米粒子为核、有机大分子为壳的核壳结构纳米载体,其能够提供较大的药物装载效率、多样化的表面修饰以及多样化的治疗手段,进一步提升了药物利用率和癌症治疗效果[7~9].
贵金属纳米粒子化学性质稳定,具有独特光学特性,被广泛用于癌症治疗、生物成像、化学传感和药物输送等领域[10~13].其中,金纳米笼(AuNC)具有近红外响应的光热转换性能、独特的中空多孔结构以及生物相容性,被广泛用作药物控制释放和光热治疗的药物纳米载体[14,15].AuNC作为抗癌药物的容器和光热剂,可以结合光热疗法与化疗,为肿瘤的治疗提供更有效的方法.
透明质酸(HA)是一种天然多糖,具有优异的生理活性和生物相容性[16,17];高表达的CD44载体蛋白的肿瘤细胞[如人非小细胞肺癌细胞系(A549)和小鼠结肠癌细胞(CT-26)等]具有较高的亲和性,HA修饰后的纳米材料也被赋予了一定的靶向性[18].Li等[19]使用HA和异硫氰酸荧光素修饰Fe3O4纳米粒子用于体内靶向肿瘤磁共振,其中HA靶向的Fe3O4纳米粒子可以被过量表达的CD44受体的癌细胞特异性摄取,并可用作体外靶向癌细胞的MR成像和体内异种移植肿瘤模型的有效探针.此外,HA在透明质酸酶(Haase)作用下能够发生水解,当HA改性纳米粒子作为纳米药物载体进入细胞后,在HAase作用下其结构会发生变化从而释放药物,具有酶刺激响应性[20].酶刺激响应性纳米载体由于具有反应条件温和、高效性和专一性的特点,吸引了大量研究者的注意[21].将HA用于载药纳米粒子的包覆,不仅能够增强其生物相容性,更赋予载体靶向性及酶响应性,这将大幅提升治疗效果,极具应用前景.
本文利用改性的HA、AuNC和盐酸阿霉素(DOX)通过简单的一锅法制备了有机-无机核壳结构载药纳米微粒DOX@AuNC@HA(DAH),并在pH=7.4、光热及透明质酸酶存在的条件下监测了DAH颗粒在模拟人体环境中的药物释放行为.在细胞实验中,DAH粒子在化疗与光热治疗的协同治疗中展现出较好的靶向性和刺激响应性,为开发低毒、高效的纳米载药体系提供了一条新的途径(Scheme 1).
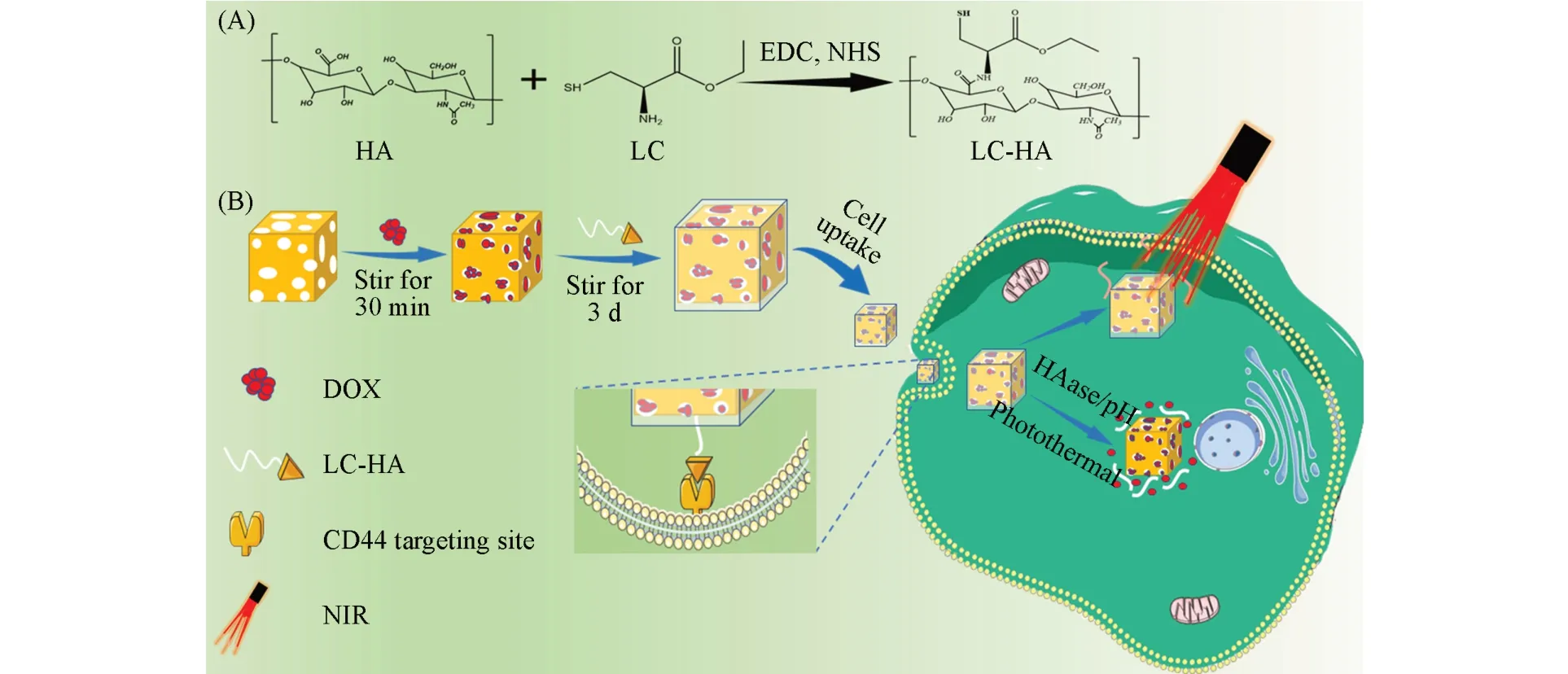
Scheme 1 Modification process of hyaluronic acid(A)and schematic representation of the preparation and drug release behavior of DAH(B)
1 实验部分
1.1 试剂与仪器
水溶性碳二亚胺盐酸盐(EDC,B.R.级)、聚乙烯吡咯烷酮(PVP,Mw=30000)、硫化钠(NaS,纯度99%)、丙酮(C3H6O,分析纯)和谷胱甘肽(GSH,B.R.级),国药集团化学试剂有限公司;N-羟基琥珀酰亚胺(NHS,B.R.级)、L-半胱氨酸乙酯盐酸盐(LC,纯度98%)和乙二醇(EG,纯度≥99.5%),阿拉丁试剂有限公司;氯金酸(HAuCl4,Au含量48%~50%)、透明质酸酶(HAase,400~1000 U/mg)、青霉素链霉素(PS)、胰酶(Trypsin)和多聚甲醛,分析纯,Sigma试剂有限公司;达尔伯克改良伊格尔培养基(DMEM,B.R.级)和牛血清(FBS),赛默飞世尔科技公司;透明质酸钠(Mw=3000~10000),华熙福瑞达生物医药有限公司;Cell Counting Kit-8试剂(CCK-8),GLPBIO生物试剂有限公司;细胞实验所使用的A549细胞由武汉大学中南医院医学实验中心提供,小鼠成纤维细胞(L929细胞)购自武汉普诺塞生物公司;所有实验所用超纯水均由惠仪浦(北京)环保科技有限公司HYP-QX-UP型超纯水机制得.
Spectrum one型傅里叶变换红外光谱仪(FTIR),美国Perkin-Elmer公司;UV-6100S型紫外-可见分光光度计(UV-Vis),上海精密仪器仪表有限公司;ZS90型激光粒度分析仪,英国Malvern公司;Tecnai G20型透射电子显微镜(TEM),美国FEI公司;JSM7100F型场发射扫描电子显微镜(SEM),日本电子株式会社;波长671 nm的红外激光器,北京华源拓达激光技术有限公司;SpectraMax iD3型全自动定量绘图酶标仪,美国分子设备公司;Nikon C2型共聚焦显微镜,日本Nikon公司.
1.2 实验过程
1.2.1 AuNC的合成 参照文献[22]方法制备AuNC.首先以AgNO3溶液为原料合成银立方(Ag cube),纯化后分散于4 mL超纯水中;将5 mL 1 mg/mL的PVP溶液和0.1 mL Ag cube溶液加入到圆底烧瓶中,加热至轻微沸腾;10 min后,将6 mL 0.1 mmol/L的HAuCl4以45 mL/h的速度滴加到圆底烧瓶中,当烧瓶中溶液颜色变为蓝色时停止滴加,保温;待液体颜色稳定不变后停止加热,剧烈搅拌,直至反应体系冷却到室温;将产物转移至离心管中,加入NaCl晶体至达到饱和,离心富集后,用乙醇与去离子水(体积比为1∶1)的混合物洗涤3次,最后分散于超纯水中备用.
1.2.2 透明质酸钠的修饰 将EDC和NHS加入到0.1 mg/mL透明质酸钠溶液中(nHA∶nEDC∶nNHS=1∶1.5∶1.8);30 min后,逐滴加入L-半胱氨酸乙酯盐酸盐溶液,反应4 h;然后透析24 h(使用超纯水透析,换水3次,每次500 mL),冷冻干燥,得到巯基化的透明质酸LC-HA.
1.2.3 阿霉素的负载与释放 向AuNC分散液中滴加1 mL 1 mg/mL的DOX溶液,避光搅拌30 min后加入150 mg巯基化的透明质酸,低温避光搅拌72 h;负载结束后进行离心处理,用超纯水洗涤、离心3次去除未装载的DOX,得到透明质酸修饰的负载DOX的AuNC(DOX@AuNC@HA,即DAH).利用紫外-可见分光光度计检测离心上清液在490 nm处的吸光度,计算DAH中DOX的载药量和载药率.
1.3 光热转化实验
分别将1 mL不同浓度的AuNC和DAH悬浊液(10,25和50μg/mL)加入到石英池中,使用激光持续照射(671 nm,1 W/cm2,10 min),每隔30 s记录溶液温度;分别取1 mL 25μg/mL的AuNC和DAH悬浊液,使用不同的激光功率(0.5,1,2 W/cm2)照射10 min,记录溶液的温度变化;此外,分别对AuNC和DAH悬浊液进行连续5次升-降温实验,考察DAH的光热转换稳定性及光热转化率[23,24],每次记录结束后等样品冷却到室温后再进行下一次循环实验.
1.4 DAH的体外生物评价
使用CCK-8试剂盒检测了DAH对A549细胞的细胞活性的影响[25].将约5000个A549细胞接种在96孔板上,待细胞增殖到铺满孔板的70%~80%时,加入不同浓度的HA,DOX和DAH溶液与细胞共同培养24 h.为了研究金纳米笼的光热作用对细胞活性的影响,添加3组DAH培养的细胞,每6 h使用不同功率的激光照射10 min,共照射4次;培养结束后,将细胞用pH为7.4的磷酸盐缓冲溶液(PBS)洗涤3次,加入100μL含有CCK-8的DMEM培养基(VCCK-8∶VDMEM=1∶9),在细胞培养箱中培养2 h,使用酶标仪检测细胞在450 nm处的吸光度.根据吸光度的值计算细胞的活性.
此外,研究了A549细胞和L929细胞对DAH的摄取情况.分别将约1×105个A549细胞和L929细胞接种到共聚焦培养皿中孵育24 h;当细胞融合率达到80%左右时,分别加入DOX和DAH溶液,共培养4和24 h后,用PBS(pH=7.4)洗涤3次,加入1 mL多聚甲醛置于培养箱中;30 min后,去除上层清液,加入700μL细胞核着色剂4′,6-二脒基-2-苯基吲哚(DAPI),着色5 min后去除上层清液,用PBS(pH=7.4)洗涤3次,再加入l mL PBS(pH=7.4),保持细胞状态;使用激光共聚焦显微镜拍摄明场、258和490 nm处的图像.
2 结果与讨论
2.1 DAH核壳结构纳米粒子的合成与表征
为整合化疗与光热疗法的优点,提升癌症治疗效果,选择具有光热效应的AuNC为载药容器.用LC对HA进行巯基化改性,再用改性后的HA通过巯基与金的反应对载有DOX的AuNC实现包封,从而制备了载药纳米微粒DOX@AuNC@HA(DAH),制备过程见Scheme 1.图1给出LC,DOX,HA及DAH的FTIR谱图.在DAH的FTIR谱图中,1752和1228 cm-1处出现了LC的酯羰基的伸缩振动特征峰和酯基的不对称伸缩振动特征峰[26];1286 cm-1处出现了DOX上蒽环的羰基伸缩振动吸收峰[27];1660和1070~1207 cm-1处出现了HA的糖环和羧酸的羰基的吸收峰[28].红外光谱结果表明成功合成了改性HA修饰的AuNC负载DOX的核壳纳米粒子.
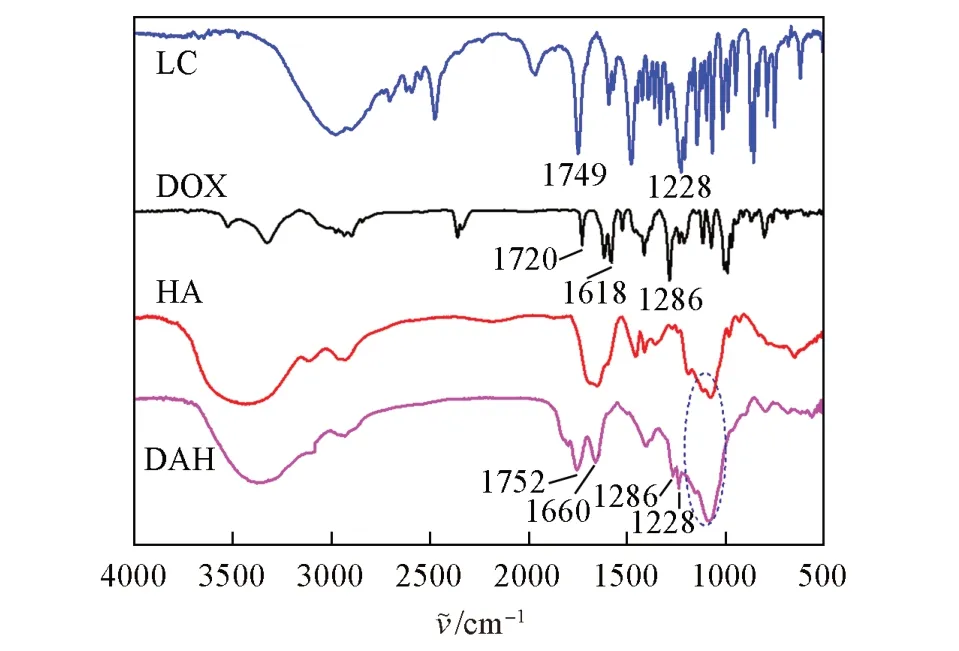
Fig.1 Infrared spectra of LC,DOX,HA and DAH
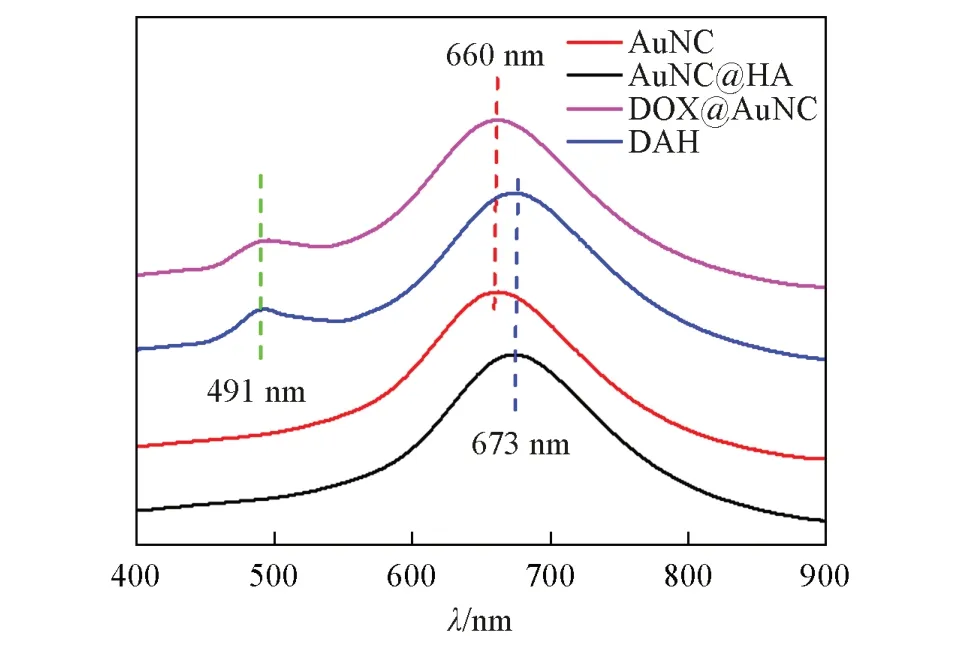
Fig.2 UV⁃Vis spectra of AuNC,AuNC@HA,DOX@AuNC and DAH
图2为AuNC,AuNC@HA,DOX@AuNC和DAH的紫外-可见吸收光谱.4种物质在660~670 nm处都有一个大的吸收峰,这是AuNC的吸收峰,不同的是,AuNC和DOX@AuNC的吸收峰在660 nm附近,而AuNC@HA和DAH的吸收峰在673 nm附近.这主要是因为HA包覆后AuNC的外层介质由水变为了HA(由液体变为固体),导致外层的介电常数增大,从而使吸收峰发生红移[29].同时,DOX@AuNC和DAH在491 nm处也都有一个吸收峰,这是装载的DOX的特征吸收峰.紫外-可见光谱证明了HA对AuNC成功包覆,DOX也成功被装载.
图3(A)为Ag cube的SEM照片.由图3(A)可见,Ag cube的尺寸比较均匀,其直径在70 nm左右.由AuNC的TEM照片[图3(B)]可见,AuNC分散良好,尺寸均匀,可以明显看出其中空结构,说明AuNC的成功制备.
图4(A)给出Ag cube,AuNC及DAH的电位图.由图4(A)可见,Ag cube的表面电位在-10 mV左右,AuNC的表面电位为-7.8 mV,而DAH的表面电位为-15 mV,说明HA的修饰使AuNC的表面负电荷增多,这将会增强纳米微粒在体液中的稳定性,延长体内循环时间[2].图4(B)为Ag cube,AuNC及DAH的水合动力学粒径图.可以看出,AuNC和Ag cube的水合粒径尺寸相近,大约为70 nm,而DAH由于有HA的包覆,其水合粒径为110 nm.DAH较小的尺寸将有利于其穿过血管和组织进入细胞内部[30].

Fig.3 SEM image of Ag cube(A)and TEM image of AgNC(B)
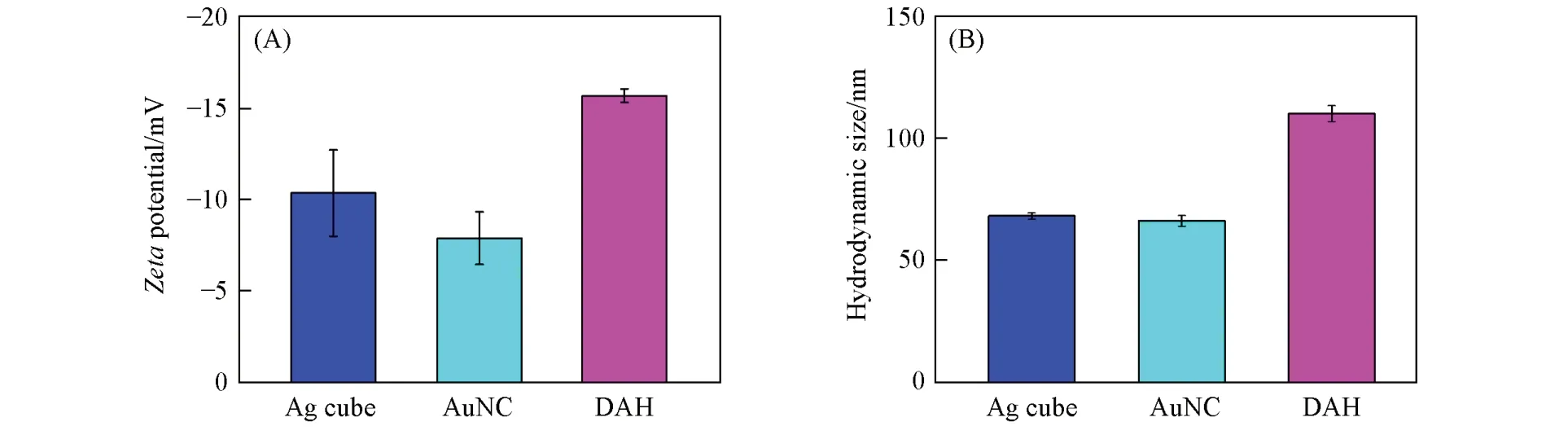
Fig.4 Zeta potential(A)and hydrated particle sizes(B)of Ag Cube,AuNC and DAH
2.2 AuNC和DAH的体外光热性能

Fig.5 Photothermal conversion of AuNC(A,C)and DAH(B,D)at different concentrations(A,B)or different power laser sources(C,D)
以波长为671 nm的激光为光源,考察了不同浓度AuNC和DAH悬浊液的温度随照射时间的变化[图5(A)和(B)].经过10 min持续照射后,AuNC和DAH悬浊液的温度都明显升高.AuNC浓度为10 μg/mL时,AuNC和DAH组的温度增值分别为19.2和20.1℃;AuNC浓度为25μg/mL时,AuNC和DAH组的温度增值分别为24.4和29.3℃;AuNC浓度为50μg/mL时,AuNC组的温度增值为32.4℃,DAH组增值为33.5℃.温度的增值在一定范围内与试剂的浓度呈正相关,相同浓度下DAH组的温度增值都略高于AuNC组,这可能是因为包覆高分子外壳和载药后DAH的吸收峰发生红移,更加接近激光的波长,有利于光热剂吸收更多的光而放出更多的热[31].在DAH中AuNC的光热效果得到增强,能够更好地满足杀死肿瘤细胞的要求[32].
图5(C)和(D)示出了AuNC浓度为25μg/mL时,不同功率激光对AuNC和DAH悬浊液光热转换性能的影响.可以看出,在0.5 W/cm2功率下,AuNC和DAH升温较慢,其10 min后的温度增值分别为11.7和12.3℃;在1和2 W/cm2功率下,AuNC和DAH升温较快,其中1 W/cm2功率下AuNC和DAH在10 min后的温度分别升高21.7和25.5℃,2 W/cm2功率下AuNC和DAH的温度增值分别为30.1和35.4℃.通过温度的变化可以看出,当体系内的光热剂含量一定时,激光器功率越大,温度增量就越大,光热效果总体就越好.这可能是由于激光功率的增加可有效提高单位面积光热试剂的光热转换量,从而使得体系表现出温度的升高[31].
对25μg/mL的AuNC和DAH悬浊液进行光热稳定性实验[图6(A)和(B)].在1 W/cm2功率下进行连续照射,发现经过激光反复连续照射5次后,其光热转换能力并未减弱,AuNC在循环测试中温度上升快,激光照射10 min后其温度升高了25.4℃;DAH在升温实验中,平均温度增值也达到26.8℃.DAH的升温幅度高于AuNC,拥有较好的光热稳定性,进一步证明DAH通过利用光热用于肿瘤的治疗的可行性.根据光热转换率计算公式[23,24],AuNc和DAH的光热转换率分别为23.1%和33.1%[图6(C)和(D)].可以看出DAH拥有比AuNC更高的光热转换率,这主要是因为经过修饰后的AuNC最强吸收峰位置发生红移,与实验中选择的激光波长更加接近,使得其吸收的光增多而反射的光减少,从而提高了光热转化率.
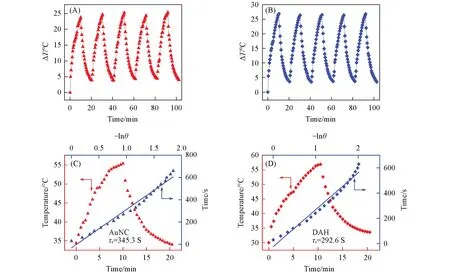
Fig.6 Photothermal curves of AuNC(A)and DAH(B)and photothermal effects of AuNC(C)and DAH(D)with cooling period of the time versus negative natural logarithm of the temperature
2.3 DAH的载药和体外释放性能
基于AuNC的中空结构和HA的生物相容性,DOX被成功包载到AuNC@HA纳米凝胶中.根据紫外-可见光谱分析结果计算得出DAH的载药率约为28.3%,载药量为12.5%,说明AuNC@HA纳米凝胶具有较好的药物载运能力.
DAH在生物体内能否有效释放内部的DOX是判断载体功能性好坏的重要标准之一.本文通过模拟不同的细胞内环境,分析了DAH的刺激释放性能.图7(A)给出DAH在不同pH环境下DOX的累计释放情况.由图7(A)可以看出,在pH值为7.4的条件下,DOX的释放率一直保持在一个较低的状态,20 h的累计释放率在20%左右.而在pH值为6.5和5.0时,20 h后的累计释放率分别为55.2%和77.8%,远高于在pH值为7.4时的释放率.说明DAH在酸性条件下具有明显的刺激响应性,这可能是因为HA分子链上有众多的官能团(羟基及氨基等),这些官能团在酸性条件下能够结合溶液中的氢离子而带上同种电荷,从而打开包覆在AuNC表面的高分子链,释放出DAH粒子中的药物[33].DAH在pH值为7.4时释放率较低也说明其在该条件下具有良好的稳定性.由于血液的pH值接近7.4[34],因此DAH在血液中将具有良好的稳定性,能够减少药物的泄露,降低药物的毒副作用.而肿瘤细胞内部的微环境是呈酸性的,在这种酸性环境下,羟基和氨基能够更多更快质子化,使表面聚合物因带同种电荷互相排斥而处于“蓬松”状态,DAH内部的DOX能够大量地释放并作用于癌细胞,达到抑制癌细胞生长或杀死癌细胞的目的[35].
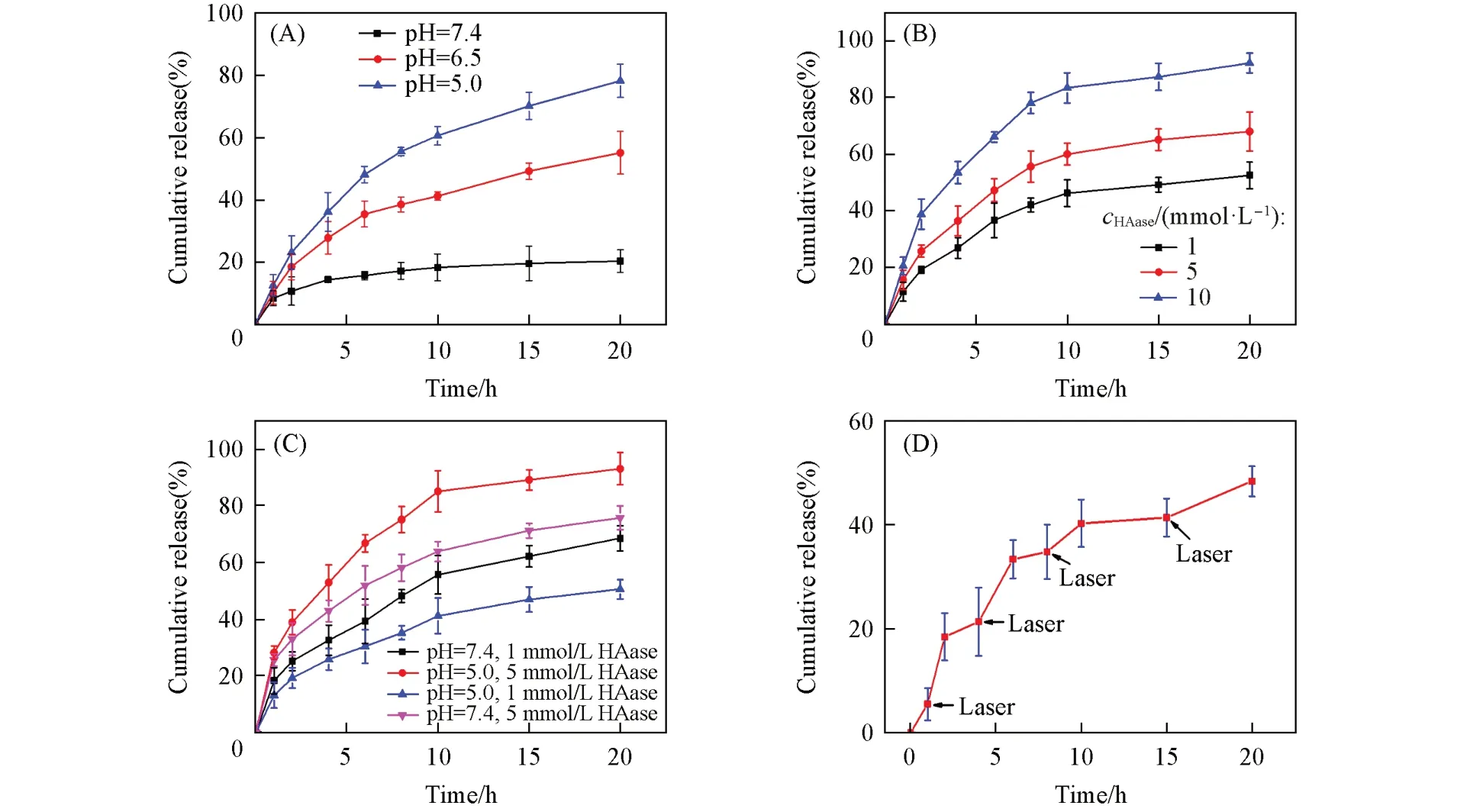
Fig.7 DOX cumulative release from DAH under different p H values(A),HAase concentrations in PBS solution(p H=7.4,B),enzyme concentrations in PBS(p H=7.4 or 5.0,C)and laser intermit⁃tent irradiation at 1,4,8,12 h(D)
图7(B)给出DAH在不同浓度HAase存在下DOX的释放情况.由图7(B)可以看出,HAase对DAH中DOX的释放有着很大的影响,即使在最低浓度(HAase浓度为1 mmol/L)时,DOX的累计释放率也达到52%左右.这主要是因为HAase对HA的酶解作用破坏了AuNC表面的包覆层,促进了药物释放[36].20 h后,不同浓度HAase下DOX的累计释放率分别为52.6%(1 mmol/L),68%(5 mmol/L)和92%(10 mmol/L).可见,DAH具有良好的酶响应性.这主要是因为HA能够与细胞中的HAase发生酶解作用,利用这一特点设计的DAH纳米粒子能够有效释放出其内部的DOX.
图7(C)是pH和HAase共同作用于DAH时,DOX的累计释放情况.由图7(C)可知,在pH值为5.0及酶含量为5 mmol/L的环境下,DOX释放率高达93.2%,释放效果最佳;而在pH值为7.4及酶含量为5 mmol/L的溶液中,DOX累计释放率为75.89%.这主要是因为酸性环境下,HAase的活性更高[37].此外,在pH值为5.0及酶含量为1 mmol/L的溶液中,DOX的累计释放率为66.7%;在pH值为7.4及酶含量为1 mmol/L的环境下,DOX的累计释放率只有51%.这也说明酸性条件下HAase的活性较强,有利于药物释放.由以上分析可知,HAase对DAH中DOX的释放影响是绝对的,且酶活性与pH值之间存在协同作用.
为了探讨光热对DOX释放的影响,采用激光器在释放过程中每隔一段时间照射样品10 min.DOX的释放情况如图7(D)所示,光照后的一段时间内,DOX的释放有所加快,释放6 h,累计释放率达到了32%左右;6 h后,这种光照刺激对释放效率的影响变小,20 h的累计释放率达到50%左右.这说明光照对药物的释放有一定的影响.这可能是因为激光的照射使金纳米笼发生光热效应,使体系温度升高,体系内分子的热运动能增加[38].这将导致原本包覆在DAH表面的高分子链发生运动及排布变化,使包覆“壳”出现松动甚至出现破裂,释放出DAH内部或高分子链间隙中的DOX,导致DAH表现出光热敏感性.
2.4 DAH的生物性能
以A549细胞为模型,探究了HA、AuNC、游离DOX、DAH及不同功率激光作用下DAH的细胞毒性.由图8(A)可见,AuNC在较低浓度时无细胞毒性,当浓度达到8μmol/L时就表现出一定的细胞抑制作用.不同浓度下的HA均表现出无毒性,说明HA具有良好的生物相容性,作为包封材料能够减少对正常组织的危害.因此,使用HA修饰AuNC可以有效提高载体的生物相容性.游离DOX和DAH组随着DOX浓度的增加,细胞毒性也增强.当DOX浓度达到16μmol/L时,游离DOX组的细胞存活率为40%,DAH组为33.4%.通过对比可以看出,DAH表现出优于游离DOX的药物活性,这可能与HA的靶向介导有关,HA的引入提高了DAH进入细胞的效率.
由图8(B)可见,相同浓度的DAH在不同功率的激光器作用下,细胞的存活率出现了明显的差别.DAH浓度为16μmol/L时,在0.5 W/cm2功率激光照射下细胞的存活率34.23%,与非光照条件下的结果(33.44%)接近,说明在低功率激光下光热效果不明显,主要靠DOX的化疗作用.而在1和2 W/cm2功率激光照射下,细胞的存活率分别为12.45%和5.36%,与低功率(0.5 W/cm2)激光组及非光照组相比明显降低,说明在较高功率的激光照射下DAH的光热能效满足杀死细胞的温度,再结合DOX的化疗效果,使癌细胞的生长得到有效地抑制.化疗与光热疗法的共同作用使DAH表现出更高效的细胞杀伤性.
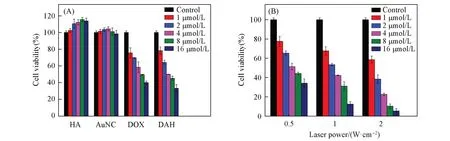
Fig.8 Survival rate of A549 cells cultured with HA,AuNC,DOX and DAH(A)and treated with DAH under the action of different laser power for 24 h(B)
通过观察对比A549和L929细胞对DAH和游离DOX的摄取情况.图9给出L929细胞与游离DOX和DAH共培养24 h后的激光共聚焦图像.从图9可以看出,经过24 h共培养后,游离DOX组的红色荧光明显强于DAH组.这主要是因为游离DOX是小分子,其通过自由扩散的方式进入到细胞内,扩散速度快,进入细胞的量更大;而DAH体积较大,只能通过胞吞的方式进入细胞,进入过程较慢,并在内部环境刺激下才能释放出DOX.所以游离的DOX会比DAH更多进入到细胞,甚至细胞核.

Fig.9 Optical and fluorescence images of L 929 cells treated with free DOX(A 1—A 4)and DAH(B1—B4)for 24 h
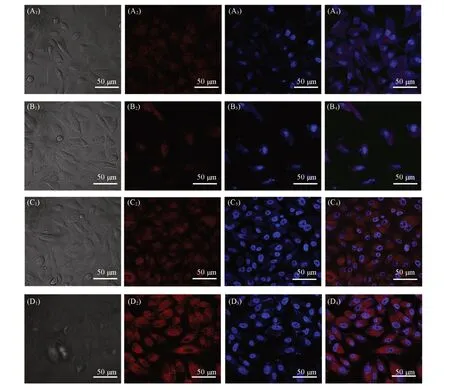
Fig.10 Optical and fluorescence images of A549 cells treated with free DOX(A 1—A 4,C1—C4)and DAH(B1—B4,D 1—D4)for 4 h(A 1—A 4,B1—B4)and 24 h(C1—C4,D1—D4)
图10示出了CD44高表达的A549细胞对游离DOX和DAH的摄取情况.可见,游离DOX和DAH与A549细胞孵育4 h后,两组细胞的红色荧光强度相近.理论上游离DOX在短时间内可以通过自由扩散迅速进入细胞,表现出更强的荧光;但由于DAH表面的HA与肿瘤表面的CD44蛋白受体的靶向结合,加快了DAH进入细胞的速度,导致两者进入细胞的DOX的量差别较小,荧光强度相当[35,39].随着DOX在体液中浓度的降低,自由扩散的速度也随之减慢;但DAH通过靶向效应及胞吞进入细胞,其进入细胞的速度与浓度无关,所以DAH能够始终保持较快的速度进入细胞.于是24 h后DAH组的红色荧光强度明显强于游离DOX组.对比A549和L929对DAH的摄取情况可以看出:DAH对CD44高表达的A549细胞具有典型的靶向作用.
3 结 论
采用简单的一锅法合成了以负载DOX的金纳米笼为核、改性透明质酸为壳的核壳结构多功能纳米载药体(DAH).实验结果表明,DAH的粒径在110 nm左右,表面电位为-15 mV.DAH在pH=5.0的PBS中20 h的累计释放率为77.8%;与在PBS(pH=7.4)中相比,在不同浓度HAase的PBS溶液中DAH都表现出明显的释放增强,表明DAH具有较好的pH和酶响应性.此外,DAH拥有较好的光热转换稳定性和较高的转换效率.在细胞毒性实验中,HA表现出一定范围内完全无毒性,AuNC在较低浓度下也表现为无细胞毒性,这也表明载体AuNC@HA具有良好的生物相容性;而DAH组在2 W/cm2激光照射后细胞存活率仅为5.36%,表现出较高的治疗性能.更重要的是,透明质酸修饰的纳米粒子能够更快更多地被癌细胞摄取.具有多重敏感性能、可结合多种疗法的纳米载药体系能够明显提升对癌症的治疗效果,具有一定的研究价值.