参与植物非生物逆境响应的DREB/CBF转录因子研究进展
刘坤 李国婧 杨杞
(1. 内蒙古农业大学农学院,呼和浩特 010019;2. 内蒙古农业大学生命科学学院,呼和浩特 010019)
植物生长和发育的环境十分复杂,常常遭受如干旱、涝害、高盐碱、重金属(铅、Al3+、Cd2+、Fe2+)、极端温度以及对流层臭氧等逆境胁迫,严重时甚至会导致植物死亡,造成农作物大量减产,从而严重影响农业生产效益和生态环境。因此,提高植物抗逆性,降低逆境对植物的伤害,阐明植物抗逆机理意义重大。为应对外界不利环境,提高对逆境的适应性,在进化过程中,植物通过调节相关基因和功能蛋白的表达,激活体内免疫防御应答机制,提高自身对外界环境的适应性[1]。转录因子(反式作用因子)是植物中最重要的一类DNA结合蛋白,能够与启动子区域顺式作用元件(即特定的DNA序列)特异性结合,在时间和空间上协同调控下游基因的表达;或者通过转录因子之间以及与其他相关蛋白之间的相互作用,激活或抑制基因转录[2]。近几十年来,科学家们已经相继从许多种植物中分离出一系列调控生物以及非生物胁迫基因表达的转 录 因 子,包 括AP2/ERF、bHLH、bZIP、MYB、WRKY、NAC、TCP等,其中,AP2/ERF是植物中广泛存在的一类转录因子超家族,含有AP2/ERF结构域,具有DNA结合功能,与植物的生长发育及逆境胁迫响应密切相关[3]。DREB转录因子属于AP2/ERF转录因子超家族的一个亚家族,能够与DRE/CRT(dehydration responsive element/C-repeat)顺式作用元件或具有DRE元件的核心序列(CCGAC)特异结合,故DREB转录因子又被称作CBF(C-repeat binding factor)转录因子。已有研究表明,DREB转录因子参与调控逆境响应基因表达,介导非生物胁迫信号的转导[4]。本文将从DREB转录因子结构特征、分类以及逆境胁迫应答等多个角度,对近几十年特别是近5年来国内外有关DREB类转录因子在植物抗逆领域中的作用及研究进行综述,以期为全面了解植物抗逆分子机制提供参考。
1 AP2/EREBP转录因子家族的结构特征
AP2/EREBP(APETALA2/ethylene responsive element binding protein)或AP2/ERF(APETALA2/ethylene responsive factor)参与植物的生长发育、激素调控、病原反应、逆境胁迫应答等相关生物学过程,这类转录因子的DNA结合域均为保守的AP2/EREBP结构域(简称AP2结构域),因而统称为AP2/EREBP或者AP2/ERF转录因子[5-6]。AP2结构域长度为57-70个氨基酸残基,其典型的三维结构是由1个双亲性的α-螺旋和3个反向平行的β-折叠所构 成[7-8]。此外,在AP2结构域的N-末端和C-末端上还分别含有YRG和RAYD保守元件,长度分别为19-22个和43个氨基酸残基。这两个元件对于AP2/ERF转录因子识别下游特异性DNA序列非常重要[8]。Sakuma等[9]依据AP2结构域的相似性以及数量将拟南芥AP2/ERF转录因子家族分为5个亚家族,包括AP2、DREB(dehydration responsive element binding protein)、ERF(ethylene response factor)、RAV(related to ABI3/VP1)和Soloist类。AP2亚家族含有2个相似度很高的且串联的AP2结构域,DREB和ERF亚家族均含有1个AP2结构域,其中DREB亚家族AP2结构域第14位和第19位氨基酸为Val和Glu,而ERF亚家族AP2结构域第14位和第19位氨基酸为Ala和Asp,序列的细微差别直接影响到转录因子与下游DNA序列结合的特异性[10-12]。 DREB转录因子能够与启动子区域DRE/CRT元件结合,参与植物逆境胁迫应答过程。DRE/CRT基序含有6 bp的保守核心序列:A/GCCGAC,该序列在干旱响应基因RD29A(responsive to desiccation 29A)的启动子上首次被发现,并且已有研究表明,RD29A能够在干旱、高盐和低温的诱导下表达水平升高[13]。而ERF亚家族能够特异性识别GCC-box(A/GCCGCC),从而调控植物对乙烯、病菌侵害以及非生物胁迫的应答反应[14]。另外,DREB和ERF亚家族又各进一步分别细分为6个组,A1-A6组和B1-B6组[9]。RAV亚家族包含1个AP2结构域和1个B3结构域,Soloist类中也含有1个AP2结构域,但是其氨基酸序列和结构与其他亚组相差甚远,且Soloist类的AP2结构域中不含有WLG基序[15]。
2 DREB转录因子的特点与分类
不同物种间DREB转录因子的AP2结构域具有较高的相似性,尤其是在序列的中间位置相似性较高,而在结构域的两端相似性较差。DREB A1组转录因子羧基末端包含高度保守的LWSY序列,在AP2结构域的上游具有核定位信号(NLS)PKK/RPAGRxK -FxETRHP,在结构域的下游包含DSAWR基序[16]。DREBA2组与A1组相比略有不同,在序列的羧基端包含保守GDDGFSLFxY序列,在AP2结构域上游包含保守PKK-like核定位信号,序列为RKxPAKGSKKGCMxGKGGP ENxx,结构域下游没有出现特异性序列。DREB A3组转录因子在序列的羧基端包含高度保守的GSIWDxxDPFF序列,同时在AP2结构域上游包含RKxxxxKGGPxNxKF保守序列。DREB A4和A5组结构域中无特异性序列出现。DREB A6组转录因子在羧基末端包含保守KYPSxEIDW序列[17-18],在基因结构中间位置富含丝氨酸和苏氨酸,并且与AP2结构域相邻,在特定条件下可被磷酸化[17,19]。
不同组的DREB转录因子对于识别下游DRE/CRT基序核心序列A/GCCGAC的特异性不同,有学者研究发现,将序列中第二个A突变为C或者T时,或者将第3位C突变为T时,DREB1A依然可以结合DRE核心序列,而DREB2A则失去结合能力[9]。此外,将DREB1A AP2结构域上的谷氨酸(E)突变为谷氨酰胺(D)后,其依然能够结合DRE/ CRT元件,但不能识别GCC-box;如果将缬氨酸(V)突变为丙氨酸(A),则不能特异性识别DRE/CRT元件和GCC-box。结果表明,DREB 1A转录因子第14位缬氨酸(V)在识别下游启动子作用元件中具有十分重要的作用。然而,如果将DREB2A中第14位的V和第19位的E任意突变一个,DREB2A就失去了与DRE/CRT元件结合的能力,表明这两个氨基酸在调控DREB2A基因特异性结合下游DNA序列上均具有重要的作用[9]。
有学者根据DREB转录因子序列的结构与特点,对拟南芥中DREB A1组成员进行了更为细致的分类,其中,DREB A1组共包含6个成员,分别为CBF1(C-repeat-binding factor 1)/DREB1C、CBF2/ DREB1B、CBF3/DREB1A、CBF4/DREB1D、DDF1(dwarf and delayed-flowering 1)/DREB1E和DDF2/DREB1F。根据基因功能的不同,这6个成员又被分为两组:其中一组CBF1/DREB1C、CBF2/DREB1B、CBF3/DREB1A为第1类,另一组CBF4/DREB1D、DDF1/DREB1F和DDF2/DREB1E为 第2类[20-23]。DREB A2组有8个成员,按照基因间亲缘关系可以被分为3小组,第1小组为DREB2A、DREB2B、DREB 2C、DREB 2E和DREB 2H,第2小 组 为DREB2D和DREB2G,第3小组为DREB2F。与拟南芥相比,水稻(Oryzae sativa)DREB A2组包含6个成员,其中,OsDREB2A和OsDREB2B为第1类,OsDREB2C为第2类,OsDREB2E为第3类,OsABI4为第4类,而OsDREB2D基因的序列明显不同于其他OsDREB2s基因序列,故未将其进行分类[24-25]。拟南芥DREB A3组只有一个成员ABI4,但由于其与水稻DREB A2组中第4类成员OsABI4相似性较高,有人也将其归为DREB A2组的第4类[24]。拟南芥DREB A4组有16个成员,包括TINY和TINY2等[26]。DREB A5组也有16个成员,包括RAP2.1(related to AP2 1)、RAP2.9(related to AP2 9)和RAP2.10(related to AP2 10)等[8]。DREB A6组有9个成员,其中包括RAP2.4(related to AP2 4)等[9]。
3 DREB转录因子家族鉴定与分析
早在2002年,Sakuma等[9]就报道拟南芥中含有145个AP2/ERF转录因子,其中,DREB亚家族共56个成员,占总数的38.6%,其中A1-A6组成员数量分别为6、8、1、16、16和9个。另外,ERF亚家族共有65个成员,AP2亚家族共有17个成员,RAV亚家族共有6个,以及1个Soloist成员:AL079349。2006年,Nakano等[15]又在Sakuma的研究基础上进行了更进一步分析,发现在拟南芥中共有147个AP2/ERF转录因子成员,其中包含在Sakuma等研究中未发现的AP2亚家族成员At5g60120以及ERF亚家族成员At1g22190。Soloist亚家族基因为At4g13040,这与Sakuma等[9]的研究结果一致。另外,Nakano等[15]将Sakuma等分类中的DREB和ERF 2个亚家族分为1个家族,命名为ERF家族,其中Group I-Group IV为DREB亚家族成员,数量为57个,Group I(A6)、Group II(A5)、Group III(A1、A4、A5)、Group IV(A2、A3) 组成员数量分别为10、15、23和9个。
目前,国内外学者对DREB转录因子家族的报道较多,涉及的植物种类较为广泛,涵盖了禾本科、豆科、十字花科、杨柳科等。然而,对于同一种植物,不同学者可能有不同的看法,例如Song等[27]研究发现,油菜(Brassica rapa)中AP2/ERF转录因子超家族成员的数量为291个,其中DREB转录因子的数量为107个,占36.77%;而其他学者则认为,油菜中AP2/ERF转录因子超家族成员的数量是281个,其中DREB转录因子为105个,占37.37%[28]。苟艳丽等[1]、邵文靖等[29]和张麟等[3]认为茄科作物马铃薯含有246个AP2/ERF转录因子家族成员,其中DREB类转录因子为58个,占23.58%;番茄中共含有190个AP2/ERF转录因子家族成员,DREB类转录因子占23.16%,数量为44个。而Charfeddine等[30]和Sharma等[31]研究表明,马铃薯和番茄中分别含有181和112个AP2/ERF转录因子,其中DREB类分别为65和25个,占比为35.91%和22.32%。Nakano等[15]研究表明,在水稻中AP2/ERF转录因子家族基因共有157个,其中DREB转录因子共有56个,占35.67%;而Sharnoi等[32]持不同观点,他认为水稻中有163个AP2/ERF转录因子,其中DREB转录因子共有57个,占34.97%(表1)。另外,二穗短柄草(Brachypodium distachyon)、毛竹(Phyllostachys edulis)等植物中也存在类似问题,究其原因可能是:第一,存在可变剪接。有学者认为,虽然来源相同,但是可变剪接体在DNA序列上就存在差异,每一种剪接体都应该被认为是单独的一个基因家族成员,而有的学者则认为只要可变剪接体的来源是相同的,就认为是家族中的一个基因。第二,AP2结构域的差异。AP2/ERF转录因子基因结构上含有典型的AP2结构域,对于只含有AP2结构域的基因均归为AP2/ERF转录因子家族成员,但一些人认为,基因结构上除了含有AP2结构域之外,如果还具有其他的结构域,那么也要归为AP2/ERF转录因子家族中。第三,AP2结构域的完整性。对于一些AP2/ERF结构域完整性较低的基因,一些学者认为也可以归为家族成员中,而有的学者只对具有完整AP2结构域的基因进行了统计。
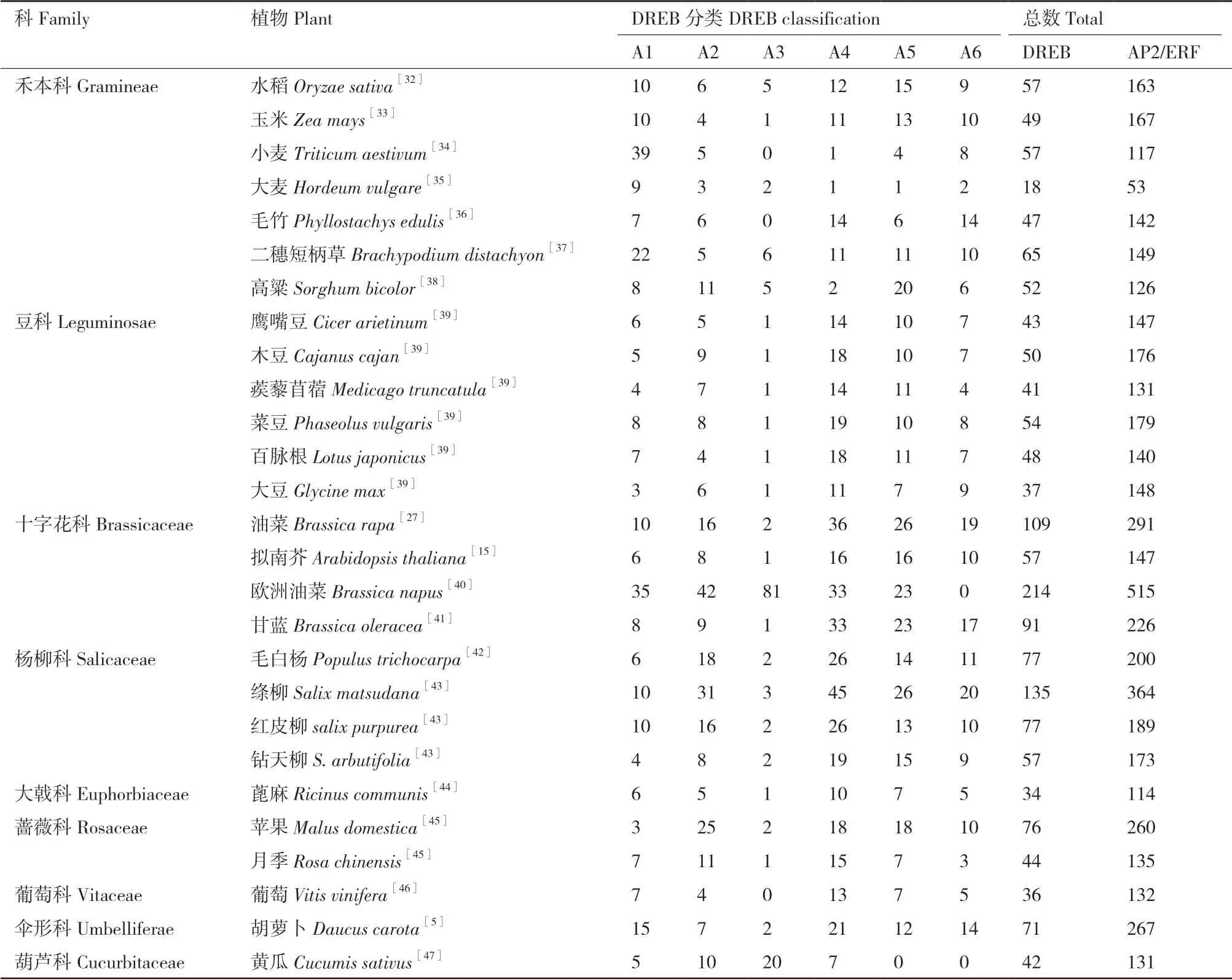
表1 不同植物AP2/ERF类转录因子总结Table 1 Summary of AP2/ERF transcription factors in different plants
4 DREB转录因子在非生物胁迫中的功能
植物DREB类转录因子能够响应非生物胁迫,能够在逆境条件下提高植物的抗逆性。同时,DREB类转录因子对植物激素信号也非常敏感,在植物激素信号转导通路中具有重要作用[13]。
4.1 低温及冷胁迫响应机理及功能
农作物遭受低温及冷害后会大幅减产,作物的品质也会受到影响,如何提高植物在冷害胁迫条件下的抗性一直以来备受人们关注。近几年,人们对于植物冷胁迫耐受调控机理也进行了深入研究。外界冷信号刺激质膜上钙离子通道(Ca2+channel)、蛋白激酶(protein kinases)以及COLD1(cold sensor chilling-tolerance divergence 1)冷响应受体。蛋白激酶OST1(open stomata 1)、MPK3/6(mitogen-activated protein kinase 3/6)以及BIN2(brassinosteroid-insensitive 2),E3连接酶HOS1(high expression of osmotically responsive genes)、PUB25/26(U-box type E3 ubiquitin ligases 25/26)和SUMO E3(small ubiquitinrelated modifier E3)连接酶SIZ1(SAP and MiZ1)等在翻译后水平参与调控ICE1(inducer of CBF expression 1)和MYB15(myeloblastosis 15)等关键转录因子的活性。ICE1属于bHLH转录因子家族,能够识别CBFs基因启动子区域的MYC元件[48],激活CBFs基因的表达,激活后的CBFs可以直接与冷防御基因如CORs(Cold regulated)上的DRE/CRT元件结合,激活CORs基因的表达,最终通过激活抗冷蛋白或ROS清除系统,增强植物的抗冷性[49]。MYB15是MYB转录因子家族中的一个抑制子,其可以与ICE1相互作用,进而识别CBF基因启动子区域的Myb识别元件,抑制CBFs基因表达[50]。
在冷胁迫下,COLD1能够与RGA1(rice G-pro- tein α subunit 1)亚基互作,激活下游第二信使,如Ca2+信号等,随后将信号级联传递给蛋白激酶,如OST1等。OST1磷酸化ICE1,使ICE1变为激活态,最终激活CBFs基因表达[51]。除了ICE1外,近期研 究 发 现,BTF3(basic transcription factor 3)和BTF3L(BTF3-like)也是OST1的催化底物。BTF3蛋白是新生多肽相关复合物的β亚基,能够提高植物的抗冷性。OST1能够磷酸化BTF3和BTF3L,促使BTF3蛋白与CBFs转录因子互作,使CBFs蛋白在冷胁迫下更稳定[52]。另外,在外界冷信号到来时,OST1也同样受到ERG2(clade E growth regulating 2)的调控。ERG2属于PP2C(type 2C(clade E)protein phosphatase)蛋白家族,该蛋白家族在植物响应非生物胁迫以及激素调节过程中发挥着重要作用,但其行使功能不依赖于ABA[51]。
研究发现,冷信号途径中的一些重要组分可能会被E3泛素连接酶识别,进而使其泛素化并且通过26S蛋白酶体途径降解。然而最近有研究报道,CBF转录因子同样也会经过26S蛋白酶体途径而降解。在冷胁迫下,CRPK1(cold-responsive protein kinase 1)磷酸化14-3-3蛋白使其从质膜转移到细胞核,进入细胞核的14-3-3蛋白与不稳定的CBFs转录因子结合,从而减弱CBF通路的表达,避免对冷胁迫产生过度响应[53]。此外,在冷胁迫下,有活性的OST1可以磷酸化2个U-box型E3泛素连接酶PUB25和PUB26,增强其泛素连接酶活性,激活MYB15的泛素化降解途径,从而正调控冷胁迫[54]。
植物DREB转录因子的6个亚家族中,A1亚家族成员(CBF/DREB1s)对冷胁迫敏感,几乎都能够受到冷胁迫的诱导,能够调控冷胁迫相关基因的表达,如COR47和COR15a等[55-57]。研究表明A1亚家族成员在拟南芥4号染色体上是串联排列 的[20,58],为阐明DREB/CBF转录因子抗冷机理提供了思路。有学者通过CRISPR-Cas9技术获得拟南芥cbf123三突变体株系,经冷冻胁迫后证实cbf123株系不耐受冷冻胁迫[59],而CBFs双突变体的表型则略有差异。拟南芥cbf23双突变体对冷胁迫十分敏感,而cbf13双突变体对冷胁迫没有响应。Jia等[60]利用相同技术获得拟南芥CBFs三突变体幼苗,也命名为cbf123,并发现三突变体cbf123在低温冷驯化后对冷冻胁迫的敏感性要比单突变体cbf2、cbf3以及双突变体cbf13强,以上结果表明,拟南芥DREB A1家族CBF/DREB1s参与植物应对冷胁迫信号,且由于CBF1、CBF2、CBF3在染色体上属于串联排列,所以在冷胁迫信号响应过程中存在一定的功能冗余,且CBF2要比CBF1和CBF3在冷驯化依赖的冷冻耐受方面发挥更重要的作用。但是,目前对于CBFs基因功能的研究存在不同的观点,如Novillo等[61]结果表明,将拟南芥CBF2突变掉后,植株对冷胁迫的耐受力增强,而将拟南芥CBF1和CBF3一起突变后,植株对冷胁迫的耐受力减弱[62],该结果与Jia等[60]结果一致。Zhao等[59]则认为cbf2突变体对冷胁迫稍有敏感,而拟南芥双突变体cbf1cbf3对冷胁迫不敏感。作者对可能的原因进行了分析,拟南芥CBFs基因在染色体上的排列方式是串联的,对其中1或2个基因进行突变时,其他基因可能会受到影响。另外,在CBFs基因的周围含有许多基因表达调控的关键元件,基因的突变会影响关键调控元件的激活,进而影响拟南芥突变体的表型。所以,CBFs基因间复杂的调控关系还有待进一步的研究和验证[51,63]。
除了DREB A1组外,其他组DREB转录因子则对冷胁迫不十分敏感。DREB 2A不受低温诱导,但受干旱和高盐诱导[19]。过表达DREB 2A转基因拟南芥轻微提高对冷害的抗性,显著提高对干旱的耐受性[64]。狼尾草(Pennisetum glaucum)中DREB A2型转录因子PgDREB2A在冷胁迫下的表达水平明显比盐和干旱处理后要高,在处理12 h时表达量最高,是对照组的3倍[65]。水稻OsDREB2B受冷胁迫快速诱导,而OsDREB2A受热、干旱和高盐的诱导,却不受冷诱导[24]。胡杨(Populus euphratica)DREB A2组成员PeDREB2受冷、干旱和高盐的诱导[66]。另外,狗牙根(Cynodon dactylon)BeDREB1和BeDREB2、银 新 杨(Populus alba×P. alba var. pyramidalis)PaDREB2、小 麦TaWDREB2以 及 玉米ZmDREB2A等多种DREB A2组基因均能够受到冷胁迫的诱导[67-70]。拟南芥AtTINY属于DREB A3型,受到干旱胁迫、冷胁迫、乙烯、ABA的强烈诱导,过表达AtTINY后,拟南芥植株矮小且发育迟缓,冷胁迫相关基因COR6.6、COR15A和COR78等上调表达[71]。大豆GmDREB2和GmDREB3均属于DREB A5组成员,均受低温胁迫的诱导,其中,GmDREB3对冷胁迫响应较为迅速,处理0.5 h后即有明显响应,且不受干旱,高盐和ABA的诱导,与DREB A1组基因的表达模式较为相似。过表达GmDREB3拟南芥在冷胁迫下的存活率高于野生型[72-73]。Figueroa-Yañez等[74]研究发现,番木瓜(Carica papaya)CpRap2.1、CpRap2.4a、CpRap2.4b和CpRap2.10受冷胁迫快速诱导,冷胁迫15 min后,基因表达量即有明显提升,将这4个基因转化烟草发现,在冷胁迫处理下,转基因烟草的耐冷性明显优于野生型。以上结果表明,DREB类转录因子在植物响应冷胁迫信号应答途径中具有十分重要的功能。
4.2 干旱、盐和热响应机理及功能
DREB转录因子在响应干旱、盐及热胁迫的过程中发挥着重要的作用,尤其是DREB A2组成员,如DREB2A对干旱和高盐诱导较为敏感,而对低温诱导不敏感,过表达DREB2A拟南芥显著提高植株对干旱的耐受性[64]。DREBA2组转录因子的表达水平在PI-PLC/PA阻遏途径或DRIP1/2参与的泛素化途径的作用下能够维持在一个相对稳定的水平[75],当遭遇干旱、盐以及热胁迫时,核内AREB(ABAresponsive element-binding proteins)、HSF(heat shock transcription factor)及GRF(growth regulation factor)等相关转录调控因子与DREB2s调控元件相结合,启动其转录并翻译成无活性的蛋白,同时被运出细胞核。无活性的蛋白在去磷酸化或者是将PEST序列移除后变成有活性的蛋白。PEST是脯氨酸(proline,P)、谷氨酸(glutamic acid,E)、丝氨酸(serine,S)、苏氨酸(threonine,T)的缩写[76],该序列存在于AP2结构域周围,较为保守,是一种负调控因子(negative regulatory domain,NRD)[64],富含丝/苏氨酸和磷酸化位点,可被蛋白激酶C或酪蛋白激酶2磷酸化[76]。当NRD上的丝/苏氨酸位点被磷酸化后[77],其可充当DREB2类转录因子降解的信号肽,蛋白将被迅速降解[78]。相反,有研究发现,从拟南芥DREB2A蛋白上移除NRD,该蛋白变成一种稳定且激活的状态,能够与下游多种调控因子如HSF、AREB等相结合,调控植物的级联反应,提高植物的抗逆性。由于是组成型过表达,所以转基因拟南芥植株出现生长退化的表型[79]。
在干旱胁迫方面,东京大学Kazuko Yamaguchi-Shinozaki教授团队做出了重要贡献。在正常生长条件下,拟南芥DREB2A蛋白稳定性较差,而干旱和热胁迫下,BPM(BTB/POZ AND MATH DOMAIN proteins)敲除株系中DREB2A蛋白明显积累,且其靶基因表达量明显升高,进一步研究发现BMP能够识别DREB2A蛋白上的NRD(negative regulatory domain)结构域,从而通过E3泛素连接酶途径降解DREB2A,该结果探明了拟南芥DREB2A依赖于NRD降解的主要原因[80]。Kudo等[81]研究表明,过表达DREB1A和OsPIL1拟南芥抗旱性明显提高,表型类似于过表达DREB1A植株,且转录组和代谢组数据表明,双过表达株系中非生物胁迫相关基因(如RD29A、COR15A等)表达量明显升高,可溶性固形物如糖类、氨基酸等均有明显积累。Kidokoro等[82]分析了大豆基因组数据库,鉴定出14个DREB1型转录因子(GmDREB1s),结果表明,多数GmDREB1受多种非生物胁迫(包括冷、干旱、高盐和热等)诱导,另外,通过分析转录组数据发现,过表达GmDREB1B、GmDREB1C、GmDREB1F拟南芥RD29A、RD17、COR15A等表达量明显上调,这与过表达GmDREB1A转基因拟南芥的结果类似,且干旱胁迫处理下,转GmDREB1F拟南芥存活率明显高于对照。在水分缺乏条件下,转拟南芥AtDREB2A大豆中,AtDREB2A表达量明显升高,尤其是在大豆根部,基因表达量最高,且稳定性最强[83]。Mizoi 等[84]发现一个新的大豆DREB A2组基因GmDREB2A;2,其受到干旱、热和低温胁迫的诱导,干旱胁迫下转GmDREB2A;2拟南芥存活率明显高于转空载体拟南芥。Reis等[85]和Souza等[86]在甘蔗中过表达AtDREB2A,并在温室和大田条件下进行干旱胁迫处理,与对照相比,转基因甘蔗下游干旱胁迫相关基因表达量升高,且叶片相对含水量、水势以及光合速率也显著高于对照,植株蔗糖含量和出芽率也明显提高,大田试验结果表明,转基因甘蔗表现出更高的产量和生产力。综上所述,室内和室外田间试验结果均证实,DREB1型和DREB2型转录因子参与调控植物响应干旱胁迫应答。
在盐胁迫下,水稻根特异性诱导DREB转录因子SERF1(salt responsive ERF1)通过MAPK级联信号通路介导植物对高盐胁迫的响应,过表达OsSERF1后,植株耐盐性明显提高[87]。水稻Os- DREB1A和OsDREB1B能够被冷胁迫诱导,且Os-DREB1B也受甘露醇、NaCl和PEG的诱导,过表达水稻OsDREB1A能够提高拟南芥的耐盐性和抗旱性,同时,过表达OsDREB1B能够显著提高转基因烟草的抗逆性[88-89]。转拟南芥AtDREB1C丹参与野生型相比抗旱性更强,SOD、POD、叶绿素含量显著升高,MDA含量显著降低[90]。木薯MeDREB1B受盐、PEG强烈诱导,过表达MeCBF1/DREB1B明显增强了转基因木薯对于冷害、氧化胁迫以及干旱胁迫的耐受性[91]。马铃薯StDREB1和StDREB2分别属于DREB A4和A5组,受干旱、盐及渗透胁迫诱导,与对照相比,转StDREB1和StDREB2马铃薯具有更强的耐盐性,且转StDREB1的马铃薯抗旱性更强,同时,两种转基因马铃薯中胁迫相关基因表达水平明显升高[92-93]。除了DREB 1型转录因子外,棉花DREB A4组成员GhDPB3与拟南芥AtTINY2的表达模式类似,受到干旱和盐胁迫的快速诱导[94]。Liang等[95]在真藓(Bryum argenteum)中发现一种苔藓类物种中特有的DREB转录因子,命名为BaDBL1。从结构分类上看,BaDBL1不属于DREB A1-A6组。BaDBL1受干旱、盐、冷、ABA的诱导。盐胁迫下,转BaDBL1基因拟南芥耐盐性、抗氧化酶系统(SOD、POD、CAT)以及下游胁迫相关基因(AtRD29A、AtCOR15A和AtLEA)表达水平明显上调。此外,Liang等[96]和Li等[97]发现,在拟南芥中过表达真藓DREB A5组基因ScDREB8和ScDREB10能增强拟南芥种子萌发率和耐盐性,究其原因主要是下游胁迫相关基因的表达水平升高以及ROS清除系统酶活性的增强。
此外,DREB转录因子对热胁迫也有明显的响应,大豆GmDREB2A、苜蓿MtDREB2A和拟南芥AtDREB2A受干旱、盐和热胁迫诱导,转基因植株对干旱、盐以及热胁迫的耐受性明显增强[64,84,98]。玉米ZmDREB2A受热胁迫诱导,转基因株系耐热性明显提升[68]。转基因拟南芥中超表达DREB2C后,热响应相关基因表达量升高,说明DREB2C参与植株热胁迫应答途径[99]。木瓜CpRap2.1、CpRap2.10、CpRap2.4a和CpRap2.4b均对热胁迫敏感,其中CpRap2.4a和CpRap2.4b也受到冷胁迫的诱导。在热胁迫下,转CpRap2.4a、CpRap2.4b、CpRap2.1和CpRap2.10烟草幼苗存活率明显高于野生型[74]。将禾本科植物穇子(Eleusine coracana)DREB2A转入烟草中发现,转基因烟草耐42℃高温,不耐盐和渗透胁迫,其耐热机制主要是通过增强体内抗氧化酶(SOD、CAT、GR和POD等)活性,从而提高植株耐热性。此外,在热胁迫下,转基因烟草生长发育、形态以及生理生化指标都优于野生型[100]。过表达和基因沉默番茄(Solanum lycopersicum)DREB A4组基因SiDREBA4后,转基因微型番茄通过调节渗透物质含量、耐逆激素水平和抗氧化酶活性,从而改变植物的耐热性,且SiDREBA4还能够参与调控下游许多热激蛋白(Hsp)的表达[101]。与番茄类似,同源过表达菊花(Chrysanthemum morifolium)DREB A6组基因CiDREB6后,与野生型相比,植株耐热性和存活率显著提高,下游CmHsfA4、CmHSP90以及活性氧清除基因CmSOD和CmCAT表达水平明显提高[102]。这些结果表明,DREB转录因子家族参与植物响应干旱、盐以及热胁迫应答过程,并发挥重要作用。
4.3 其他逆境胁迫响应
除上述逆境胁迫之外,DREB转录因子还能够调控植物对其他逆境胁迫的响应。植物叶片衰老过程受到内源因素以及外界环境的影响,DREB转录因子也参与植物叶片衰老途径。拟南芥DREB A1组成员DEAR4受黑暗胁迫诱导,过表达AtDEAR4拟南芥在正常以及黑暗条件下均能够明显延缓叶片的衰老,说明其参与到植株衰老响应途径中。另外,通过研究发现,DEAR4是通过诱导ROS的产生,最终减轻衰老以及其他胁迫对植物产生的毒害[103]。Liu等[104]在烟草中异源表达川桑(Morus notalilis)MnDREB4A,Schwager等[105]在拟南芥中过表达AtDREB1C后也得到类似的结果,说明DREB类转录因子参与植物衰老调控途径并发挥重要功能。DREB类转录因子也参与到植物应对氧化胁迫过程。在H2O2和百草枯等处理下,转AtCBF2拟南芥抗氧化性显著提高,对AtCBF2拟南芥进行转录组分析表明,下游WRKY、NAC等转录因子差异表达,而SOD和CAT等基因表达量不变,说明DREB结合下游NAC等转录因子,参与植株的抗氧化过程[106]。另外,拟南芥DREB转录因子CRF6也受到氧化胁迫的快速诱导[107]。二色补血草(Limonium bicolor)LbDREB受到盐、渗透以及碱胁迫的诱导,在CuSO4胁迫下,转LbDREB烟草与对照相比可溶性蛋白和脯氨酸含量升高,且K/Na值升高,同时胁迫相关基因包括Cu/Zn超氧化物歧化酶(Cu/Zn SOD)、过氧化物酶(POD)、晚期胚胎发育富集蛋白(LEA)以及脂转运蛋白(LTP)等表达升高,说明LbDREB增强转基因烟草对重金属离子胁迫的耐受性[108]。辣椒(Capsicum annuum)DREB A1组 成 员CaDREBLP1受干旱、高盐以及机械损伤的不同程度的诱导[109]。此外,水稻OsDREB1A受机械损伤短暂而迅速地诱导[89]。水对于植物的生长发育至关重要,但是过多的水分比如水淹或者洪水等则会导致植物低氧胁迫,影响植物正常的生理过程。Du等[110]在基因组水平上分析了玉米AP2/ERF转录因子家族的表达模式发现,在不同水淹时间胁迫下,有38个AP2/ERF家族基因响应较为显著,其中包含10个DREB类亚家族基因,大部分DREB类基因响应较为迅速,在水淹胁迫1 h后,表达量即有明显升高,且随着水淹胁迫处理时间的延长,DREB A1组成员表达量越高,说明DREB类转录因子参与植物应对多种非生物胁迫过程。
5 展望
目前,已对DREB转录因子的结构、类型、表达特性、逆境胁迫下的功能进行了大量的研究工作,为阐明植物抗逆分子机制,进行农林草抗逆新品种的培育提供理论依据。但是,依然存在许多问题,有待进一步研究。
DREB类转录因子的抗逆性和转录调控的研究大部分还只能依赖于异源表达模式植物拟南芥或者烟草,跨物种的异源表达在一定程度上会影响试验结果,导致规律不一致。如果能实现DREB转录因子同源基因表达,将对揭示植物抗逆分子机制,筛选优质农林草资源,完善DREB转录因子在木本植物中的调控网络具有十分重要的意义。另外,对于多年生、体型高大、生命周期长、自身结构复杂、难以进行遗传转化的木本植物来说,大部分根、茎属多年生,而叶为一年生,还有少部分木本植物的根、茎、叶均为多年生,而大部分草本植物均为一年生,木本和草本植物生命特征和周期截然不同,抗逆机制必然存在差异,且与草本植物相比,木本植物的进化程度更高,分子机制也更为复杂。
转入DREB转录因子受体植物不够广泛,所研究的对象主要集中在拟南芥、油菜、甘蓝、蒺藜苜蓿、小立碗藓等植物上,对于大田作物如马铃薯、甜菜、番茄等研究相对较少。如何将植物抗逆基因工程技术有效地应用于田间种植推广,并且被大众普遍接受,还是一个十分漫长的过程。另外,对于一些亲缘关系较远的植物是否有效,还有待深入研究。
植物对胁迫应答的反应是由多基因协同控制的,在整个信号转导网络中,从感知胁迫信号到胁迫应答基因表达都需要各种转录因子与顺式元件间互作与调控才能完成,DREB转录因子所介导的基因表达调控在植物抵御各种环境胁迫应答中发挥重要功能,然而目前的研究方向主要集中在对DREB转录因子家族成员的功能研究上,对其上下游基因的挖掘还有待进一步加强。
总之,对DREB转录因子结构、功能以及作用机理研究的逐步深入,为利用DREB转录因子改良植物抗逆性的基因工程技术,筛选优质抗逆林木和牧草资源,培育抗逆农林草新品种提供了理论依据。

