绿色木霉Tv-1511组蛋白乙酰化酶编码基因TvGCN5的功能分析
张豪 李哲 郭凯 黄艳华 郝永任
(齐鲁工业大学(山东省科学院)生物研究所,济南 250014)
木霉(Trichoderma spp.)属于半知菌类的丝孢纲、丝孢目、丛梗孢科、木霉属,广泛分布于自然界中,是土壤微生物群落的重要组成部分[1]。木霉是一种多功能丝状真菌,在植物促生抗逆、生物防治、纤维素酶生产和生物质利用等方面有着广泛用途。
木霉菌作为生防菌株已得到广泛认可,其对植物病原真菌的拮抗机制包含竞争作用、重寄生作用及抗生作用等[2]。木霉还可以产生一些拮抗性物质和次级代谢产物,对其他微生物产生毒害,抑制其他微生物的蛋白质表达,从而抑制其他微生物的生长。一些研究已经表明木霉对黑曲霉菌[3]、尖孢镰刀菌[4]、炭疽病[5]、菌核病病菌[6]具有拮抗作用。
木霉在自然界分布广泛,常腐生于木材、种子及植物残体上,生长迅速[7],且对营养物质要求低,分泌丰富的纤维素酶系,可在植物残体和土壤等含有有机质的环境中通过菌丝体和繁殖孢子存活,适应力强。另外,近年来越来越多的报道指出,木霉菌能够很好地在植物根部定殖并快速生长,并能伴随根系的生长而拓展[8-9],较好地促进宿主植物生长和抗病性[10]。大量研究表明,木霉可以诱导根际微生物群落组成发生变化,增强养分吸收,稳定土壤养分,促进侧根发育,增加根毛形成[11-12]。同时,木霉还能提高植物耐受非生物胁迫的能力,包括一些盐碱胁迫、干旱胁迫[13]、重金属离子胁迫[14]等。因此,木霉已经被制成孢子粉、发酵液等多种制剂,广泛应用于农业生产中。
研究表明,生长素介导的信号通路是调控木霉生防促生能力的主要方式[15]。木霉处理可以提高植物体内生长素的水平,同时在多种木霉菌的代谢产物中也能够检测到生长素的水平。另外,在多种木霉菌的代谢产物中还分离纯化出了木霉特有的类植物生长素6-PP[16],它不仅能促进植物的生长,还能减少植物病害的发生[17]。
木质纤维素是地球上含量最丰富的可再生资源,其降解主要由以木霉属、曲霉属和青霉属为代表的丝状真菌完成。其中木霉属被公认是产纤维素酶最高的菌种之一,是当前生产上应用较多的菌种[18-19]。里氏木霉和绿色木霉是木霉属中纤维素酶的有效生产者,是现代工业发酵生产线上不可缺少的“生物机器”[20-21]。同时,也有研究表明,木霉通过分泌纤维素酶分解植物细胞壁,从而实现更好的根系定殖效果[22]。木霉在产纤维素酶方面具有菌体生长量大且迅速、酶系齐全、产酶量大、酶活性高、降解木质纤维素能力强、绿色高效以及自身生长营养需求简单等优点。
组蛋白的翻译后修饰在染色质调节中起着至关重要的作用。它确保开放染色质结构的保真度,增加基因表达和其他DNA活动[23-24]。GCN5是第一个被鉴定的组蛋白乙酰基转移酶[25],属于GCN5相关的N-乙酰转移酶(GNAT)超家族[26],最初是从氨基酸合成缺陷的酵母突变体中鉴定出来的[27],被确认为是组蛋白乙酰化修饰的必需条件。GCN5通过催化核心组蛋白N末端尾部特定赖氨酸残基的乙酰化而参与染色质修饰[28]。在酿酒酵母、曲霉菌以及木霉菌的研究中表明,GCN5对于维持全基因组组蛋白乙酰化的基础水平具有决定性的作用,但是其在丝状真菌生长发育、代谢调控等方面的功能研究还比较少。Xin等[28]通过序列比对和功能分析鉴定了酿酒酵母GCN5的里氏木霉直系同源物,并构建了里氏木霉GCN5缺失突变株,对里氏木霉纤维素酶活性和乙酰化水平等测定后,发现里氏木霉TrGCN5在丝状生长、形态发生和包括纤维素酶编码基因在内的特定基因的转录激活中起着关键作用。Zheng等[29]通过铜抑制现象实现了木霉GCN5缺失的效果,从而降低了木霉的营养生长和产孢量,而且还严重损害了木霉纤维素酶基因的表达。
木霉体内代谢途径丰富,代谢产物繁多,其基因转录和表达受到复杂而严格的调控[30-31]。利用基因组分析和基因工程技术,发掘木霉中重要的代谢途径和功能基因,是对木霉进行遗传改良的有效途径。本文鉴定了绿色木霉Tv-1511中的组蛋白乙酰化编码酶基因TvGCN5,并对TvGCN5在木霉促生抗逆、次级代谢以及产纤维素酶等方面的功能进行了分析和鉴定。
1 材料与方法
1.1 材料
1.1.1 供试菌株 绿色木霉(Trichoderma viride)Tv-1511,本实验分离保存,在中国普通微生物菌种保藏中心的保藏号为CGMCC No. 16800,保藏日期为2018年12月04日,保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
1.1.2 培养基 培养基均是购买于青岛高科园海博生物技术有限公司。PDA培养基(g/L):马铃薯浸粉6.0,葡萄糖20.0,琼脂20.0。LB培养基(g/L):胰蛋白胨10.0,酵母浸粉5.0,氯化钠10.0,琼脂15.0。
1.1.3 试剂 潮霉素;氨苄青霉素。溶液A:1.2 mol/L D-sorbitol,0.1 mol/L KH2PO4,pH 5.6。溶解酶液:取0.15 g 溶解酶(lysing enzyme,Sigma:L1412)溶于20 mL溶液A,0.2 μmol/L滤膜过滤除菌。溶液B:1 mol/L sorbitol,50 mmol/L CaCl2,10 mmol/L Tris-HCl,pH 7.5。PEG溶 液:25% PEG600,50 mmol/L CaCl2,10 mmol/L Tris-HCl,pH 7.5。
1.2 方法
1.2.1 绿色木霉TvGCN5基因缺失工程菌构建 (1)敲除片段构建:以绿色木霉Tv-1511基因组DNA为模板,扩增TvGCN5基因的上游片段和下游片段,敲除片段扩增引物分别为:上游片段扩增引物TvGCN5-up-F:ACAGTGGGATTTGGAAGTTGGGAT和TvGCN5-up-R:GCCATATTGATGTAAGGTAGCTCAGGTGGAATTAGGTGAGGTAGAGAC;下游片段扩增引物TvGCN5-down-F:GGGTATTCCATCTAAGCCATAGTACCCATGTCACGAAAGGGTTT GGTGGTAT和TvGCN5-down-R:GTGTTGGACGAAGAATGGGAGCAGT。以线性化的pBARGPE1-Hygro质粒为模板,扩增潮霉素抗性基因(HygR),扩增引物为HygR-F:GAGAGCTACCTTACATCAATATGGC和HygR-R:GGTACTATGGCTTAGATGGAATACCC。通过融合PCR构建敲除片段,将PCR产物纯化回收。(2)原生质体制备:接种Tv-1511于PDA平板,28℃培养10 d后,收集分生孢子。在玻璃纸覆盖的PDA平板上,涂布孢子悬液,待PDA平板上的孢子萌发后,将长有菌丝的纤维膜取出并反向贴在含有溶解酶液的平板上,裂解菌丝,收集原生质体,并稀释至107个/mL。(3)原生质体转化及突变子筛选:在离心管中加入原生质悬浮液、纯化的PCR产物、PEG溶液,用枪头混匀,冰上放置20 min,常温下放置5 min,轻轻混匀后将混合液涂布在覆盖层析纸的含1 mol/L蔗糖PDA平板上,待萌发后,将条形层析纸转到含抗生素的PDA平板上,挑取菌落,转接至新鲜的抗生素平板上,培养2 d,筛选并鉴定突变子。
1.2.2 绿色木霉TvGCN5基因过表达工程菌构建 (1)TvGCN5基因表达盒的克隆:以绿色木霉Tv-1511基因组DNA为模板,PCR反应获得带有酶切连接位点(BamH I和EcoR I)的TvGCN5基因表达盒,利用DNA回收试剂盒回收扩增出的DNA片段。连接T载体,测序验证序列的正确性。扩增引物分别为TvGCN5-FL-BamHI-F:CGGGATCCATGGCTGAC GTTAAAGAAGA和TvGCN5-FL-EcoRI-R:CGGAATTCCTACTTCTCCGGCTCGAG。(2)过表达载体的构建及转化:将酶切回收得到的TvGCN5基因表达盒和载体pBARGPE1切胶并回收,利用T4连接酶试剂盒进行DNA片段和表达载体的连接。转化DH5α感受态细胞,并在抗性LB平板上筛选,进行菌落PCR验证。用质粒大提试剂盒提取后经测序验证的表达载体为pBARGPE1-Hygro-TvGCN5,保存备用。(3)过表达工程菌的构建及验证:按照1.2.1的方法制备原生质体,用BamH I酶切表达载体pBARGPE1- Hygro-TvGCN5,获得线性化质粒。在离心管中加入原生质悬浮液、纯化的PCR产物、PEG溶液,用枪头混匀,冰上放置20 min,常温下放置5 min,轻轻混匀后将混合液涂布在覆盖层析纸的含1 mol/L蔗糖PDA平板上,待萌发后,将条形层析纸转到含抗生素的PDA平板上,挑取菌落,转接至新鲜的抗生素平板上,培养2 d,筛选并鉴定突变子。
1.2.3 绿色木霉TvGCN5基因的转录表达和蛋白表达水平分析 将100 μL木霉原始菌株(wildtype)和突变工程菌(Tv-1511-△GCN5和Tv-1511-GCN5-OE)的孢子液分别接种于PDB液体培养基中,28℃,180 r/min培养48 h,通过4层无菌纱布过滤获得无菌的菌丝体。将上述收集的木霉无菌菌丝体,经过液氮充分研磨处理后,用Trizol法提取木霉菌总RNA,并反转录获得cDNA。使用泽叶生物的真菌总蛋白微量提取试剂盒,提取木霉菌的总蛋白。
采用荧光定量PCR检测木霉原始菌株和突变工程菌(Tv-1511-△GCN5和Tv-1511-GCN5-OE)中TvGCN5的转录表达,扩增引物为TvGCN5-qPCR-F:GGAGTGGA AGAATGGCATA和TvGCN5-qPCR-R:GGAGTGGAAGAATGG CATA。利用已知的TvGCN5蛋白的特征序列制备可用于蛋白检测的抗体,制备工作有南京金斯瑞公司完成。利用蛋白质免疫印迹法,检测TvGCN5蛋白在原始菌株(wildtype)和突变工程菌(Tv-1511-△GCN5和Tv-1511-GCN5-OE)中的表达。
1.2.4 绿色木霉组蛋白乙酰化水平分析 为了测定GCN5基因缺失与过表达后,基因组中组蛋白乙酰化水平的变化,利用EpiQuik公司试剂盒(Total H3ac Detection Kit,P-4031)进行组蛋白H3的提取和乙酰化状态检测。
1.2.5 绿色木霉抗逆能力的分析 在PDA平板上活化木霉原始菌株(wildtype)和突变工程菌(Tv-1511-△GCN5和Tv-1511-GCN5-OE),28℃避光培养48-72 h,使得原始菌株和突变工程菌木霉长势均一,再使用打孔器制备大小均一的菌块。一部分菌块转移到含有300 mmol/L NaCl的PDA平板中央,进行耐盐实验研究;部分菌块转移到新的PDA平板中央,放入35℃培养箱培养72 h,进行耐高温实验研究。将不同处理的木霉平板培养一段时间后,分别测量其菌落生长直径。
将200 μL木霉原始菌株和突变工程菌(Tv-1511-△GCN5和Tv-1511-GCN5-OE)的孢子分别接种于含有300 mmol/L NaCl的PDB液体培养基中,28℃,180 r/min培养72 h;再重新取等量的菌丝体分别接种于新的PDB液体培养基中,35℃,180 r/min培养72 h,进行耐高温实验研究。在特定培养时间,收集菌丝,测定生物量。
1.2.6 绿色木霉对植物促生能力的分析 供试植物为拟南芥、椒样薄荷和黄瓜(津研四号)。将上述供试植物进行预培养,并选用长势均一的植物移至水培装置,进行处理。以加入木霉原始菌株或突变工程菌(Tv-1511-△GCN5和Tv-1511-GCN5-OE)的孢子液(终浓度为105)为不同处理组,每个处理设置4个重复,处理一段时间后进行生长指标的测定。
1.2.7 木霉发酵液中的IAA含量分析 将200 μL木霉原始菌株和突变工程菌(Tv-1511-△GCN5和Tv-1511-GCN5-OE)的孢子分别接种于PDB液体培养基(加入或者不加100 μg/mL L-tryptophan)中,28℃,180 r/min培养72 h,通过2层无菌纱布过滤菌丝体,回收液体发酵液,回收的液体发酵液经10 000 r/min离心后取上清,利用HPLC检测发酵液中的IAA含量。
1.2.8 木霉发酵液中纤维素降解酶的活性分析 将200 μL木霉原始菌株和突变工程菌(Tv-1511-△GCN5和Tv-1511-GCN5-OE)的孢子分别接种于MM液体培养基中,28℃,180 r/min培养48 h,通过2层无菌纱布过滤获得工程菌和原始菌株的菌丝体。将菌丝体分别接种于含有微晶纤维素的MM液体培养基(不添加葡萄糖)中进行纤维素酶的诱导培养,72 h后通过2层无菌纱布过滤菌丝体,回收液体发酵液。
回收的液体发酵液经10 000 r/min离心后取上清,制备粗酶提取液,检测纤维素酶的活性。其中滤纸酶(filter paper celluloses,FPase)活性、羧甲基纤维素酶(carboxymethylcellulose cellulose,CMCase)活性检测采用DNS法检测,pNPCase(p-nitrophenyl-β-cellobioside cellulase)和pNPGase(p-nitroph- enyl-β-glucopyranoside cellulase)酶活性采用pNG法检测。
2 结果
2.1 绿色木霉TvGCN5基因缺失和过表达的工程菌的构建
通过融合PCR获得TvGCN5基因的敲除片段(图1-A,B),构建了木霉缺失菌株Tv-1511-△GCN5;通过双酶切法构建了TvGCN5过表达载体(图1-C,D),进一步构建了TvGCN5过表达木霉菌株Tv-1511-GCN5-OE。然后采用荧光定量PCR检测TvGCN5的转录表达,利用蛋白质免疫印迹法,检测TvGCN5的蛋白表达。结果显示,与原始菌株相比,在Tv-1511-△GCN5菌株中检测不到TvGCN5的转录表达(图2-A)和蛋白表达(图2-B,C),而在Tv-1511-GCN5-OE菌株中TvGCN5的转录表达(图2-A)和蛋白表达(图2-B,C)均明显上升。

图1 TvGCN5基因敲除片段及过表达载体的构建Fig. 1 Construction of knockout fragment and overexpression vector of TvGCN5 gene

图2 荧光定量PCR和Western blot鉴定TvGCN5基因过表达和缺失的木霉工程菌Fig.2 Identification of overexpressing or deleting TvGCN5 gene in Trichoderma engineering strains by fluorescence quantitative PCR and Western blot
2.2 过表达TvGCN5基因对绿色木霉组蛋白乙酰化水平的改变
检测了绿色木霉中TvGCN5基因缺失和过表达对组蛋白H3乙酰化水平的影响。结果表明,与原始菌株相比,TvGCN5基因缺失突变体Tv-1511-△GCN5中组蛋白H3的乙酰化修饰水平明显下降(图3),TvGCN5基因过表达工程菌Tv-1511-GCN5-OE中组蛋白H3乙酰化修饰水平明显提高(图3)。

图3 绿色木霉Tv-1511及其工程菌中的组蛋白乙酰化修饰水平的变化Fig.3 Changes in the levels of histone acetylation in T. viride Tv-1511 and its engineered strains
2.3 过表达TvGCN5基因提高了绿色木霉的抗逆 能力
对木霉原始菌株(wildtype)和突变工程菌株(Tv-1511-△GCN5和Tv-1511-GCN5-OE)进行了耐盐耐高温平板实验以及耐盐耐高温液体培养实验。结果发现,在300 mmol/L NaCl胁迫下,TvGCN5基因过表达的工程菌(Tv-1511-GCN5-OE)的直径平均比原始菌株增加了大约(90.8±5.1)%,而TvGCN5基因缺失的工程菌(Tv-1511-△GCN5)的直径平均比原始菌株减少了大约(69.3 ± 3.5)%(图4-A,B)。TvGCN5过表达的工程菌(Tv-1511-GCN5-OE)的生物量比原始菌株提高了大约1.1倍,而TvGCN5缺失的工程菌(Tv-1511-△GCN5)的生物量比原始菌株降低了大约(62.4 ± 4.4)%(图4-C)。这些结果表明TvGCN5基因在绿色木霉耐盐中起着重要作用。

图4 绿色木霉Tv-1511原始菌株及其工程菌耐盐能力的 分析Fig.4 Analysis of the salt tolerances of T. viride Tv-1511 original strain and its engineered strains
在35℃的培养环境下,TvGCN5基因过表达的工程菌(Tv-1511-GCN5-OE)的直径平均比原始菌株增加了大约(82.2 ± 4.1)%,而TvGCN5基因缺失的工程菌(Tv-1511-△GCN5)的直径平均比原始菌株减少了大约(48.8 ± 3.6)%(图5-A,B)。TvGCN5基因过表达的工程菌(Tv-1511-GCN5-OE)的生物量比原始菌株提高了大约(75.3 ± 5.2)%,而TvGCN5基因缺失的工程菌(Tv-1511-△GCN5)的生物量比原始菌株降低了大约(51.9 ± 6.3)%(图5-C)。这些结果表明TvGCN5基因在绿色木霉耐高温中起着重要作用。

图5 绿色木霉Tv-1511原始菌株及其工程菌耐高温能力的分析Fig.5 Analysis of the high temperature tolerance of T. viride Tv-1511 original strain and its engineered strains
2.4 过表达TvGCN5基因的绿色木霉具有更强的植物促生能力
在拟南芥、椒样薄荷和黄瓜种植中,接种了绿色木霉Tv-1511的孢子液,有效地促进了植物的生长,而且接种了TvGCN5基因过表达工程菌菌株(Tv-1511-GCN5-OE)的促生效果更明显(图6-8)。
其中,TvGCN5基因过表达工程菌(Tv-1511-GCN5-OE)对拟南芥的促生效应明显强于原始菌株,其中鲜重提高了(34.1 ± 3.3)%,叶片面积提高了(24.6 ± 3.8)%;而TvGCN5基因缺失工程菌(Tv-1511-△GCN5)的促生效率相比原始菌株明显下降 (图6),其中鲜重降低了(45.9 ± 5.1)%,叶片面积降低了(25.9 ± 4.1)%。
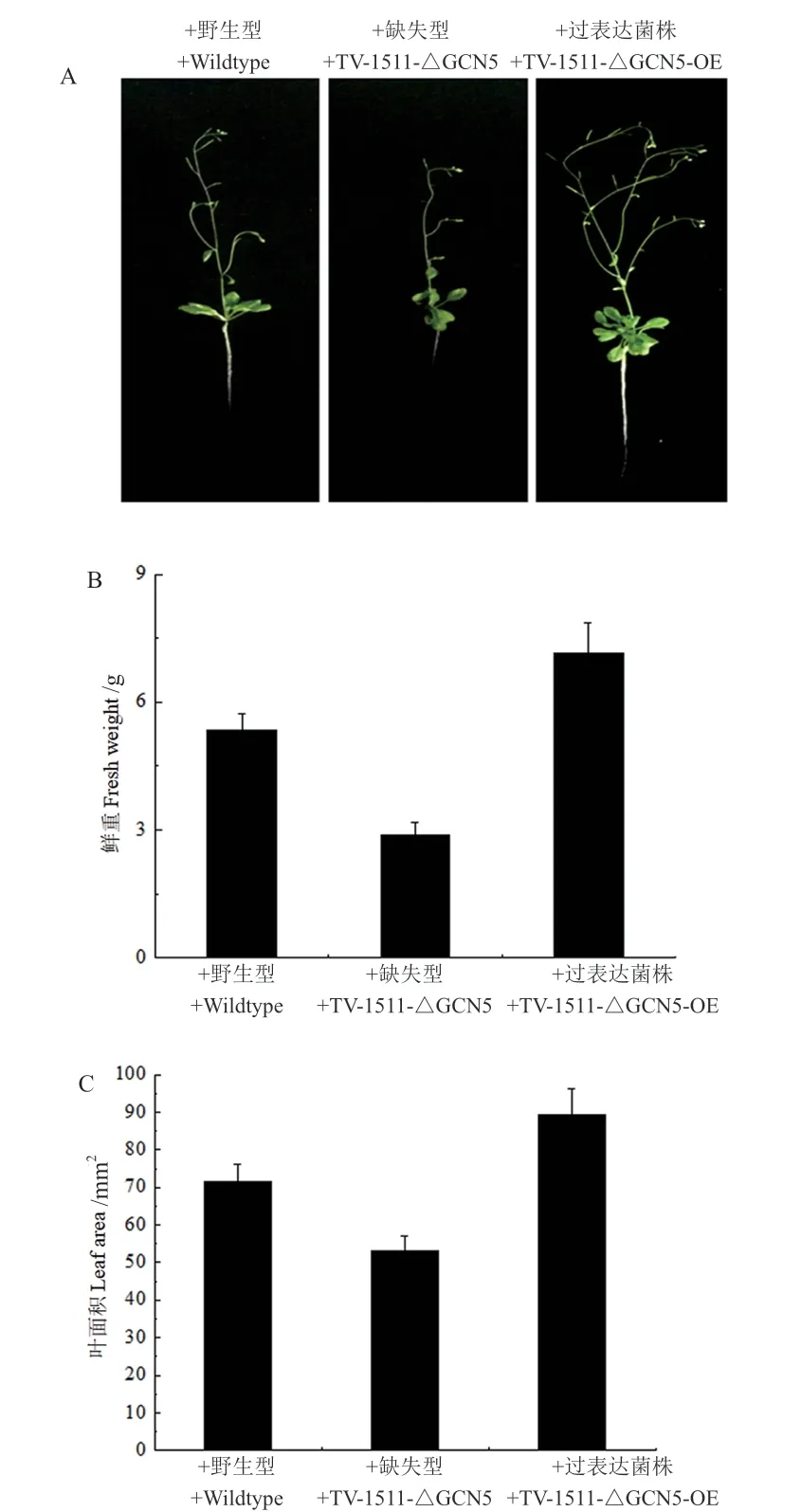
图6 绿色木霉Tv-1511原始菌株及其工程菌对拟南芥促生能力的分析Fig.6 Analysis of the growth-promoting effects of T. viride Tv-1511 original strain and its engineering strains on Arabidopsis thaliana
TvGCN5基因过表达工程菌(Tv-1511-GCN5-OE)对椒样薄荷的促生效应明显强于原始菌株(图7),其中鲜重提高了(48.1 ± 4.5)%,叶片面积提高了(34.3 ± 4.3)%;而TvGCN5基因缺失工程菌(Tv-1511-△GCN5)的促生效率相比原始菌株明显下降 (图7),其中鲜重降低了(40.6 ± 3.1)%,叶片面积降低了(46.1 ± 5.3)%。
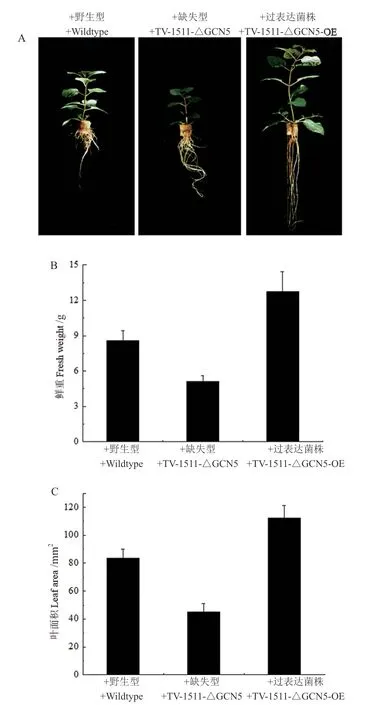
图7 绿色木霉Tv-1511原始菌株及其工程菌对椒样薄荷促生能力的分析Fig.7 Analysis of the growth-promoting effects of T. viride Tv-1511 original strain and its engineering strains on peppermint(Mentha piperita)
TvGCN5基因过表达工程菌(Tv-1511-GCN5-OE)对黄瓜的促生效应明显强于原始菌株(图8),其中鲜重提高了(50.9 ± 6.3)%,叶片面积提高了(14.33 ± 1.3)%;而TvGCN5基因缺失的工程菌(Tv-1511-△GCN5)的促生效率相比原始菌株明显下降(图8),其中鲜重降低了(33.6 ± 2.9)%,叶片面积降低了(26.4 ± 1.9)%。
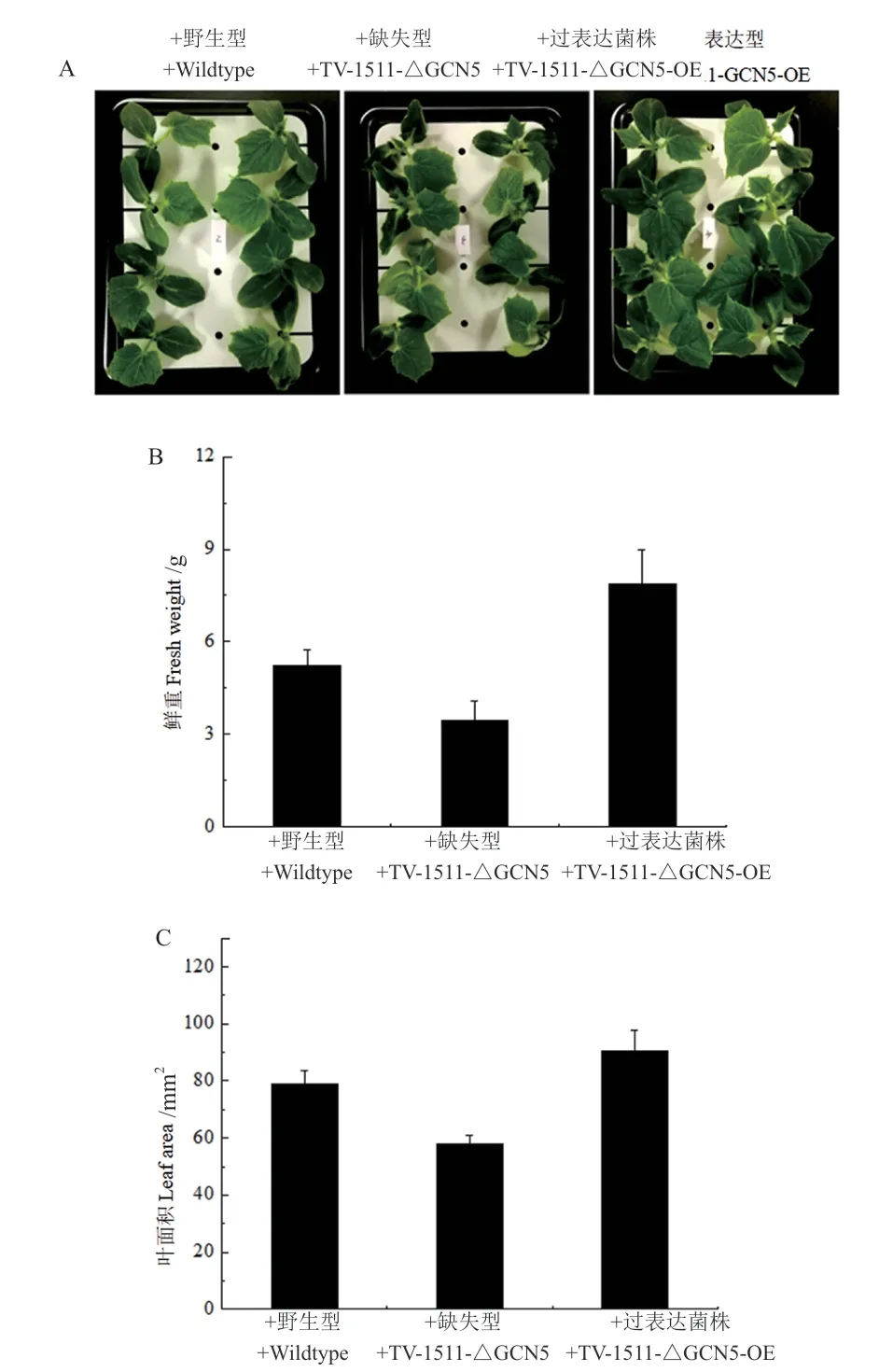
图8 绿色木霉Tv-1511原始菌株及其工程菌对黄瓜促生能力的分析Fig.8 Analysis of the promoting effects of T. viride Tv-1511 original strain and its engineering strains on cucumber(Cucumis sativus L.)
2.5 TvGCN5基因参与调控绿色木霉产IAA的能力
木霉菌能分泌一些植物生长激素等物质,促进植物的生长。因此我们利用液相色谱检测了木霉发酵液中IAA的含量。结果(图9)发现,相比于原始菌株,在加入L-tryptophan 的培养基中,TvGCN5基因过表达工程菌(Tv-1511-GCN5-OE)所产IAA的含量提高了(71.2 ± 6.7)%,而TvGCN5基因缺失工程菌(Tv-1511-△GCN5)则降低了(53.5 ± 3.9)%。这些结果表明TvGCN5基因在绿色木霉产IAA的代谢中起着重要作用。
2.6 TvGCN5基因过表达提高了绿色木霉产纤维素酶的能力
木霉是公认的高效的纤维素酶产生菌,因此测定了TvGCN5基因在绿色木霉产纤维素酶中的作用。TvGCN5基因过表达工程菌(Tv-1511-GCN5-OE)中各种纤维素降解酶的活性均高于原始菌株,其中FPase 活性提高了大约1.3倍(图10-A),CMCase 活性提高了大约(75.2 ± 4.8)%(图10-B),pNPCase 活性提高了大约(74.6 ± 6.2)%(图10-C),pNPGase活性提高了大约(72.9 ± 5.1)%(图10-D);而TvGCN5基因缺失工程菌(Tv-1511-△GCN5)中,各种纤维素降解酶的活性均低于原始菌株(wildtype),其中FPase 活性降低了大约(60.1 ± 3.7)%(图10-A),CMCase 活性降低了大约(41.4 ± 4.4)%(图9-B),pNPCase 活性降低了大约(53.8 ± 5.5)%(图10-C),pNPGase活性降低了大约(61.9 ± 5.8)%(图10-D)。
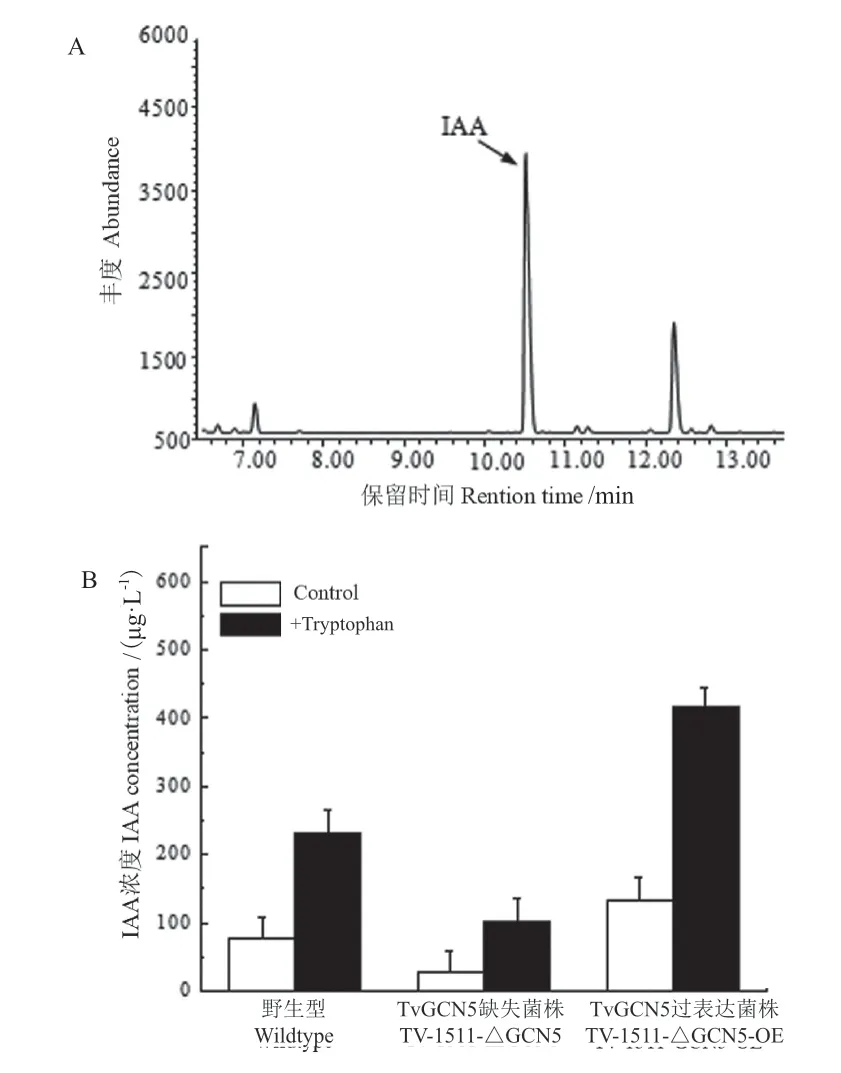
图9 绿色木霉Tv-1511原始菌株及其工程菌发酵液中IAA含量的检测Fig.9 Detection of IAA contents in the fermentation broths of T. viride Tv-1511 original strain and its engineering strains

图10 绿色木霉Tv-1511原始菌株及其工程菌产纤维素酶活性的分析Fig.10 Analysis of cellulase activities of T. viride Tv-1511 original strain and its engineering strains
3 讨论
由组蛋白乙酰转移酶和组蛋白去乙酰化酶催化的组蛋白乙酰化和去乙酰化对于基因表达调节至关重要[32],在生物生长发育中起着重要作用。组蛋白乙酰基转移酶GCN5属于其中重要的一种,在维持全基因组组蛋白乙酰化的基础水平起着重要作用。自从1996年Brownell等从四膜虫核提取物中分离到第一种组蛋白乙酰基转移酶(HAT)——GCN5以来,在酵母、果蝇等生物体内都分离得到了不同的HATs。我们基于前期全基因组测序(DDBJ/ENA/GenBank under the accession VCEC00000000(BioProject:PRJNA543939;BioSample:SAMN11791795))的结果,也从绿色木霉Tv-1511中克隆到了组蛋白乙酰化酶编码基因TvGCN5,并已将基因序列提交至NCBI GenBank(MZ338376)。
本研究通过构建TvGCN5缺失的木霉菌株Tv-1511-△GCN5和TvGCN5过表达的木霉菌株Tv-1511-GCN5-OE,清晰高效的研究了TvGCN5基因在木霉中的作用。木霉菌属于重要的植物根际促生真菌,在植物根际接种木霉孢子液,可以有效的增加植物的鲜重、叶面积等[9-11]。本研究中,绿色木霉对植物的促生作用效果明显,而且经过TvGCN5过表达的木霉菌株Tv-1511-GCN5-OE处理后的植物促生效果比经过TvGCN5缺失的木霉菌株Tv-1511-△GCN5更明显。木霉主要通过重寄生、竞争作用和分泌一些代谢产物等方法产生促生作用。研究表明,木霉属可产生一些挥发性有机化合物,通过土壤空气扩散抑制植物病原真菌的生长[33]或在植物中诱导防御反应[34-36]。木霉的促生作用还表现在木霉可以产生IAA。生长素可以促进根系的发育,促进侧根生长。Contreras-Cornejo HA等通过气相色谱-质谱在木霉培养液中检测到吲哚类化合物吲哚-3-乙酸(IAA)、吲哚-3-乙醛(IAAld)和吲哚-3-乙醇(IEt),并用这3种物质处理拟南芥,揭示了木霉菌促进拟南芥生长的生长素运输/响应基因的调控机制[37]。在本研究中,在TvGCN5过表达的木霉菌株发酵液中检测到了更高浓度的IAA,表明TvGCN5在木霉菌产生生长素的过程中发挥着重要作用。
生物在面对生存环境无时无刻的变化时,组蛋白乙酰化是基因表达可逆和动态变化的重要调节方式。在一些非生物胁迫下,生物可以激活相应的反应基因来耐受不断变化的生存环境。GCN5通过组蛋白乙酰化的方式激活了为菌株提供抵抗非生物胁迫能力的相关基因[38]。GCN5通过调节有关于细胞壁上的重要基因的表达来应对盐胁迫[39]和热胁迫[40]。在工农业生产中,高温胁迫、盐胁迫对于木霉的生长和生产有着重要的作用,严重影响着木霉的代谢活动[30]。本研究中,TvGCN5过表达的菌株在抵抗盐胁迫和热胁迫时,效果也更明显。木霉属是工业上重要的产纤维素酶的菌株。在近些年来,有关表观遗传修饰在真菌产酶方面的研究也在不断深入。Xin等[28]通过敲除里氏木霉中的GCN5,发现里氏木霉产纤维素酶能力异常。在木霉中,cbh1和egl1是主要编码纤维素酶的基因,Xyr1是主要的调控激活因子。周娇娇[41]采用siRNA技术在转录水平上特异性的抑制GCN5的表达发现,组蛋白乙酰化水平降低,Xyr1、cbh1和egl1的表达量降低,木霉产纤维素酶的能力和纤维素酶活也降低。进一步的表明了组蛋白乙酰化酶在木霉产纤维素酶中发挥着重要作用。
4 结论
本研究开展了绿色木霉Tv-1511组蛋白乙酰化酶编码基因TvGCN5(NCBI accession number MZ338376)在木霉促生、抗逆、产酶等方面的功能研究。在过表达TvGCN5基因后,绿色木霉的生长及抗逆境胁迫能力显著提升,其产纤维素酶的水平显著提高,而且其植物促生和产IAA的能力明显增强。表明TvGCN5基因及其参与的组蛋白乙酰化修饰在绿色木霉生长发育、次级代谢以及促生抗逆等方面起重要作用。