L-天冬氨酸-α-脱羧酶的重组表达、定点突变及高通量检测方法的建立
朱秋雨 段绪果
(南京林业大学轻工与食品学院,南京 210037)
L-天冬氨酸-α-脱羧酶(L-aspartate-α-decarboxylase,EC 4.1.1.11,panD)属于氨基酸脱羧酶的一种,能够催化L-天冬氨酸脱去α位的羧基生成β-丙氨酸。该酶最早是由Williamson等[1]从大肠杆菌(Escherichia coli)中分离得到,验证了大肠杆菌中L-天冬氨酸到β-丙氨酸的代谢途径。目前已有多种不同来源的panD的研究报道,主要集中在大肠杆菌[2]、谷氨酸棒状杆菌[3](Corynebacterium glutamicum)、枯草芽孢杆菌[4](Bacillus subtilis)、结核分枝杆菌[5](Mycobacterium tuberculosis)、幽门螺旋杆菌[6](Helicobacter pylori)等。研究发现,大肠杆菌L-天冬氨酸-α-脱羧酶首先转录翻译形成1个无活性的前体蛋白(π-蛋白,约14 kD),随后π-蛋白发生分子内重排,从而导致肽链断裂,自剪切形成1个C端含有羟基的β-亚基(约3 kD)和1个N端含有丙酮酰基的α-亚基(约11 kD),这2个亚基的空间位置非常紧密,但却没有共价键连接[7]。枯草芽孢杆菌L-天冬氨酸-α-脱羧酶蛋白模拟结构与大肠杆菌 L-天冬氨酸-α-脱羧酶蛋白结构非常相似,并且具有保守的切割位点残基,推测也具有类似的自剪切机制。β-丙氨酸广泛应用于医药、食品饲料和化工等领域[8],被认为是12种最具发展潜力的三碳化合物之一[9]。通过panD转化L-天冬氨酸制备β-丙氨酸是主要途径之一,具有重要的工业应用价值,因此近年来panD的克隆表达、分子改造及应用等方面的研究逐渐升温。
研究发现L-天冬氨酸-α-脱羧酶普遍存在酶活力低[10]和稳定性差[11]等问题,筛选高活性、高稳定性panD新酶或酶变体是当前研究的热点,这离不开高效的筛选技术[12]。酶活测定使酶催化功能可以被“量化”,是新酶或酶变体高通量筛选不可或缺的过程[13],开发简单、高效的高通量酶活检测方法是非常重要和必要的。建立有效的高通量检测方法需要满足以下条件[14]:(1)高度的准确性;(2)快速,例如103-104样品/天;(3)易操作;(4)可重复性;(5)廉价并容易获得的筛选底物;(6)无需过于昂贵的仪器设备等。
目前,L-天冬氨酸-α-脱羧酶活力测定方法主要包括高效液相色谱法(HPLC)[15]、荧光法[16]、薄层层析法[17],其中最常用的是HPLC法。但是HPLC法及荧光法检测panD酶活力时,需要使用专用设备及有毒试剂,检测准备过程长、成本高。薄层色谱法灵敏度较低,且难以实现准确的定量分析。因此,建立操作简便易行、灵敏度高的检测方法尤为重要。自1940年以来,pH指示剂已广泛用于检测释放或消耗质子的酶催化反应的进程[18]。原则上,只要缓冲液和pH指示剂具有相等或相似的质子亲和力,pH指示剂的颜色变化可以与脱羧反应期间消耗的质子量成比例,从而提供检测酶活性的定量工具[19]。基于pH指示剂的比色法已经成功检测氨基酸脱羧酶[20]、碳酸酐酶[21]、糖基转移酶[22]和许多其他水解酶[23-24]催化的反应。相比于其他方法,比色法具有安全、简便、成本低且检测时间短等优点,当考虑底物失活时,panD的反应速率可以更精确地通过质子转移速率来确定,而不是通过量化产生的β-丙氨酸,该方法可以连续对反应过程进行检测,不用考虑样品稳定性,因此更能准确测定酶与底物的反应情况[25]。Mo等[25]通过利用HEPES-中性红缓冲液/指示剂对,使用高通量比色法从突变体文库中获得了4个活性分别提高了3.18%-24.69%的L-天冬氨酸-α-脱羧酶突变体。Jiang等[19]证实了4-吗啉乙磺酸(MES)-CPR和3-吗啉丙磺酸(MOPS)-BTB在高通量筛选各种脱羧酶方面具有潜在的应用价值。为了实现高通量筛选L-天冬氨酸-α-脱羧酶这一目标,应仔细研究缓冲液/指示剂对借助酶标仪及微孔板组合的比色法实现酶催化反应高通量检测的适用性。
相较于其他来源的panD,来源于枯草芽孢杆菌的panDBs的活性和稳定性较好,具有较好的工业应用潜力[4],但panDBs仍存在酶活力低和机理失活现象,Pei等[26]利用易错PCR技术,创建了一个随机突变文库,通过测试4 000个转化子,成功筛选到V68I和I88M两个突变体,其酶活和催化稳定性相比野生型分别提高了18%-22%和29%-64%。Qian等[27]利用分子动力学和结构比对方法相结合,筛选到组合突变体Q5(BsPanDI46V/I88M/K104S/I126*)。由于其中2种枯草芽孢杆菌来源的L-天冬氨酸-α-脱羧酶突变体I88M和I46V/I88M/K104S/I126*在一定程度上提高了酶活和减弱了酶的机理失活现象,因此本研究选择这2种突变体与野生酶一起作为模型酶,用于高通量检测方法的验证。
本文首先以Bacillus subtilis的基因组DNA作为模板,扩增得到L-天冬氨酸-α-脱羧酶编码基因并在Escherichia coli BL21(DE3)实现了成功表达,在此基础上采用定点突变构建了2个突变体(I88M和Q5)。然后,筛选了缓冲液/指示剂体系并优化检测体系中缓冲液和指示剂的浓度,建立基于比色法原理的微孔板高通量检测方法。最后以L-天冬氨酸-α-脱羧酶及其突变体作为模型酶,对高通量检测方法进行验证。本方法的建立旨在通过显著提高筛选速度,对筛选和鉴定酶变体具有较好的应用潜力。
1 材料与方法
1.1 材料
1.1.1 菌株 大肠杆菌JM109、大肠杆菌BL21(DE3)、枯草芽孢杆菌168、质粒pET24a(+)由本实验室保存。
1.1.2 培养基 LB种子培养基(g/L):酵母粉5,蛋白胨10,氯化钠10,pH 7.0,121 ℃灭菌20 min。TB发酵培养基(g/L):酵母粉24,蛋白胨12,甘油5,K2HPO4·3H20 16.43,KH2PO42.3,pH 7.0-7.2,121℃灭菌20 min。
1.1.3 主要试剂及仪器 扩增L-天冬氨酸-α-脱羧酶基因panD的引物(表1),上海生工生物有限公司;细菌基因组提取试剂盒、细菌质粒提取试剂盒、DNA琼脂糖凝胶回收试剂盒,天根生化科技有限公司;r Taq DNA聚合酶、dNTP、核酸限制性内切酶Nde I、Sac I和无痕连接缓冲液,大连TaKaRa公司;甲基化模板消化酶(Dpn I)Fermentas公司;L-天冬氨酸、β-丙氨酸、氢氧化钠,国药集团化学试剂有限公司;氯酚红(CPR)、4-吗啉乙磺酸(MES),生工生物工程(上海)股份有限公司。

表1 本研究中使用的引物Table 1 Primers used in this study
PCR仪、电泳仪,美国Bio-Rad公司;722N可见光分光光度计,上海仪电分析仪器有限公司;酶标仪,美谷分子仪器(上海)有限公司;JY92-IIN型超声波细胞破壁仪,宁波新芝生物科技股份有限公司。
1.2 方法
1.2.1 枯草芽孢杆菌L-天冬氨酸-α-脱羧酶基因的克隆及表达载体的构建 提取Bacillus subtilis基因组DNA,以该基因组DNA为模板,通过PCR扩增 L-天冬氨酸-α-脱羧酶基因panD,质粒pET24a(+)采用Nde I和Sac I双酶切,经鉴定、胶回收后通过无痕连接构建重组表达载体pET24a(+)-panD,热激转化E.coli JM109,卡那霉素抗性平板筛选出阳性克隆进行测序分析。将测序正确的质粒转化E.coli BL21(DE3),得 到 重 组 菌E.coli BL21(DE3)/ pET24a(+)-panD。
1.2.2 突变体构建方法 以野生型panDBs基因的重组质粒pET24a(+)-panD为模板,利用表1所示引物对,通过高保真聚合酶pfu进行全质粒PCR。采用Dpn I酶于37℃对PCR产物进行酶切以消化野生型模板。将测序正确的质粒转化表达宿主E. coli BL21(DE3),挑取阳性克隆培养后,得到含有突变基因的重组菌株。
1.2.3 重组蛋白表达及SDS-PAGE分析 挑取单菌落至LB种子培养基中,于37℃摇床200 r/min培养8-10 h,制备种子液。将种子液以5%接种体积分数转接至TB发酵培养基,37℃、200 r/min培养3 h,加入15 g/L乳糖诱导,继续培养36 h。发酵液离心去上清,用缓冲液悬浮菌体至菌体浓度OD600为15,菌体悬浮液经超声波细胞破壁仪破碎后,再经过离心后收集上清液和沉淀,上清液即为L-天冬氨酸-α-脱羧酶的粗酶液,并进行SDS-PAGE分析。此外,对粗酶进行了硫酸铵沉淀、透析和离子交换纯化,得到的纯酶用于后续酶动力学分析。
1.2.4 缓冲液/指示剂检测体系吸光度的确定 氯酚红(CPR)的质子化和去质子化形式的吸收光谱在酶标仪上进行测定。在微孔板中分别加入浓度为5 mmol/L MES缓冲液,分别用盐酸调节至pH 3.0或氢氧化钠调节至pH 9.0,然后加入50 μmol/L CPR指示剂,用酶标仪从350-700 nm进行全波长扫描,记录下指示剂在质子化和去质子化形式下的最大光谱吸收差值。
确定体系检测波长后,制备12.5、25、37.5、50、62.5、75、100 μmol/L的CPR溶液,然后在最佳检测波长下检测溶液的吸光度,验证不同指示剂浓度与吸光度的线性关系,确定该波长是否适用于定量检测。
1.2.5 缓冲液最适浓度的确定 通过检测在酶标板中37℃预热的混合物中添加氢氧化钠后指示剂吸光度的变化来建立校准曲线。测定混合物(250 μL)为75 mmol/L L-天冬氨酸[19](初始pH值为6.5),75 μmol/L CPR和MES(2、5、10、20 mmol/L)。然后,添加100 μL NaOH(0-1 mmol/L)于检测混合物中模拟酶促脱羧反应中质子的消耗。
1.2.6 指示剂最适浓度的确定 测定混合物(250 μL)为75 mmol/L L-天冬氨酸,2 mmol/L的MES和CPR(25、50、75、100 μmol/L)。然后,添加100 μL NaOH(0-1 mmol/L)于检测混合物中模拟酶促脱羧反应中质子的消耗。
1.2.7 酶活的测定 在微孔板中分别加入2 mmol/L MES缓冲液、75 μmol/L CPR指示剂及75 mmol/L L-天冬氨酸溶液于37℃预热10 min,然后加入100 μL酶液。立即在酶标仪中振荡10 s保证完全混匀,并连续测定反应10 min内反应液在567 nm处的吸光值,每隔1 min测一次。
HPLC法:准确吸取500 μL L-天冬氨酸溶液于试管中,加入500 μL MES缓冲液于37℃水浴预热10 min。然后准确加入1 mL酶液,立即摇匀并计时,37℃水浴准确保温酶解反应10 min后,将反应样品置于沸水浴中煮沸5 min,12 000 r/min离心5 min,上清用0.22 μm针头式有机滤膜过滤,等待上样,检测样品中β-丙氨酸含量。HPLC检测条件,检测器为紫外检测器,波长334 nm,色谱柱:安捷伦HC-C18(2)150 mm×4.6 mm,流动相为35 mmol/L含有30%甲醇(pH值7.5)的乙酸钠,进样量:10 μL,流速:1 mL/min,柱温:30℃。
1.2.8 动力学参数的测定 在微孔板中加入2 mmol/L MES缓冲液,75 μmol/L CPR指示剂及不同浓度的 L-天冬氨酸溶液(2、5、10、15、20、30、40、50、60、75 mmol/L)。预热10 min,然后加入100 μL酶液,立即在酶标仪中振荡10 s保证完全混匀,并连续测定反应10 min内反应液在567 nm处的吸光值,每隔1 min测一次。利用Graphpad Prism8.0软件将结果进行非线性拟合测定动力学参数。
1.2.9 酶活计算公式

将指示剂吸光度变化速率与反应速率之间的比例定义为缓冲因子Q。公式中Qexp是实验确定的缓冲因子,为校准曲线斜率1 000倍的倒数,用于计算酶促脱羧反应的速度[18];dA / dt是指示剂吸光度变化的速率[28-29];v为反应体积(L)。酶活力定义:1 min反应产生1 μmol/L产物β-丙氨酸的酶量,定义为1个单位(U)酶活力。
2 结果
2.1 枯草芽孢杆菌L-天冬氨酸-α-脱羧酶在大肠杆菌中的表达
2.1.1 枯草芽孢杆菌L-天冬氨酸-α-脱羧酶基因的克隆及表达载体的构建 首先以提取的Bacillus subtilis的基因组DNA作为模板,进行PCR克隆 扩增,得到panDBs片段(384 bp),与经过Nde I和Sac I双酶切的pET24a(+)胶回收片段(图1-A)进行连接,连接产物转化克隆宿主JM109,测序结果显示质粒上连接的基因序列与panDBs理论序列一致,重组表达载体pET24a(+)-panDBs结构示意图如图1-B所示。

图1 琼脂糖凝胶电泳图及表达载体结构示意图Fig. 1 Agarose gel electropherogram and structural schematic diagram of expression vector
2.1.2 L-天冬氨酸-α-脱羧酶panDBs的定点突变及在大肠杆菌BL21(DE3)中的诱导表达 以pET24a(+)-panDBs为模板,根据表1中的引物,利用PCR介导的方法,分别构建得到带有突变体编码基因的突变体panDBs-1(I46V/I88M/K104S/I126*)和panDBs-2(I88M)。将测序验证正确的重组质粒转化表达宿主E.coli BL21(DE3),得到突变后的重组菌株。重组菌经诱导表达、破碎离心后,菌体破碎上清经SDS-PAGE蛋白分析,结果如图2所示。panDBs和panDBs-1菌体破碎上清中在小于14 kD左右的位置有明显的蛋白条带,与理论蛋白大小一致,说明panDBs基因已成功表达。野生型和突变体panDBs-2只有断裂后较大的α-亚基和较小的β-亚基,表明野生型和panDBs-2可以完全自我剪切。而突变体panDBs-1包括酶原π-蛋白(即没有完成剪切断裂前的蛋白)、少量α-亚基及β-亚基,可能是突变体panDBs-1只能实现部分剪切。
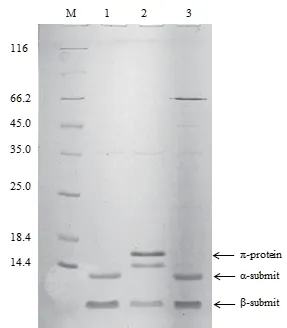
图2 重组酶panDBs及突变体蛋白电泳图Fig. 2 Electropherogram of recombinant protein panDBs and its mutant proteins
2.2 微孔板法酶活测定方法的建立
2.2.1 缓冲液/指示剂体系的选择 L-天冬氨酸-α-脱羧酶在酶促脱羧反应过程中,能够消耗底物L-天冬氨酸生成β-丙氨酸和CO2,每脱去一分子的羧基消耗一分子的质子,因此可以基于酶催化反应中随着质子的消耗而引起的pH值的增加,从而使得指示剂颜色变化的原理建立比色法测定酶活的方法,如图3所示。

图3 比色法测定L-天冬氨酸-α-脱羧酶酶活的原理Fig. 3 Principle for the determination of panD activity by colorimetric method
CPR指示剂在质子化和去质子化状态下在350-700 nm之间的吸收光谱图,如图4-A所示,并且获得了二者光谱吸收差值谱图见图4-B,CPR指示剂光谱吸收差值最显著的波长为567 nm。此外,进一步研究发现,在567 nm波长条件下,CPR浓度与吸光值是成正比的,如图4-C所示,曲线满足回归相关系数R2= 0.99以上,说明此波长适合进行定量检测。因此,选用567 nm波长作为L-天冬氨酸-α-脱羧酶酶活测定的检测波长。

图4 基于比色法的PanD高通量筛选方法的建立Fig. 4 Development of a colorimetric high-throughput screening method for PanD assay
2.2.2 MES缓冲液最适浓度的确定 将不同浓度的氢氧化钠(0-1 mmol/L)加入到测定混合物中模拟脱羧反应中质子的消耗,制作校准曲线观察质子变化与吸光度变化之间的线性关系。首先将CPR指示剂的浓度设定成75 μmol/L,检测不同浓度缓冲液(2-20 mmol/L)对校准曲线的影响,结果如图5所示,使用2 mmol/L MES缓冲液得到的曲线呈大幅度上升的趋势,而更高浓度的3种缓冲液,它们的曲线变化幅度较小,表明缓冲液浓度为2 mmol/L的校准曲线具有较高的灵敏度。此外,将不同浓度缓冲液的回归方程及相关系数进行对比,缓冲液浓度为2 mmol/L的缓冲因子Qexp为0.002 0,并且具有良好的线性,因此在接下来的实验中将MES缓冲液浓度固定在2 mmol/L。
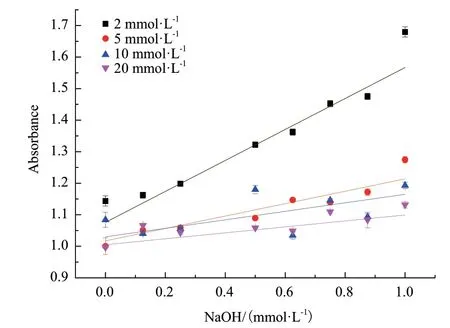
图5 CPR为指示剂时缓冲液浓度对测定体系pH敏感性的影响Fig. 5 Effects of buffer concentrations on sensing pH change using CPR as indicator
2.2.3 CPR指示剂最适浓度的确定 确定MES缓冲液浓度后,进一步检测CPR指示剂浓度(25-100 μmol/L)对校准曲线的影响,如图6结果所示,4种不同CPR指示剂浓度在在氢氧化钠浓度为0-1 mmol/L的线性范围内,曲线上升趋势均较平缓。此外,随着指示剂浓度的增加,Qexp的值逐渐降低,说明指示剂浓度越高,检测的灵敏度越高,这对于检测酶活较低的L-天冬氨酸-α-脱羧酶具有优势,但是观察发现指示剂浓度对初始吸光度值的影响大,高浓度指示剂一开始就具有很高的吸光度值,限制了检测的范围,并且75 μmol/L的指示剂线性良好,因此综合选择75 μmol/L的CPR指示剂进行接下来的实验。
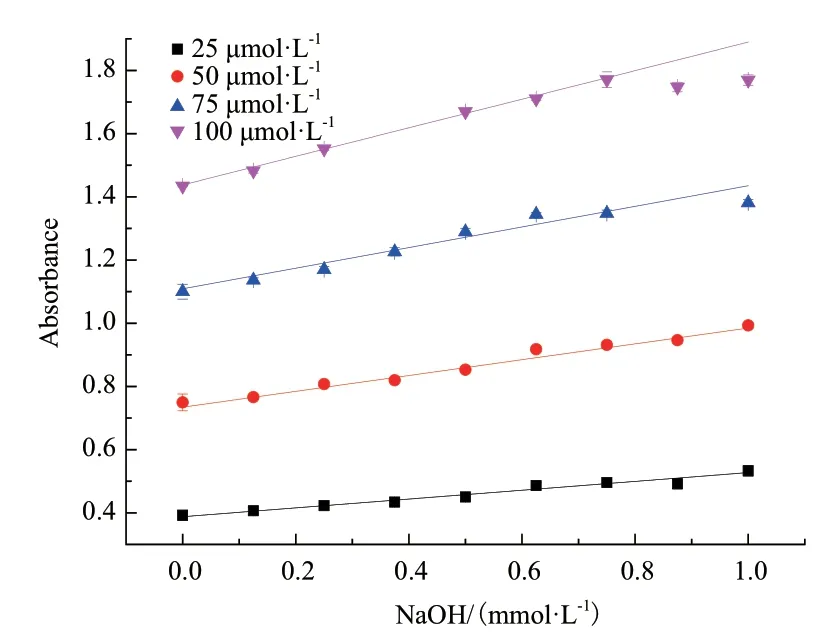
图6 CPR为指示剂时指示剂浓度对测定体系pH敏感性的影响Fig. 6 Effects of indicator concentration on sensing pH change using CPR as indicator
2.3 微孔板法在L-天冬氨酸-α-脱羧酶酶活检测中的应用
微孔板法的建立选择的是浓度为2 mmol/L的MES缓冲液与75 μmol/L的CPR指示剂,在此条件下建立的校准曲线如图7-A所示,回归方程为y=0.285x+1.126 5,R2=0.998 5,该检测体系的线性范围为0-0.25 μmol/(min·mL),最低检测限为0.096 μmol/(min·mL)。进一步测定不同底物浓度下对应的酶反应速率,利用Graphpad Prism8.0软件将结果进行非线性拟合,结果如图7-B所示,根据动力学曲线拟合结果计算出panDBs的Km值为2.78 mmol/L。

图7 PanD活性的测定Fig. 7 Determination of PanD activity
在微孔板中使用CPR-MES体系对反应过程进行检测,加入酶液与仅加入缓冲液的反应体系相比,吸光度值呈明显线性增长,其中突变体panDBs-2的变化速率最大。表2结果显示突变体panDBs-2的Vmax是野生型的1.82倍,通过HPLC方法检测的突变体panDBs-2酶活力是野生型的2.58倍,这两种方法的趋势是一致的。Km值较野生型小,说明该突变体的底物亲和力有所提高。

表2 重组酶及其突变体的部分动力学参数Table 2 Partial kinetic parameters of recombinant enzyme and its mutants
2.4 微孔板法与其它方法对L-天冬氨酸-α-脱羧酶酶活检测效率的比较
对不同的样品数量进行酶活检测,将微孔板法和HPLC法这两种方法所需要的检测时间进行对比。发现当检测样品为1 h,微孔板法需10 min,HPLC法需15 min(仅考虑检测过程,不考虑前期准备时间),两种方法所需时间的差异较小。当样品数量为10个时,微孔板法检测时间需10 min,而HPLC法则需要150 min,随着检测样品数量的增加至30个、50个、80个时,微孔板法的检测时间可近似看成无明显变化,但HPLC法的检测所需时间迅速增加至450 min、750 min甚至1 200 min,由此可以看出HPLC法的检测所需时间与样品数量成正相关。
3 讨论
邓思颖等[4]比较了不同来源的panD 的比酶活,发现来源于枯草芽孢杆菌的panD的活性和稳定性较好,具有更好的应用潜力。而大肠杆菌是常用于生产重组蛋白的宿主之一,与其他原核表达系统相比,大肠杆菌因其遗传背景清楚、繁殖快、成本低、操作简便、可大规模高密度发酵培养等优点被广泛应用于外源蛋白表达研究[30]。枯草芽孢杆菌是革兰氏阳性菌,没有内毒素,是一种安全的蛋白表达系统,作者也尝试过将panDBs在枯草芽孢杆菌中进行表达,但是其表达水平远低于大肠杆菌,因此本文将panDBs在大肠杆菌中进行了表达和研究,后期我们将继续尝试优化枯草芽孢杆菌表达系统,提高panDBs在枯草芽孢杆菌中的表达水平。
基于比色法原理的微孔板高通量检测方法的建立,首先需要选择合适的缓冲液/指示剂体系,该体系需要满足以下几个条件[19,28]:(1)为了保证pH指示剂的颜色变化与脱羧反应过程中消耗的质子数成正比,缓冲液与指示剂的pKa值应该尽可能相等或相似,因此可以通过颜色的变化定量测定目标脱羧酶的催化活性;(2)酶促反应的pH范围需要在指示剂的变色范围内,保证酶具有催化活性;(3)指示剂不能是待测酶的抑制剂且不与酶发生反应。分析发现CPR指示剂颜色变化范围为pH 5.2 (黄色)-pH 6.6(紫红色),L-天冬氨酸-α-脱羧酶在此范围内具有较好活性,同时CPR指示剂和MES缓冲液的pKa值均为6.0,缓冲良好的pH范围为5.5-6.7,且不会对酶活产生抑制作用或发生反应,满足比色法测定L-天冬氨酸-α-脱羧酶酶活的条件,因此实验选用CPR-MES反应体系。
反应体系确定后,为了计算特定反应的速率,需要吸光度的变化与质子消耗之间存在良好的线性关系[18]。公式中dA/dt为指示剂吸光度变化率,当缓冲因子Q很小时,灵敏度最高(最大的dA/dt),降低缓冲液浓度或增加指示剂浓度可以提高检测的灵敏度[29],因此对反应体系中缓冲液和指示剂浓度进行了优化。在最优条件下建立的标准曲线,回归方程为y=0.285x+1.126 5,R2=0.998 5,说明在此检测条件下,pH指示剂的颜色变化可以与脱羧反应期间消耗的质子量成比例,可以用于定量检测酶活力,该检测体系的线性范围为0-0.25 μmol/(min· mL),最低检测限为0.096 μmol/(min·mL),能够满足实际应用的需要,并且方法操作简单,测定结果快速准确。
然后,将优化后的检测体系以L-天冬氨酸-α-脱羧酶及其突变体作为模型酶,对高通量检测方法进行了验证。结果显示,突变体panDBs-2酶活力及底物亲和力均有明显提高,其中突变体panDBs-2的Vmax是野生型的1.82倍,通过HPLC方法检测的突变体panDBs-2酶活力是野生型的2.58倍,这两种方法测得结果的趋势是一致的。并且测得的Km值也与HPLC法(2.02 mmol/L)[26]相近,二者之间的差别可能是采用的检测仪器不同、反应体系体积不同及酶活定义不同所造成的。HPLC法测定的酶活定义为测定体系中产物β-丙氨酸的生成速率,而微孔板法测定的为体系中质子浓度的减少速率。相对而言,微孔板法能更准确测定酶与底物的反应情况,因为该方法是一个连续的反应体系,酶活的测定也是即时的,每60 s进行一次监测,而不用考虑样品的稳定性,而在HPLC方法中则计算的是平均速率,从这个角度看微孔板法可能比HPLC更准确[18]。突变体panDBs-1的Vmax和Km值相较于野生型无明显变化,这可能与酶是否剪切成熟有关。从野生型和突变体的蛋白电泳图发现,突变体panDBs-1没有完全剪切成熟,而野生型和突变体panDBs-2可以自我完成剪切成熟,由无活性的酶原π-蛋白,裂解生成有活性基团丙酮酰基的α-亚基和β-亚基,α-亚基的丙酮酰基才是催化基团[31],从中筛选出的具有优势的突变体panDBs-2,在后续转化L-天冬氨酸制备β-丙氨酸中表现出较好的应用潜力,也说明该检测方法具有一定筛选能力。对比微孔板法与其它方法在L-天冬氨酸-α-脱羧酶酶活检测中的效率发现,一方面,微孔板法操作简单快速,且费用低;另一方面,随着酶分子改造技术的快速发展,突变文库包含的突变体数量巨大(通常含104-106个突变子),用传统的基于HPLC的筛选方法,去逐一测定“海量”样品的活性是十分费时费力的,这对快速、准确的高通量筛选模型的建立提出了更为迫切的要求[32]。高通量筛选模型的建立将大幅度提高筛选速度,对筛选和鉴定酶变体具有较好的应用潜力。
4 结论
对来源于Bacillus subtilis L-天冬氨酸-α-脱羧酶采用定点突变的方法,得到了2个突变体panDBs-1和panDBs-2。建立基于比色法原理的微孔板高通量检测方法,得到最适检测条件为MES缓冲液2 mmol/L,CPR指 示 剂75 μmol/L,L-天 冬 氨 酸75 mmol/L,pH 6.5,温度37℃,反应时间10 min,检测波长为567 nm。
该检测方法具备一定筛选能力,这将显著提高筛选速度,对筛选和鉴定酶变体具有较好的应用潜力。