Mn2O3/Hβ催化热塑性聚氨酯临氧裂解反应动力学
邢佑鑫,费兆阳,2,陈 献,崔咪芬,乔 旭,2
(1.南京工业大学 化工学院,江苏 南京 211800;2.南京工业大学 材料化学工程国家重点实验室,江苏 南京 211800)
由于工业化进程的加快和城市化进程的推进,固体废弃物产生量预计将从2016年的20.1亿t增至2050年的34亿t,其中工业有机固体废弃物占相当大的比例(约30%)[1-3]。工业有机固体废弃物主要包括废塑料[4]、污泥[5]、废树脂[6]等,严重危害人畜健康和生态环境。因此,低成本、环保、高效地处理工业有机废弃物是世界各国面临的紧迫问题。
到目前为止,不可回收的工业有机固体废弃物的主要处理手段是焚烧法[7]。焚烧技术具有效率高、速度快和适应性强的优点,现代焚烧技术配有热能回收系统,可实现工业有机固体废弃物能源的综合利用。然而,焚烧技术也有明显的缺点,一是焚烧炉投资较大,二是焚烧过程中排烟造成的二次污染[8],必须配备复杂的烟尘净化系统,以减少空气污染。有时,为了确保焚烧彻底,需要额外增加燃料,从而导致能源消耗和运营成本的增加[7]。
本文开发了一种新的临氧裂解技术,用于处理工业有机固废[9-12]。在该体系中,利用负载金属氧化物的沸石催化剂可以将工业有机固体废弃物转化为环境友好的小分子,具有能耗低、工艺短、效率高、成本低等优点。例如,半固体状的釜残的去除效率达到99%[9,12]。此外,之前的研究都集中在处理效率上,但进一步研究工业有机固废的临氧裂解反应动力学是必要的。
本文选择Mn2O3和Hβ分子筛2种材料在临氧裂解反应中作为不同的催化功能单元,并以热塑性聚氨酯(TPU)为研究对象,利用分布活化能模型(DAEM)对TPU临氧裂解反应动力学进行分析,研究结果以期为反应器的设计和后续的分离工艺提供参考。
1 实验部分
1.1 试剂
Hβ分子筛:工业级,天津南化催化剂有限公司;硝酸锰:分析纯,上海沃凯生物技术有限公司;TPU:分析纯,拜耳聚氨酯(上海)有限公司。TPU是一种(AB)n型嵌段线性聚合物,A为高分子量(1 000~6 000)的聚酯或聚醚,B为含2~12个碳原子的直链二醇,AB链段间化学结构是二异氰酸酯(MDI)。
1.2 模型催化剂及反应样品的制备
将100 mL质量分数为50%的Mn(NO3)2·6H2O溶液进行蒸发干燥,然后在马弗炉中650 ℃煅烧3 h,得到了具有氧化性能的Mn2O3催化剂。将工业化的Hβ分子筛放置在马弗炉中,650 ℃煅烧3 h,得到Hβ催化剂。采用浸渍法,将金属氧化物负载到Hβ分子筛上,制得Mn2O3/Hβ催化剂,具体步骤:首先,按比例取质量分数为50%的Mn(NO3)2·6H2O溶液,加入适量去离子水稀释,在搅拌状态下加入Hβ分子筛,搅拌4 h。常温下超声至分散均匀,再搅拌12 h使其混合更加均匀。然后,在70 ℃的旋转蒸发仪上进行真空干燥,在100 ℃下干燥12 h。最后,在650 ℃的马弗炉中煅烧3 h,得到Mn2O3/Hβ催化剂。
将TPU和不同的模型催化剂(在100 ℃干燥12 h)以1∶1的质量比进行称量,然后机械混合,获得TPU和催化剂均匀混合的反应样品,分别命名为TPU+催化剂。TPU和石英砂也以1∶1的质量比混合作为对照样品。
1.3 临氧裂解实验
采用美国Mettler-Toledo-TGA/DSC 3+型热分析仪(TG),在O2流量为50 mL/min下进行常压热质量损失测试。将约20 mg TPU+催化剂样品在100 ℃下加热10 min,然后以5、10和15 ℃/min的恒定升温速率加热到650 ℃,记录TG数据。最后,将样品残渣降温至100 ℃并维持10 min,再分别以5、10和15 ℃/min的升温速率将样品残渣再次从100 ℃加热至650 ℃,记录催化剂的TG数据作为基线背景扣除。
1.4 动力学方法
活化能模型(DAEM)已经用于各种有机固体材料在惰性或氧化性气氛中热降解的复杂反应及动力学研究[13-19]。该模型假定在相同的转化率下,具有相同的与活化能(E)相对应的频率因子(k0),模型计算式见式(1)。
(1)
式中:W为总的质量损失量,WT是温度为T时的质量损失量,R为气体摩尔常数,β为升温速率。活化能的差异可以用连续分布函数f(E)表示,其归一化条件满足式(2)。

(2)
利用式(2)将式(1)化简为式(3)。
(3)
式中:Es表示对应温度下的活化能。常用的活化能分布函数f(E)是在平均活化能(E0)处以标准差(σ)为中心的高斯分布[20]。连续分布函数f(E)的解析式是通过将WT/W与E进行对比,再将WT/W与E的关系进行关联而获得,见式(4)。
(4)
对Arrhenius方程进行变换,可得到式(5)。
(5)
2 结果与讨论
2.1 TPU样品的不同反应阶段拟合
在TPU的临氧裂解过程中,采用高斯拟合峰模型(GFPM)对微分热分析(DTG)数据进行拟合[21],并将得到的数据与实验数据进行对比,在10 ℃/min升温速率下,不同样品的实验和拟合DTG曲线如图1所示。由图1可得:GFPM得到的结果与DTG曲线实验值高度吻合,相关系数(r2)和简化卡方值分别为0.901~0.974和0.000 30~0.019 80。说明拟合结果具有较高的可信度。综上所述,TPU临氧裂解阶段的变化规律符合高斯分布函数模型。

图1 10 ℃/min升温速率下不同样品的实验和拟合DTG曲线Fig.1 Experimental and fitting DTG curves of the different samples at the heating rate of 10 ℃/min
2.2 TPU临氧裂解的热质量损失分析
在不同的升温速率(5、10、15 ℃/min)下,TPU在Hβ、Mn2O3和Mn2O3/Hβ催化剂的作用下的热质量损失分析结果如图2所示。由图2可知:在同一催化剂作用下,随着升温速率的增大,TG曲线整体上向高温区偏移,这是由于升温速率增大导致了传热滞后。TPU在Hβ、Mn2O3和Mn2O3/Hβ催化剂的作用下均实现了100%的质量损失,说明升温速率对反应有着较小的影响。但是,在不同催化剂的作用下,TG曲线的变化趋势存在显著的差异,意味着TPU经历不同的反应过程。

图2 TPU在不同催化剂下的质量损失曲线Fig.2 Thermogravimetric curves of TPU using different catalysts
2.3 动力学分析
反应样品在O2氛围下以5、10、15 ℃/min的升温速率进行临氧裂解反应,采用DAEM进行了详细的分析,得到动力学三因子(指前因子、活化能和机制函数),建立表观活化能、机制函数、温度以及质量损失率之间的关系,揭示TPU的临氧裂解反应机制。
不同样品的与WT/W匹配的ln(β/T2)与1/T的阿伦尼乌斯拟合曲线如图3所示。通过计算等转化率下不同升温速率的ln(β/T2)和1/T的值,可以得到3个点,然后对其线性拟合,得到拟合直线的斜率和截距,再利用阿伦尼乌斯方程计算得到对应转化率的活化能[22]。由图3可知:拟合得到的直线,展现出较好地连续分布的形态,表明TPU及其在不同催化剂的作用下,活化能具有连续分布的特点。

图3 不同样品的与WT/W匹配的ln(β/T2)与1/T的阿伦尼乌斯拟合曲线(WT/W以0.05递增)Fig.3 Arrhenius plot of ln(β/T2) vs. 1/T at selected WT/W values of different samples (the values of WT/W increased by 0.05)
在O2氛围下,TPU以及在不同催化剂参与下的活化能与转化率(WT/W)的关系曲线见图4。由图4(a)可知:TPU的反应活化能为150~742 kJ/mol,整体呈现出M形的变化趋势。在转化率为0.1~0.35时,活化能缓慢下降,这可能是由于TPU临氧裂解过程中产生了自由基前驱体,促进了反应。转化率为0.4~0.75时,出现第一个显著的峰,这意味着TPU及中间产物发生热氧化反应难度逐渐增加,所需活化能增加;随着反应趋于平稳,活化能下降。转化率为0.75~1.0时,出现第二个显著的峰,其峰值为最高值,达到742 kJ/mol,此时积碳消除反应速率达到最大,随后反应逐渐趋缓,活化能也随之下降。由图4(b)可知:TPU+Hβ的反应活化能为133~225 kJ/mol,表现为先急速上升,然后维持在较高位置,再缓慢下降,紧接着加速下降。转化率为0.1~0.2时,由于Hβ催化剂的酸性位点催化TPU中由弱到强的化学键依次断裂,所需活化能增加。转化率为0.2~0.65时,活化能在较高位置小幅度波动,这是由于前期裂解的中间产物发生相对持续稳定的氧化反应。转化率为0.65~1.0时,活化能快速下降,这是由于产生的小分子物质在高温下更易于氧化,进而促进了反应。由图4(c)可知:TPU+Mn2O3的反应活化能在231~527 kJ/mol之间变化,整体呈现锯齿状变化趋势。转化率为0.1~0.65时,活化能呈波形振荡增加的趋势,表明TPU发生热解反应,并且由易到难,所需活化能逐渐增加。在转化率为0.65~0.8时,活化能降低,这是由于前段反应得到的中间产物在Mn2O3的催化氧化作用下,加速了反应。转化率为0.8~1.0时,出现峰值是由于在较高温度时进一步发生深度氧化,生成更稳定的产物如CO2和H2O,所需活化能较高。转化率为1.0时的活化能升高是由于发生少量的焦炭残渣消除反应。由图4(d)可知:TPU+Mn2O3/Hβ的临氧裂解活化能变化范围是57~588 kJ/mol,并呈现N形变化趋势。在转化率为0.1~0.6时,活化能从190 kJ/mol逐渐增加到565 kJ/mol,这是由于Hβ分子筛引起的端链和支链由弱到强的断裂所需活化能增加。在转化率为0.6~0.8时,活化能陡然下降,这是由于中间产物及小分子物质生成了自由基,加速了主链的断裂,TPU及其裂解产物在Mn2O3上发生氧化反应,降低了反应所需活化能。在转化率为0.8~1.0时,活化能的急速增加是由于少量的积碳发生了消除反应。在Mn2O3/Hβ的作用下,Mn2O3催化氧化功能单元和Hβ催化裂解功能单元在TPU临氧裂解反应中表现了良好的裂解氧化协同作用。

图4 活化能与转化率(WT/W)的关系曲线Fig.4 Relation curves of activation energy with conversion rate (WT/W)
图5为不同反应样品的归一化活化能分布曲线f(E)。研究活化能的归一化分布曲线f(E)与反应样品的平均活化能之间的关系,主要参数列于表1。由图5可知:所有反应样品的归一化活化能分布曲线f(E)均只有一个峰值,拟合曲线与试验点的趋势比较吻合,表明TPU和有催化剂参与的反应样品的临氧裂解过程的活化能机制函数满足归一化的趋势要求。由表1可知:在5、10和15 ℃/min升温速率下,相关系数r2均接近于1,卡方值为2.46×10-15~2.56×10-9,表明拟合得到的结果较为可靠。

图5 反应样品的归一化活化能分布曲线f(E)Fig.5 Normalized activation energy distribution curves f(E) of the reaction samples
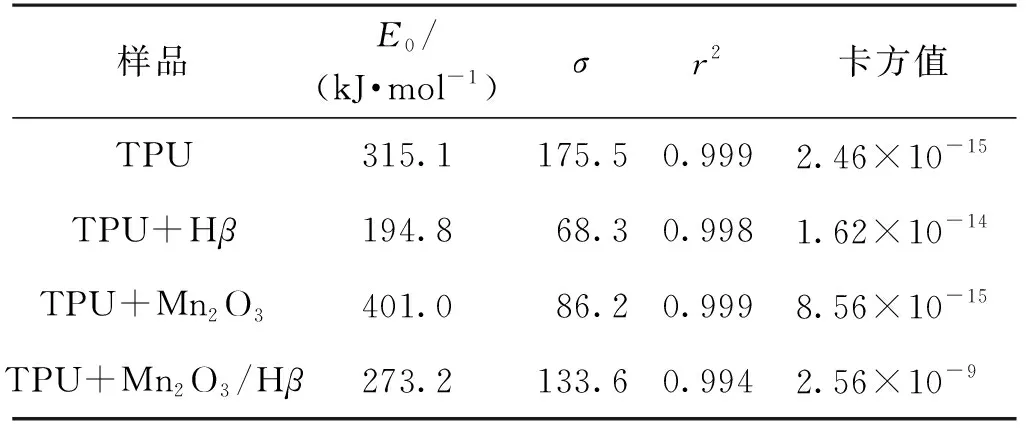
表1 高斯拟合得到的平均活化能和标准偏差
2.4 动力学预测
采用DAEM模型的简化方法对样品的热裂解曲线进行预测分析,结果列于图6。由图6可知:在不同升温速率下,ln(1/T2)和1/T显示出较强的相关性,用式(6)表示。
(6)
式中:m和n分别为1/T和ln(1/T2)所关联的比热率曲线的斜率和截距,相关数据如表2所示。由表2可知:在该试验中,r2的值比较接近1,表明拟合得到的结果较为可靠。
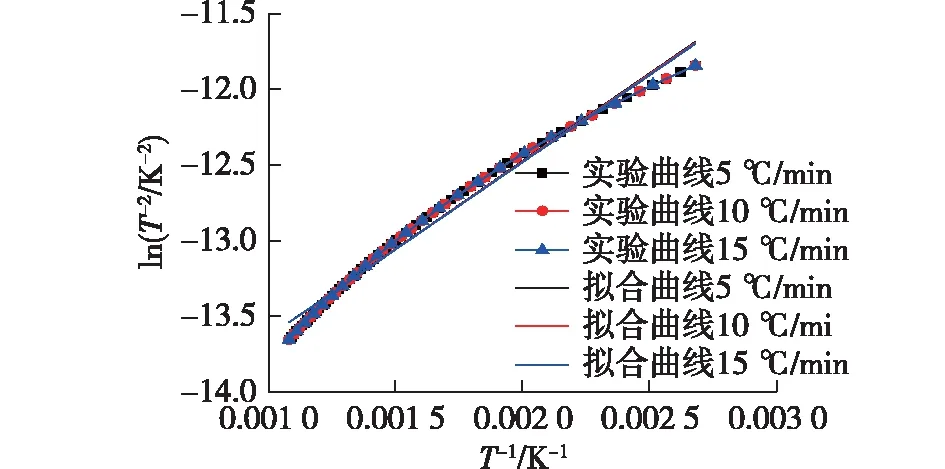
图6 ln(1/T2)与1/T曲线在不同升温速率下的线性拟合Fig.6 Linearization of ln(1/T2) vs. 1/T curves at different heating rates

表2 ln(1/T2)与1/T曲线在不同升温速率下的线性拟合参数
根据式(5)和(6),建立关于温度在转换过程中的表达式,见式(7)。
(7)
通过式(7)获得了在反应过程中转化率和温度的拟合关系,并将拟合值与实验值进行对比,结果如图7所示。由图7可知:DAEM模型在一定的升温速率下得到的动力学拟合数据与临氧裂解反应过程中得到的实验值有较好的拟合性。上述研究结果表明,简化的DAEM模型可以用来分析TPU临氧裂解反应的动力学。

图7 DAEM在10 ℃/min下的实验和预测反应曲线的比较Fig.7 Comparison of experimental and predicted devolatilization curves using DAEM at 10 ℃/min
3 结论
1)采用高斯拟合峰模型对TPU在临氧裂解过程中的不同反应阶段的DTG曲线进行拟合分析。使用GFPM得到的拟合结果与实验得到的DTG曲线高度吻合,TPU、TPU+Hβ、TPU+Mn2O3和TPU+Mn2O3/Hβ的降解反应活化能范围分别为150~742、133~225、231~527和57~588 kJ/mol。相关系数r2和卡方值范围分别为0.901~0.974和0.000 30~0.019 80。
2)采用分布活化能模型,对O2氛围下,TPU降解反应的非等温TGA数据进行详细的分析,采用DAEM模型的简化方法预测不同样品的降解曲线。得到的相关动力学参数的r2的值均接近1,表明参数值可靠,使用得到的动力学参数建立预测曲线与实验值较为匹配。
3)不同的模型催化剂对TPU临氧裂解反应的作用效果存在较大差别:Hβ催化剂在低温区促进了TPU的裂解反应;Mn2O3催化剂在中高温区促进了TPU氧化反应深度;在复合型模型催化剂Mn2O3/Hβ作用下,其反应活化能明显小于纯TPU反应样品的反应活化能。以上结果表明,Mn2O3/Hβ双功能复合催化剂表现出低温快速裂解,中高温深度氧化和降低反应活化能的作用,实现了良好的协同作用。

