地黄不同时期内生促生细菌的筛选及其促生特性分析
王春艳 腊贵晓 苏秀红 李萌 董诚明
(1 河南中医药大学,郑州 450046;2 呼吸疾病中医药防治省部共建协同创新中心,郑州 450000;3 河南省农业科学院经济作物研究所,郑州 450002)
植物内生细菌是指能够从表面消毒后的植物组织内分离得到或植物体内提取得到的,并且是对植物无实质性危害的一类细菌[1],是植物微生态系统中的重要组成部分。研究报道指出,植物内生细菌可以通过产生长素IAA、溶磷、产铁载体以及固氮等直接或间接地促进植物的生长。除此以外,内生细菌对宿主植物还具有生物防治,增强植物抗逆性,修复植物重金属污染等作用。由此说明,内生细菌与宿主植物之间的互作对植物的生长具有重要意义。地黄为玄参科植物地黄Rehmannia glutinosa 的新鲜或干燥块根,始载于《神农本草经》,因其药用历史悠久、临床疗效确切,已成为我国现代大中药产业链重点推荐研究利用的大宗药材之一[2]。随着需求量的增加,地黄种植面积也逐年增加,在其种植过程中,由于过度施用化肥和农药,造成了其种植地的土壤板结,肥力下降,微生态失衡,土地生产能力下降,进而影响了地黄药材的可持续发展。因此,克服过度使用化肥和农药带来的危害,建立一个绿色环保的中药材农业生态和环境技术体系是亟待解决的问题。在当前生态农业可持续发展形势下,开辟生物菌肥替代部分化肥日益受到重视。
目前地黄的研究主要集中在质量评价、药理作用、有效成分、炮制、配伍、栽培等方面[3-6],关于地黄内生菌的研究主要集中在内生细菌和内生真菌的抗病原菌上,而关于地黄内生促生细菌研究鲜为少见,赵龙飞等[7]只在块根组织中分离了内生细菌,并作了促生潜能分析,未对不同时期地黄根、茎、叶进行内生促生细菌分离。本研究采用纯培养法分离了地黄苗期、盘棵期、膨大前期、膨大中期、膨大后期和成熟采收期等健康植株的内生细菌,并采用形态学、生理生化和16S rRNA相结合的方法进行了鉴定分析,通过检测产IAA、铁载体活性,溶磷,固氮能力实验,筛选出具有潜在促生能力的内生细菌,以期为研究地黄专用微生物促生菌肥提供参考,并为后续微生物促生菌肥应用到地黄大田实验中奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试材料 材料于2020年5月上旬-11月上旬采自河南省焦作市武陟县不同时期(苗期、盘棵期、膨大前、中、后期和成熟采收期)地黄健康植株,采集样品后立即放入保鲜袋中,带回实验室立即进行内生细菌的分离。
1.1.2 主要仪器与试剂 MP-250B型培养箱;ISRDV3型恒温振荡器;LDZX-50KMS型立式压力蒸汽灭菌器;FA2204N型电子天平;SW-CJ-1C型超净工作台;XS-A4-SUNNY型生物显微镜;5810R型高速冷冻离心机;A5系列双光束紫外可见分光光度计;DDSJ-308A型酸度计;JS-680D型全自动凝胶成像分析仪。
氯化钠,硫酸钠,氯化钾,乙醇(分析纯,天津市致远化学试剂有限公司);磷酸二氢钾,氢氧化钠(分析纯,天津市恒兴化学试剂制造有限公司);次氯酸钠(分析纯,郑州派尼化学试剂厂);Salkowski显色剂;钼锑钪显色剂;CAS检测液;10 mol/L的磷酸盐缓冲液(pH 6.8);0.5%溴百里酚蓝溶液;三丁酸甘油酯乳化液。
1.1.3 供试培养基 LB培养基;IAA培养基[8];PKO(固 /液体)培养基[9];CAS检测培养基、MKB液体培养基[10];固氮培养基(Nfb培养基)。
1.2 方法
1.2.1 地黄内生细菌的分离 分别选取各个时期的地黄植株的新鲜块根、茎和叶用流水将其表面的泥土冲洗干净后,肥皂水浸泡30 min,之后用流水冲洗1-2 h,然后用70%酒精分别消毒块根(10 min)、茎(8 min)和叶(6 min),无菌水冲洗6次,再用0.1%的HgCl2消毒20 s,无菌水冲洗6次。然后将各组织置于灭菌滤纸皿中,吸干其表面的水分,备用。吸取200 μL最后一次的洗涤水涂布到LB固体平板上作为空白对照,重复3次,置于30℃恒温箱中培养10 d,期间观察平板上的变化,如无菌落产生,则表明消毒彻底。分别称取1 g表面消毒彻底的块根、茎和叶,置于无菌研钵中,加入9 mL的无菌蒸馏水进行研磨,将其研磨成匀浆状态,再分别吸取1 mL研磨好的匀浆,并按照10-1-10-5浓度梯度进行稀释后,分别取200 μL稀释液均匀涂布到LB培养基中,各处理重复3 次,30℃下倒置恒温培养箱中培养1-3 d。待细菌菌落长出后,参考《伯杰细菌手册》[11]和《常见细菌系统鉴定手册》[12]将不同形态、颜色等特征的单菌落反复连续划线培养,直到获得形态完全一致的单菌落,对形态特征完全一致的菌落进行革兰氏染色,并置于显微镜下观察其镜检形态,如果镜检形态特征也一样,则将菌株合并为一组,将纯化后单菌落保存于斜面培养基上,并用50.0%甘油进行封存,置于-20℃的冰箱中冷冻保存,备用。
1.2.2 菌株生理生化检测及16S rRNA分子鉴定 根据《常见细菌系统鉴定手册》[12]对待测菌株进行常规的生理生化检测,包括甲基红(MR)、V-P、柠檬酸盐、葡萄糖发酵、乳糖发酵、H2S、明胶液化、接触酶、氧化酶、淀粉酶等试验。
参照李朝辉[13]的方法对其进行DNA的提取与PCR扩增。PCR 产物纯化后送生工生物工程(上海)股份有限公司测序。将所获得的16S rRNA 基因序列提交到NCBI数据库中,与核苷酸数据库中16S rRNA基因序列进行相似性比对[14]。结合形态及生理生化鉴定结果,初步判定菌株所属类群,确定地黄内生细菌种属地位。
1.2.3 产IAA内生细菌的筛选 菌株产IAA量采用Salkowski 比色法测定,参考Patten[8]的方法,将内生细菌接种到含有L-色氨酸(浓度0.2 g/L)的LB液体培养基中,130 r/min、30℃培养48 h后,取一定量的菌液,以10 000 r/min离心5 min后,取1 mL上清液与2 mL Salkowski,S显色剂充分混匀,以1 mL未接菌的LB液体培养基与2 mL的S显色剂混合均匀作为空白对照,每个处理3次重复,避光静置30 min后,观察混合液的颜色变化。若混合液的颜色变成粉色,表明该菌株具有产IAA的能力。制备 浓 度 为 0、2.5、5.0、7.5、10、12.5、15、17.5、20 mg/L的IAA标准溶液,绘制IAA标准曲线,根据标准曲线,计算菌株IAA产量。
1.2.4 溶磷内生细菌的筛选 用溶磷圈法检测待测内生细菌溶磷能力,每个菌株3次重复,进行溶磷能力初筛。将初筛后具有溶磷能力的内生细菌以钼锑抗比色法测定菌液的有效磷含量,培养液以130 r/min、30℃培养24 h,以10 000 r/min离心5 min,具体操作参考唐玉娟等[9]。
1.2.5 产铁载体内生细菌的筛选 参考Schwyn等[10]的方法检测内生细菌产铁载体能力。将待测菌株等距离点接种于CAS检测培养基上,每个菌株重复3次,于30℃培养3 d后,观察菌落附近是否产生橘黄色的晕圈以此判断内生细菌是否具有产铁载体的能力。将具有产铁载体能力的菌株用CAS比色法测定,具体操作参考王欢等[15]。
1.2.6 具备固氮能力内生细菌的筛选 按照Andrade等[16]等人的方法对内生细菌进行固氮能力的筛选。将已活化的内生细菌接种于Nfb半固体培养基中,30℃恒温培养5 d后,观察培养基中是否有菌膜的出现,如果有菌膜的出现,则说明该菌种具有固氮的能力,否则,说明该菌种没有固氮能力。对具固氮潜力的内生细菌进行固氮酶基因nifH的扩增:(1)按照1.2.2方法进行内生细菌DNA的提取。(2)用引物 nifH-F(5′-AAAGGYGGWATCGGYAART CCACCAC-3′)和 nifH-R(5′-TTGTTSGCSGCRTACAT SGCCATCAT-3′)[17]对提取的 DNA 进行 PCR 扩增。(3)50 μL PCR 反 应 体 系 :25 mmol/L MgCl25 μL,10×Buffer 5 μL,5 mmol/L dNTPs 1 μL,10 μmol/L nifH-F 1 μL,10 μmol/L nifH-R 1 μL,5 U/μL Taq DNA Polymerse 0.25 μL,DNA 模板 1 μL,补 ddH2O 至 50 μL。(4)PCR 扩增程序[18]:94℃预变性 5 min,30个循环,包括94℃变性30 s,60℃退火30 s,72℃延伸1 min,最后72℃延伸10 min。若PCR产物经电泳检测,出现特异性条带(约460 bp),则说明该菌种含固氮酶基因nifH。
1.2.7 数据处理 使用 SPSS 16.0 软件对试验数据进行统计分析,采用方差分析(ANOVA)和 Tukey 检验进行方差分析和多重比较(α=0.05),使用 Origin 8.1软件进行数据处理及作图。图表中数据为平均值±标准差。
2 结果
2.1 内生细菌的分离
从地黄6个不同时期的块根、茎和叶中共分离到512株内生细菌。其中由苗期分离出45株,盘棵期分离到67株,膨大前期分离出70株,膨大中期分离到95株,膨大后期分到104株,成熟采收期分到131株,共计512株。
根据平板上菌落的形态,颜色、菌落透明度、表面是否光滑、是否凸起及菌落边缘情况等形态特征,并根据光学显微镜下内生细菌的镜检结果,同时参考生理生化特征检测结果对分离出的菌株进行同类合并,最终将其初步鉴定分为54组,并从每一组中选取一株内生细菌,并进行编号为ER1-ER54,进行16S rRNA分子鉴定,结果见表1。
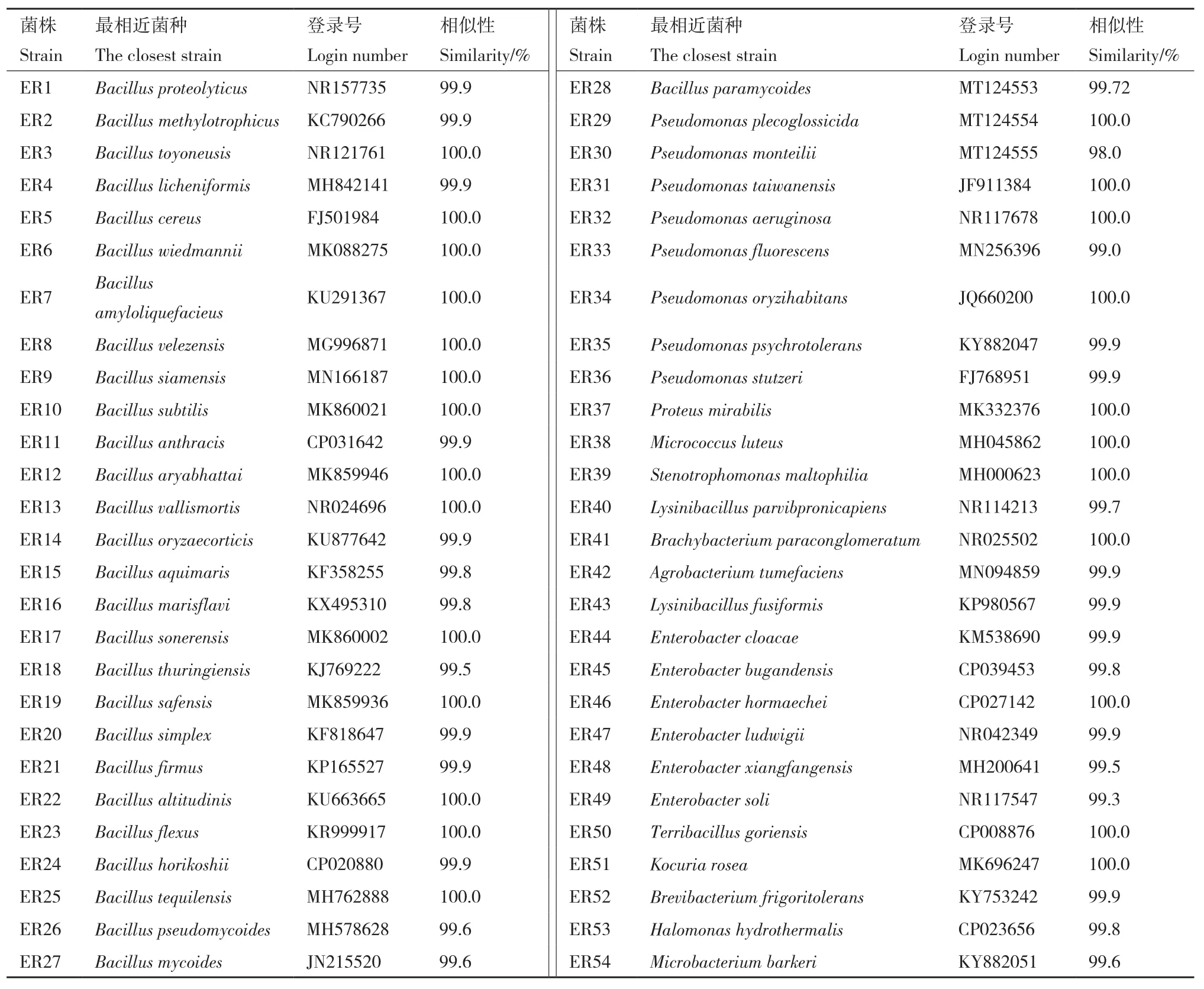
表1 地黄内生细菌16S rRNA鉴定Table 1 Identification of endophytic bacteria in R.glutinosa via16S rRNA
2.2 产IAA能力的测定
IAA显色发现,54株内生细菌中有41株(75.9%)在L-色氨酸存在的条件下,与Salkowski,S显色剂反应后颜色均显示为粉色。但各个菌株之间呈现的颜色深浅不一,反映菌株合成IAA能力强弱的不同。如 E.soli ER49,E.cloacae ER44、E.bugandensis ER45、E.xiangfangensis ER48,4个菌株显色反应为粉红色,颜色表现较深,说明合成IAA的能力较强。有11个菌株颜色表现次之,为粉色,表明其合成IAA的能力中等;其余26个菌株颜色为浅粉色,表明合成IAA的能力相对其他菌株较弱;剩余的13个菌株没有颜色变化,说明这些内生细菌不具备合成IAA的能力。
根据IAA标准溶液的浓度与对应的OD530,绘制成IAA标准曲线为:y=0.033 2x+0.008 9,其R2值为0.999 3。将上述初筛产IAA的内生细菌进一步地进行产IAA含量的测定,结果(表2)显示,41株内生细菌均能检测到产IAA,产量在2.15 mg/L-27.35 mg/L之间,且各菌株产IAA的能力具有显著性差异。其中,菌株E.soli ER49 产IAA的量最高,为27.35 mg/L;其次是菌株E.cloacae ER44和E.bugandensis ER45,产量分别为27.29 mg/L和25.93 mg/L;产IAA量最低的菌株是B.siamensis ER9,只有2.15 mg/L。

表2 内生细菌IAA分泌量Table 2 IAA secretion from endophytic bacteria
2.3 溶磷能力的测定
内生细菌溶磷初筛结果发现,54株内生细菌有29株(53.7%)内生细菌产生了溶磷圈(图1,表3),其中有12株内生细菌属于芽孢杆菌属,占溶磷菌株的41.4%。由表3可知,各个菌株D/d值的大小在1.13-2.44之间。29株内生细菌有6种的D/d值在2.0-2.5之间,表明溶磷能力强;11株的D/d值在1.5-2.0之间,表明溶磷能力中等;12株的D/d值在1.0-1.5之间,表明溶磷能力弱。最大的D/d比值出现在菌株K.rosea ER51,其次是菌株P.psychrotolerans ER35和B.siamensis ER9,D/d值分别为2.31和2.17;最小的D/d比值(1.13)出现在菌株Proteus mirabilis ER37。

图1 不同菌株溶磷圈的大小Fig.1 Size of phosphorus dissolving circle of different strains
根据OD700与磷标准溶液浓度绘制有效磷标准曲线,确定了有效磷浓度标准曲线计算公式:y=0.359 3x+0.005 6。其中R2为0.999 2。溶磷量结果如表3所示,54株内生细菌有29株(53.7%)均被检测到溶磷,溶磷量在6.32 mg/L-133.65 mg/L之间,且菌株之间溶磷量具有显著差异。其中溶磷量最大的菌株为P.aeruginosa ER32,为133.65 mg/L;其次是菌株B.siamensis ER9,K.rosea ER51和B.aquimaris ER15,溶磷量分别为120.52 mg/L、112.91 mg/L和103.27 mg/L;最小溶磷量的菌株是Terribacillus goriensis ER50,为 6.32 mg/L。

表3 内生细菌溶磷能力测定Table 3 Determinationof phosphorus dissolving capacity of endophytic bacteria(D/d)
2.4 产铁载体能力的测定
54株内生细菌有28株(51.9%)内生细菌菌落周围出现了橘黄色的晕圈,说明这些内生细菌具有产铁载体的能力。主要为Bacillus、Pseudomonas、Brachybacterium、Lysinibacillus、Enterobacter、Brevibacterium和Halomonas等7个属,其中Bacillus属于优势菌属,占产铁载体菌株的53.6%。部分内生细菌产铁载体平板检测如图2所示。

图2 不同菌株产铁载体活性比较Fig.2 Comparison of the activities of different strains producing iron carrier
初筛得到的产铁载体内生细菌进行产铁载体定量测定,结果(表4)显示,A/Ar(接菌吸光度值/未接菌吸光度值)比值在0.14-0.79之间,各菌株产铁载体量存在显著性差异。其中,菌株B.subtilis ER10,L.fusiformis ER43、E.bugandensis ER45和 B.amyloliquefacieus ER7,4个菌株的A/Ar值分别为0.14、0.16、0.17和0.20,说明这4个菌株产铁载体的能力最强;有9个菌株A/Ar比值次之,范围在0.28-0.39之间,说明这9个菌株产铁载体的能力较强。

表4 内生细菌产铁载体的能力Table 4 Abilities of producing iron carrier by endophytic bacteria
2.5 固氮能力内生细菌的筛选
内生细菌在半固体Nfb培养基中若能产生固氮菌膜,则说明其具备固氮能力。表5结果显示,54株内生细菌有25株(46.3%)能够在半固体Nfb培养基中产生固氮菌膜。具有固氮能力的内生细菌分布于不同的菌属,主要包括Bacillus、Pseudomonas、Lysinibacillus、Brachybacterium、Enterobacter、Terribacillus、Kocuria、Halomonas和 Microbacterium等9个属。固氮内生细菌中,Bacillus占44.0%,其次为Pseudomonas,占20.0%。
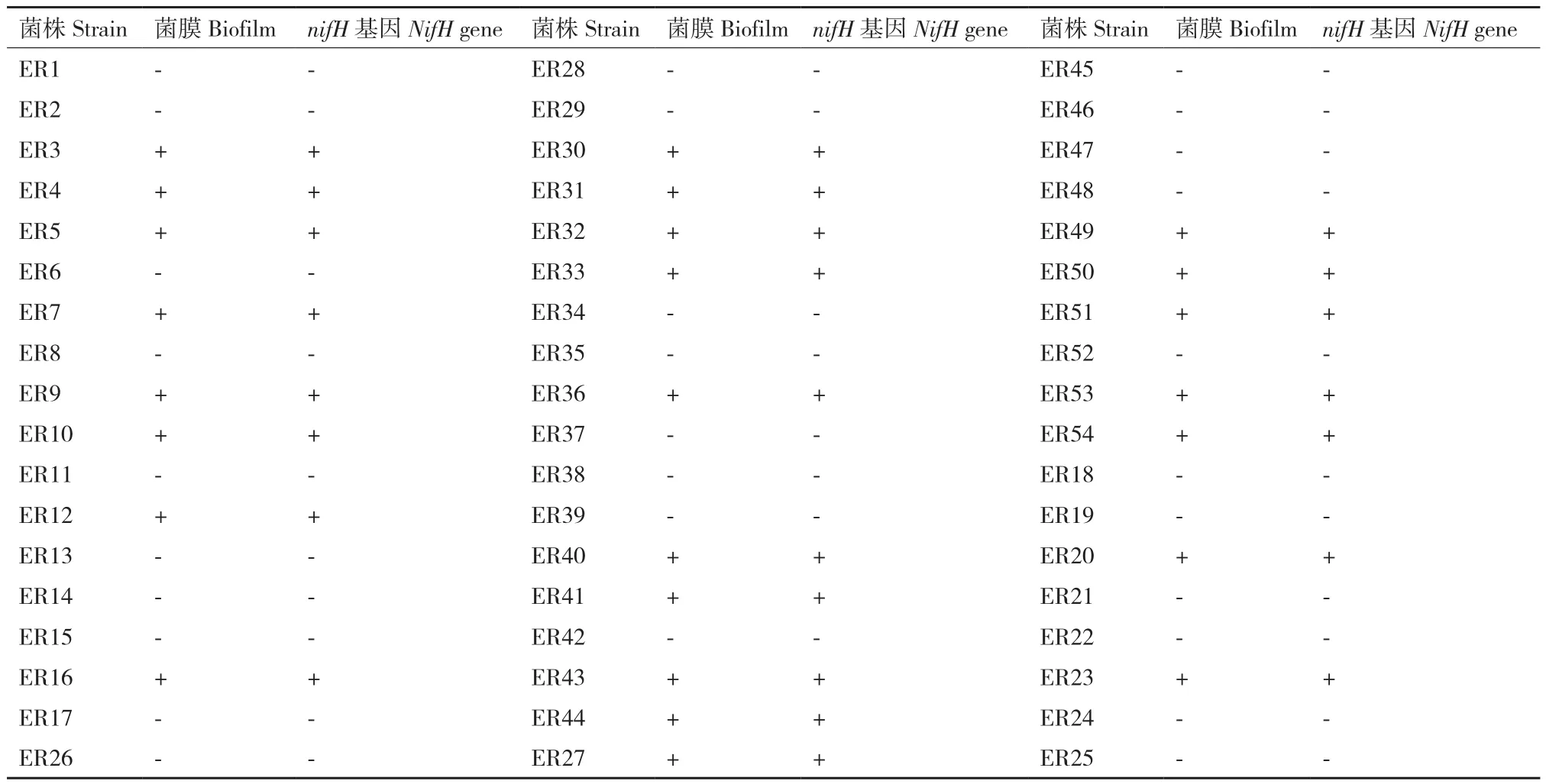
表5 内生细菌固氮能力的筛选Table 5 Screening the nitrogen fixation abilities of endophytic bacteria
利用固氮菌特异性引物对这25株内生细菌进行nifH基因的扩增,结果显示,均能够扩增出约460 bp的目的条带(图3),由此说明这些具固氮潜力的内生细菌均含有固氮酶基因nifH基因。

图3 内生细菌nifH基因的扩增Fig.3 Amplification of nifH gene in endophytic bacteria
3 讨论
内生细菌是蕴藏在植物体内的一类重要微生物资源,对植物的生长发育具有重要的调控作用[19]。本研究从地黄中分离出 512 株内生细菌,并选出形态最有辨识特征的54株进行鉴别,并归为14个属54个种,主要分布于芽孢杆菌属、假单胞菌属、大肠埃希菌属。其中芽孢杆菌属占分离总数的62.5%,为地黄优势菌属,除了芽孢杆菌属和假单胞菌属,其他菌属均是首次从地黄中分离得到。分离出的菌株数量和种类远高于前人的研究,如杨清香等[20]共从怀地黄中分离出67株内生细菌;王瑞飞等[21]分离出30株内生细菌。芽孢杆菌属作为多种植物的优势菌属已被报道[22-24]。研究表明,芽孢杆菌属可将土壤中难溶性的磷转化为可溶性的磷[25],也可通过产IAA促进植物的生长[26],是研制微生物菌肥的重要类群;不仅如此,该属还可作为生防细菌,有效防止植物炭疽病[27]。除芽孢杆菌属外,本研究分离的假单胞菌属、肠杆菌属的种类(8种和6种)仅次于芽孢杆菌属;这两个菌属已被用于合成功能活性物质、筛选医用抗生素、防治农业病虫害等领域[28-30]。因此,本研究进一步对分离的内生细菌进行了功能筛选。
植物内生细菌可通过产生植物激素来促进植物的生长发育,其中最为活跃的为IAA。目前已经从植物中分离鉴定出多种能够产IAA的菌属,其中最为常见的为芽孢杆菌属、假单胞菌属、肠杆菌属、微杆菌属等,且均为高产主体菌[31-32]。本研究的结果同于前人的研究,在本研究中,54种内生细菌中,高产IAA菌株排名前3的均为肠杆菌属,且不同种类的内生细菌产IAA的能力具有显著性差异,原因可能与内生细菌自身的结构有关,后续会进一步探索。
由于在土壤中铁的可溶性含量较低,难以被植物直接吸收利用,因此铁元素已成为限制植物生长发育的关键因素之一。内生细菌产生的铁载体可作为铁和其他矿物或有机化合物中其他金属的增溶剂,以增加植物和微生物对铁的利用[33]。本研究发现菌株ER10 B.subtilis、ER43 L.fusiformis、ER45 E.bugandensis和ER7 B.amyloliquefacieus等4个菌株产铁载体能力最强,说明芽孢杆菌属、赖氨酸芽孢杆菌属和肠杆菌属为地黄高产铁载体内生菌属。孙磊等[34]对春兰根部189株内生细菌产铁载体检测发现,只有24.9%的内生细菌可产铁载体,这一结果小于本研究从地黄中筛选出的产铁载体的内生细菌(51.6%)。这可能与宿主植物的种类,内生细菌的生存环境以及其应对低铁环境的能力有关。
本研究结果中有25株内生细菌具有固氮功能的潜力,且已有文献证明Bacillus licheniformis ER4[35]、Bacillus cereus ER5[36]、Bacillus amyloliquefacieus ER7[37]、Bacillus subtilis ER10[38]、Bacillus aryabhattai ER12[39]、Bacillus marisflavi ER16[40]、Bacillus flexus ER23[41]、Pseudomonas fluorescens[42]、Enterobacter cloacae ER44[43]、Pseudomonas monteilii ER30[44]等均具有固氮的作用,与本实验结果一致。
综上所述,地黄不同生长发育时期存在丰富多样性的内生细菌,对于揭示内生细菌维持地黄微生态环境的动态平衡提供帮助,同时可为后续内生细菌促生特性的研究提供丰富的内生细菌资源,进而为进一步挖掘内生细菌与植物之间的互作关系奠定基础。
4 结论
从地黄不同时期根、茎、叶中分离出512株内生细菌,其中41株具有产IAA的能力,29株具有溶磷能力,28株具有产铁载体能力,25株具有固氮能力。

