马铃薯块茎形成的生理生化基础和分子机制
雷春霞 李灿辉 陈永坤,3 龚明
(1.云南师范大学生命科学学院 生物能源持续开发利用教育部工程研究中心 云南省生物质能与环境生物技术重点实验室,昆明 650500;2.云南师范大学马铃薯科学研究院 云南省马铃薯生物学重点实验室,昆明 650500;3.新疆师范大学生命科学学院,乌鲁木齐 830054)
马铃薯(Solanum tuberosum L.)是继小麦、水稻之后,全球第三大粮食作物,粮菜兼用,营养丰富,根据单位种植面积产生的供人体消耗的卡路里,它是世界上最高效的粮食作物[1-3]。马铃薯在中国的种植面积和总产量均位居世界第一,但单位面积产量仅为发达国家的1/3左右[2]。为保障国家粮食安全、促进农民持续增收,2015年初,我国启动马铃薯主粮化战略[4]。马铃薯块茎形成过程是马铃薯植株最重要的生长发育和产量决定事件之一,对其进行深入研究有利于改进和提高马铃薯块茎的产量和质量。
马铃薯起源于气候相对凉爽的南美安第斯山脉,块茎是由地下匍匐茎膨大形成的淀粉储存器官,其形成受内部因素与环境条件互做的调控。在马铃薯生长的各发育阶段,结薯期是受外界环境影响最敏感的阶段,不同地区的气候差异限制其种植区域和实际产量[5]。本文概述了马铃薯块茎形成的生理生化基础,讨论了块茎诱导形成过程中信号转导途径及相关基因、蛋白、miRNAs、激素和第二信使分子等对块茎形成的调节,构建了块茎诱导形成过程中可能的分子互作网络,展望了未来研究的方向和可能的突破点。随着各类生物技术的成熟与应用,通过分子遗传改良提高马铃薯产量成为一种发展趋势[5-7];而阐明块茎形成的分子机制,可为将来通过精准分子育种提高马铃薯产量和改良品质提供理论基础。
1 马铃薯块茎形成的生理生化基础
马铃薯植株生长发育到一定时期形成匍匐茎,在特定的诱导条件下,匍匐茎进一步膨大形成块茎,该过程涉及一系列的生理生化变化,如内源激素成分、含量及其比值发生明显的变化,植株叶片光合速率提高、同化物外运速度加快、匍匐茎顶端的蔗糖和淀粉含量增加以及特异蛋白的出现等[8]。早先的C/N 假说认为,马铃薯植株中C∶N比率的变化与块茎形成密切相关,在短日照(SDs)条件下,碳水化合物在匍匐茎亚顶端积累引起C∶N 比率增加,从而诱导块茎形成[9]。Zheng等[10]的研究也表明,随着CO2浓度的增加,马铃薯植株C∶N比率增大,块茎形成时间提早,施氮量的减少也会导致C∶N比率的升高和块茎形成时间的提前[10]。
1.1 马铃薯块茎形成的过程
马铃薯块茎的形成是一个复杂的发育过程,包括几个连续的阶段:匍匐茎的发生和伸长、随后顶端弯曲成钩状,亚顶端区域膨大形成块茎(图1)。在匍匐茎生长过程中,细胞分裂主要局限于顶芽和接近顶端垂直于匍匐茎生长轴方向的区域。块茎形成启动后,匍匐茎停止生长,匍匐茎亚顶端区域髓区、环髓区和皮层细胞的数量增多与体积增大引起块茎膨大,这一过程中伴随着淀粉合成和一组特定的贮藏蛋白质的积累[1,11-12]。匍匐茎的伸长和块茎的膨大是连续的、密切相关的两个独立的发育阶段,受外界环境和内源激素的共同调控[1,5,13]。然而,并非所有的匍匐茎都能产生块茎。受遗传基因、外界环境及栽培条件的影响,一般来说,匍匐茎的成薯率为50%-70%[14]。在某些情况如在离体培养或在黑暗中,块茎也可以从地上茎的芽或先前发育的块茎中产生。因此,匍匐茎的形成和生长并不一定是块茎形成的必经阶段。

图1 离体培养条件下马铃薯块茎形成过程图示Fig.1 Illustration of S.tuberosum tuberization in vitro
1.2 影响马铃薯块茎形成的内部因素
1.2.1 基因型和生理年龄 马铃薯块茎形成主要由其遗传特性调控,同样的外部环境,不同品种的马铃薯结薯能力不同[15]。另外,马铃薯植株发育阶段也是决定块茎形成的重要因素,植株必须达到一定的生理年龄才能对诱导块茎形成的环境因素作出响应。块茎形成过程需要生化代谢途径和形态发生过程的精确同步,其受特定基因表达的调控,同时负责诱导块茎形成的信号分子(如各种信号蛋白、mRNAs、miRNAs、植物激素和糖)的产生伴随着块茎的诱导与形成[16]。
1.2.2 植物激素 马铃薯块茎形成受到多种植物激素的共同调控,各种激素对块茎形成的功能不一。大量研究表明赤霉素(gibberellins,GAs)是植物激素中调控马铃薯块茎形成的主要负调控因子[17]。抑制结薯发生的主要生物活性GAs是GA1和GA3,它们在匍匐茎生长过程中含量高,在块茎形成前迅速下降[16,18]。GAs在块茎形成中作用的另一个证据是,施用GAs生物合成抑制剂(如氯胆碱、多效唑或嘧啶醇)可以促进块茎的形成[16]。
与GAs不同,细胞分裂素(CKs)能促进马铃薯的块茎形成[19]。离体培养条件下,CKs可通过促进细胞分裂来促进块茎形成[20-21]。此外,在块茎形成之前,匍匐茎中的生长素(IAA)水平升高,在随后的块茎生长期间仍保持较高水平,表明生长素在块茎形成中的促进作用[22]。而脱落酸(ABA)可能是通过降低GA的活性来促进块茎形成[23]。在块茎形成起始阶段,ABA/GA比值迅速上升,块茎膨大期间,ABA含量上升,GA含量下降;但二者的绝对浓度变化并不是影响块茎形成的关键因素,重要的是GA/ABA比值起决定作用[24]。因此,ABA与GA相互作用来参与块茎形成调控。
乙烯也参与了匍匐茎生长的调节。乙烯及其前体乙烯利对匍匐茎伸长具有抑制作用,而对顶端膨大具有促进作用[25]。此外,施用茉莉酸(JA)可增加分生组织的厚度,匍匐茎弯曲部位和初膨大匍匐茎的细胞面积分别增大达4倍和6倍,使亚顶端区域分生组织膨大形成块茎[26]。JA还对块茎干物质和淀粉的积累有促进作用,而CKs在块茎形成中对JA 具有拮抗作用[27]。
总体而言,植物激素是马铃薯块茎形成的关键因子,不同激素对块茎形成的影响存在互作效应,对这种互作效应的分子解析将有助于更好地理解植物激素对块茎形成调控的分子机制。
1.2.3 淀粉和蛋白质 马铃薯块茎的诱导与形成涉及一系列生理生化变化,如植株光合速率增加,同化产物的运输加快,干物质快速积累,形成块茎的匍匐茎顶端蔗糖、淀粉及块茎特异蛋白含量增加。
块茎形成伴随着匍匐茎顶端淀粉合成的急剧增加和ADP-葡萄糖焦磷酸化酶(AGPase)含量和活性的同时升高;AGPase是淀粉合成的关键酶,因此,淀粉曾一度被认为是块茎诱导形成所必需的[28]。在反义AGPase基因植株中,淀粉合成受阻,合成量仅为正常植株的2%,但块茎形成数量并未降低,甚至还高于正常植株。因此,淀粉合成对块茎诱导形成没有直接影响,但淀粉的积累会最终影响块茎产量[29-31]。Andersson等[32]的研究表明,通过 RNAi下调马铃薯质体水溶性无机焦磷酸酶(psPPase)基因,块茎总淀粉和直链淀粉含量显著降低,淀粉颗粒减小,糖中间体的数量发生了变化,ADP-葡萄糖含量显著增加。单个下调StpsPPase基因或ATP/ADP转运体基因StNTT均可提高单株块茎数量和鲜重;相反,当这两个基因同时被抑制时,一些株系只发育出少数形状扭曲的小块茎,表明PPase水解PPi对马铃薯块茎中功能淀粉的积累至关重要[32]。这暗示着未来可望通过改变淀粉合成相关基因的表达或敲除来提高块茎产量。
块茎形成的过程还伴随着一些贮藏蛋白的动态变化。块茎贮藏蛋白Patatin仅在马铃薯块茎形成过程中才在匍匐茎顶端特异性的出现和累积,其含量占块茎总可溶性蛋白含量的 40% 左右,被认为是块茎形成的生化标志;蛋白酶抑制剂Ⅱ(protease inhibitor Ⅱ,Pin Ⅱ)是在块茎发生后才开始出现和逐渐积累的。Patatin和 Pin Ⅱ只存在于块茎中,其含量大约占块茎总可溶性蛋白含量的 60%以上[33],其作用尚待进一步深入研究。
1.3 影响马铃薯块茎形成的外界因素
各种环境因子中,温度和光照是影响马铃薯块茎形成最重要的因素,水分和矿质营养对块茎形成也有一定影响。
1.3.1 温度 块茎的诱导和形成、数量、大小和产量都受到温度的影响[34]。块茎发生的最低温度是4-5℃,但生长迟缓;最适温度为15.6-18.3℃;高于2l℃,块茎的生长速度减慢[35]。在块茎形成期间,夜间温度的影响尤为关键,当夜晚的温度增加至25-27℃时,块茎的数量和重量均大幅度减少。因此,低温可以使马铃薯结薯提早,高温则会延迟甚至是完全抑制块茎形成[36-37]。
1.3.2 光照 光周期在诱导马铃薯块茎形成的启动过程中起着重要的作用。SDs有利于结薯,长日照(LDs)抑制或延迟块茎形成[38]。不同基因型对光周期反应不一,如野生种S.tuberosum ssp.andigena的块茎形成受光周期严格控制,而有些广泛种植的栽培品种尽管对光周期不敏感,但减少日照时间和降低温度仍然可以促进其块茎形成[39]。
光照强度也影响块茎形成。低光照强度通过降低光合速率,导致蔗糖合成水平和浓度降低,进而延迟结薯。此外,低光强对块茎形成的影响类似于高温,较高光照水平可以缓解高温对块茎形成的抑制作用。低光照强度能增加马铃薯叶片中的GAs水平,因此推测温度和光照强度都可通过调控GAs代谢来介导块茎形成[37]。
1.3.3 水分与矿质营养 马铃薯植株的蒸腾系数在400-600之间,属于需水较多作物,充足的水分供给对于块茎的形成至关重要。块茎诱导形成阶段需水量约占整个生育期的23%-28%以上,块茎逐渐膨大的过程占45%-50%以上,水分供应不足会延迟甚至抑制块茎形成,水分供应过多则会导致块茎品质下降[40]。
土壤营养状况也会影响马铃薯的块茎形成。氮素营养对块茎形成有显著影响,氮素形态、浓度及其施用时间与块茎形成时间和最终产量密切相关[9,41]。合理的氮、磷、钾肥施用和最佳配比配施有机肥能够提高马铃薯的产量和营养品质,适当的施用钙肥可以增加块茎数量和提高产量[42-44]。
2 马铃薯块茎诱导形成过程中的信号转导途径
马铃薯块茎形成过程中受到多种内部因素和外界环境的诱导,引发多条信号转导途径,这些途径又有上下游关系和相互作用。
2.1 光周期信号途径
光周期在马铃薯块茎诱导形成中起重要作用。马铃薯植株通过叶片感知光周期,叶片中的光受体(photoreceptor)感知光信号后,将光信号传递给昼夜节律钟(circadian clock)和节律调节基因(circadian regulated genes),并由它们将信号向下游传递[45]。
2.1.1 光周期信号的感知 马铃薯中与光周期诱导块茎形成有关的重要光受体是光敏色素A(StPHYA)、光敏色素B(StPHYB)和光敏色素F(StPHYF)[45-46]。StPHYA能够在远红外光条件下感知光信号,参与马铃薯生物节律的重建并调控块茎形成。StPHYB能够在绿色叶片中稳定积累,作为长距离运输的信号分子,在红光条件下参与光周期变化的感知,StPHYF与StPHYB以异源二聚体的形式介导马铃薯块茎形成的潜在光周期调控模式,LDs条件下抑制块茎形成[45-46]。马铃薯中的另一个蓝光受体蛋白FLAVINBINDING KELCH REPEAT F-BOX PROTEIN 1(FKF1)与昼夜节律钟的重要核心调控蛋白GIGANTEA(GI)形成复合物(StFKF1/StGI),感知蓝光来测量日长[47]。
2.1.2 光周期信号的传递及对块茎形成的调控
2.1.2.1 CONSTANS(CO)与 CYCLING DOF FACTOR 1(CDF1) 转录因子CONSTANS(CO)是调控开花和块茎形成的重要基因,昼夜节律钟对该基因的表达具有严格的调控作用[45]。在马铃薯中CO有两种形式(StCO1 和 StCO2),StCO1/2又称 StCOL1/2,对块茎形成起负调控作用[48],在马铃薯中过表达StCO延迟块茎形成,StCO对块茎形成的负调控作用可以通过嫁接传递[49]。DOF(DNA-binding with one finger)基因家族是植物专有的一类转录因子,参与调控植物生长发育过程中多种基因的表达。CYCLING DOF FACTOR 1(CDF1)蛋白属于DOF转录因子家族,马铃薯中的CDF1(StCDF1)是生物钟组件StGI1和StFKF1的下游作用因子,与 StGI1和StFKF1相互作用,StFKF1/StGI复合物调节StCDF1的稳定性,而StCDF1的稳定性控制StCOL1/2基因的表达,因此,StCDF1是昼夜节律钟调控StCO环节中的重要分子[45,47,50]。
2.1.2.2 FLOWERING LOCUST(FT,成花素)同源基因 产生于叶片并可以在植物韧皮部运输的FT蛋白被认为是诱导开花的信号分子,成花素基因FT是CO调控开花的直接下游基因,CO蛋白是调控FT基因的转录因子[49]。烟草和马铃薯的嫁接实验表明,开花和块茎形成是通过相同的移动信号来介导的,成花素是开花的移动信号,也可以诱导块茎形成,被称为成薯素[38]。在马铃薯中有4种FT同源基因:StSP6A、StSP5G、StTFL1和StSP3D。其中,StSP6A的激活与块茎诱导形成密切相关[45,48-49]。
StSP6A蛋白是产生于叶片的移动信号,可以移动到地下匍匐茎的茎尖诱导块茎形成。过表达StSP6A株系可使块茎形成提前,并且在非诱导(LDs)条件下形成块茎[48]。沉默StSP6A,在SDs条件下延迟结薯,但最终产量与野生型相比相差无几[48]。StSP6A参与块茎形成起始的激活,但是可能不参与后期的块茎形成[48]。在早熟品种中,StSP6A基因的表达量较高,而晚熟品种StSP6A基因的表达量相对较低。使用诱导型启动子诱导StSP6A可引起几个块茎标记基因(包括StGA2OX1)的激活。在一个光周期响应品种中,SDs诱导叶片和匍匐茎中StSP6A的mRNA 积累,StSP6A大量表达促进结薯[48-49]。但这种转录调控的机制目前还不明确。
LDs条件下,StPHYB感知光信号,再由光受体E3泛素化连接酶FKF1与核蛋白GI形成复合体,该复合体能够分解调节StCOL1/2基因的转录因子StCDF1,使StCOL1/2基因大量表达,抑制StSP6A基因的表达,抑制结薯[50-52]。StCOL1/2对块茎诱导的影响可以通过嫁接传递表明StCOL1/2参与远程调控信号分子的基因表达,这与StCDF1抑制StCOL1/2转录和增强StSP6A活性相一致。StCOL1/2对StSP6A的抑制作用也受StSP5G的控制,LDs能够促进StPHYF与StPHYB结合形成异源二聚体,稳定StCOL1并激活StSP5G基因的表达,进而抑制StSP6A的表达,使马铃薯在LDs下结薯受阻[39,46]。此外,在诱导块茎形成前,FT同源基因StTFL1 mRNA在匍匐茎中的丰度较高,在块茎发育的早期下降,过表达StTFL1可引起块茎产生数量的增加[53],表明StTFL1在块茎诱导和发育中的促进作用。已发现StSP3D可控制开花途径[48],但对马铃薯块茎形成的影响至今尚未见报道。
2.1.2.3 StBEL5与 POTH1 StBEL5(Solanum tuberosum BEL5) 和 POTH1(potato homeobox1) 是 马铃薯中两个相互作用的三氨基酸环扩展(TALE)蛋白[54]。
StBEL5 mRNA产生于叶片,通过韧皮部被运输到地下匍匐茎的茎尖诱导块茎形成[55]。StBEL5基因在叶片中的表达受低水平蓝光和红光的刺激,而不受日照长度的影响。在几个独立的株系中过表达StBEL5引起结薯提早、结薯率增加,而RNA干扰抑制StBEL5则显著降低块茎产量[56]。StBEL5蛋白激活多种块茎形成基因,如StSP6A和StCDF1基因[39,56]。在诱导条件下,产生于叶片的StSP6A 和StBEL5通过mRNA作为移动信号被运输到匍匐茎茎尖诱导块茎形成,StCOL1/2通过抑制叶片中StSP6A和 StBEL5 mRNAs的积累抑制块茎形成[57]。
马铃薯中的POTH1 基因受光诱导表达,编码POTH1的 mRNA被运输到匍匐茎顶端参与块茎形成[45]。Chen等[54]的研究发现 POTH1和 StBEL5协同互作抑制马铃薯赤霉素氧化酶基因StGA20ox1的表达,StGA20ox1能够将具有生物活性的GA1、GA4转变为无活性的GA8和GA34,从而调节块茎形成期间的GA合成。StBEL5-POTH1复合体还可以增加细胞分裂素水平。这表明StBEL5和伙伴蛋白POTH1相互作用,通过调节匍匐茎顶端激素水平介导块茎形成[45,54]。
2.1.2.4 参与块茎诱导调控的microRNAs 现已发现马铃薯中的两种microRNAs(miR172和miR156)可作为移动的信号分子来调控块茎形成[58,59]。
StPHYB和StBEL5参与了马铃薯块茎诱导对光周期的响应,然而它们是否在相同的结薯途径中起作用尚不清楚。Martin等[58]的研究表明,miR172在SDs下的表达量更高,在块茎形成的起始阶段,匍匐茎中miR172的表达量上调。在马铃薯中过表达miR172,在适宜的光周期诱导条件下可促进开花、加速块茎形成,LDs条件下也能诱导块茎形成。在LDs条件下结薯的植株中StPHYB的丰度降低,StBEL5 mRNA和miR172水平在叶片中降低,在匍匐茎中增加。再加上维管束中miR172的存在以及嫁接传递对块茎形成的影响,表明miR172可能是可移动的,或者是通过调节远距离信号诱导结薯。与此一致的是,过表达miR172的植株中StBEL5 mRNA水平升高,而StBEL5可以作为移动信号参与块茎形成[57]。这些结果表明,miR172可能作用于结薯抑制因子StPHYB的下游和结薯促进因子StBEL5的上游,由StPHYB、miR172和StBEL5协同控制结薯的过程[58]。
LDs条件下,miR156在马铃薯叶片和茎中显示较高的丰度,而在SDs条件下,匍匐茎中的miR156丰度增加,这表明miR156受光周期调控。过表达miR156的马铃薯植株块茎产量下降,miR172和SPLs水平都下降,研究表明miR156是通过StSPL9转录因子调节miR172,进而对块茎的形成起负调控作用[59]。
综上所述,光周期对马铃薯块茎发生的调控与其遗传机制密切相关,是一个复杂的综合调控网络。马铃薯叶片中的光受体StPHYA、StPHYB等首先感知光信号,并将光信号传递给昼夜节律钟的重要核心调控蛋白复合物StFKF1/StGI,StGI可以调控转录因子StCDF1的含量,最终负调控StCO的表达。同时,StPHYA、StPHYB和StPHYF等还可以直接对StCO的表达量进行调控[45-48]。StCO可以调控StSP6A、StBEL5的表达。而StSP5G对StSP6A起负调控作用,从而抑制块茎形成[39,49]。StBEL5-POTH1 复合体通过调节匍匐茎顶端激素水平介导块茎形成[54]。miR172也受StGI的调控,并影响StBEL5的表达[58]。miR156是通过StSPL9转录因子调节miR172,进而影响块茎形成[59]。
虽然光周期调控马铃薯块茎形成的分子机理研究已经取得了许多重要进展,但其中一些信号转导通路是通过相关实验推测而来的,未来仍需要大量研究来证实。
2.2 温度信号途径
温度是另一个重要的控制块茎形成的外部信号。已知较高环境温度不利于块茎形成。Menzel[60]的研究表明,高温对块茎形成的抑制作用是通过增加GA水平介导的,用GA生物合成抑制剂氯乙基三甲基氯化铵(矮壮素)处理植株或茎段,可克服由高温引起的对块茎形成的抑制作用。然而,GA信号转导通路中温度响应组件的分子机制尚未建立。
高温可通过减少同化物进入块茎的量和增加植株其它部分的量来影响同化物的分配。高的土壤温度并不影响诱导信号的产生,但会阻止匍匐茎形成块茎[61]。在高的土壤温度下匍匐茎会向上生长,一旦它们到达土壤表面遇到冷空气,则形成块茎。炎热的天气会使块茎上长出匍匐茎,这一过程称为热发芽。如果在热发芽后温度变冷,在匍匐茎尖将会开始形成一个新的块茎,通过高/低温的重复循环可以形成一个“链块茎”[37]。
作为马铃薯块茎形成的重要调控分子,StSP6A的积累除了依赖于日照长度外,还受温度控制。高温导致StSP6A的表达下调,这与块茎产量下降有很高的相关性。但其分子机制目前并不清楚[48,62-63]。
外界环境对马铃薯块茎形成的诱导可能是光周期和温度共同作用的结果。尽管有充分证据表明环境温度影响马铃薯块茎形成,但其分子机制目前知之甚少。这一部分尚需借鉴光周期信号途径的研究成果,阐明环境温度如何触发信号转导途径来调控马铃薯块茎的诱导与形成。
2.3 植物激素信号途径
块茎形成是环境信号和内源激素互作的结果。大量研究表明,多种植物激素对块茎形成的各个阶段都有显著影响,同一种植物激素对块茎形成的不同阶段影响不同[64]。
GA参与多种外界因素(光周期、温度、氮素等)对块茎形成的影响。大量研究表明GA不仅抑制块茎发生的诱导,还抑制块茎形成的启动[65]。GA可刺激匍匐茎的萌发、生长和分枝。高的GA水平有利于匍匐茎的萌发,但不利于块茎发生。因为块茎发生与匍匐茎生长停止及其顶端细胞分裂有关,伴随着GA含量减少,匍匐茎伸长停止。因此,所有诱导块茎发生的条件,如SDs、较低生长温度和有限的氮供应,都能显著降低匍匐茎中GA的含量[65]。
马铃薯结薯非诱导状态与高的内源GA水平相关。LDs条件下,马铃薯叶片中GA活性和含量比SDs诱导条件下高出数倍。SDs条件下,用GA处理的植株结薯延迟。LDs条件下,用抑制剂阻断GA合成可以促进块茎的形成[65]。在马铃薯块茎发育的早期阶段,可见的膨大之前,GA 2-氧化酶基因(StGA2ox1)的表达上调,它主要在匍匐茎的亚顶端区域和生长的块茎中表达,因此,StGA2ox1的作用是在块茎萌发早期,在块茎形成的起始阶段改变匍匐茎亚顶端区域的GA水平,促进块茎发育和生长[14,52]。
转基因植株在SDs条件下赤霉素氧化酶20基因(StGA20ox1)的表达水平与块茎形成时间呈负相关。该基因转录的增强延缓了块茎的形成,而表达的抑制则加速了块茎的形成。然而,由于抑制StGA20ox1基因转录而导致的GA水平下降并不能抵消LDs对块茎形成的抑制作用,即在LDs下不能形成块茎[66],故LDs抑制结薯可能不完全依赖GA信号,还有其他机制。
其中一个机制是StPHYB参与抑制LDs下的光周期诱导结薯[64]。无论在SDs还是LDs条件下,StPHYB合成受阻的转基因植株都能快速、密集地产生块茎。与一般认为的GA抑制结薯的观点相反,与野生型植株相比,这些转基因植株叶片和地上嫩枝中GA1的含量增加了3-5倍;GA20和GA8水平升高,但GA29水平降低。这表明在LDs条件下参与抑制结薯的StPHYB影响了活性GA组分的含量、比例和代谢[67]。
在马铃薯中过表达StBEL5,使StGA20ox1表达量降低,StGA2ox1表达量升高,GA活性下降,诱导块茎形成[52]。提高培养液中的氮含量,匍匐茎中GA活性增加,抑制块茎形成。蔗糖浓度可以改变匍匐茎顶端的GA1水平从而影响块茎形成[52]。此外,GAs对马铃薯块茎形成的影响不仅是通过GAs的合成/失活,它们在植株或特定器官中的运输也可能是重要的因素,然而,GA分配的机制尚不明确。近年来,优先负责糖转运的SWEET促进因子被认为参与了 GA 转运[16,68]。
脱落酸(ABA)也是控制匍匐茎生长的一个激素,通常对马铃薯块茎形成的诱导有积极的影响[65]。用ABA处理马铃薯叶片可促进块茎的形成,然而,块茎的形成过程本身与ABA在叶片中的积累并没有明显的直接关系,它的刺激作用是通过拮抗GA信号来实现的[65]。
茉莉酸(JA)及其衍生物茉莉酸甲酯(MeJA)即块茎酸(tuberonic acid,TA)和块茎酸葡糖苷(glucoside of tuberonic acid,TAG)是体外培养马铃薯外植体中促进块茎形成和生长的化合物[65]。早期的研究认为,这些化合物是块茎诱导形成的远距离刺激物。然而,目前还没有阐明叶片中这些化合物具体参与块茎形成诱导相关过程。JA、TA和TAG在马铃薯植株中通过脂氧合酶(LOX)合成;LOX催化多不饱和脂肪酸(FA)的氧化,主要形成亚油酸和亚麻酸,并形成相应的氢过氧化物[69]。
综上所述,块茎形成是环境信号和内源激素互作的结果,环境信号通过调控内源激素的合成/分解代谢途径、基因表达、内源水平与活性、各种激素比例等来调节块茎形成。但环境信号如何调控这些过程尚待进一步阐明。
2.4 参与块茎诱导形成的第二信使分子
马铃薯块茎形成受到各种外界和内源信号的激活或抑制,而这些信号常常通过一些第二信使分子参与信号转导途径来调控马铃薯块茎的形成。
2.4.1 蔗糖信号分子 蔗糖是植物主要的光合产物之一,不仅为细胞提供必要的能源物质,还作为信号分子调控植物的生长发育、细胞周期、基因表达等[70-71]。蔗糖信号系统对马铃薯块茎的发生、发育具有调控作用[52]。蔗糖水平可能是块茎形成的主要调控因子,离体块茎形成高度依赖蔗糖浓度[72]。蔗糖诱导马铃薯块茎形成过程伴随着块茎形成相关基因表达的提高,如patatin基因、Pin Ⅱ基因和钙依赖蛋白激酶 I(CDPK1)基因等[52,70]。
植物体源器官(叶片)中合成的蔗糖除少部分用于满足叶片自身的代谢活动外,大部分被运输到库器官,对产量和品质有重要影响。马铃薯块茎是营养物质的储藏器官,块茎形成与蔗糖的合成、运输、代谢密切相关。蔗糖转运蛋白(sucrose transporters,SUTs)对于蔗糖在不同器官中的运输和分配具有重要作用。目前已知的SUTs分为SUT1、SUT2和SUT4共 3个亚群[52]。StSUT1负责蔗糖的运输,SUT2是质膜上的蔗糖信号感受器,SUT4能促进GA的生物合成,GA也可以通过反馈调节使SUT4的表达增加[52,73]。StSUT4能促进StCO 蛋白对 StFT基因表达的抑制作用,从而抑制结薯[74]。
在块茎形成启动初期,蔗糖的卸载模式发生了从质外体到共质体的转变,这种转变可能是通过StSP6A和蔗糖流出运输器StSWEET11之间的相互作用来调节的。StSP6A与StSWEET11的结合阻止了蔗糖外流到质外体,因此可能促进共质体的蔗糖转运。StSWEET11和StSP6A蛋白之间的直接互作表明调控马铃薯块茎形成的糖信号和光周期通路之间存在交互作用(crosstalk)。StSP6A作为源-库分配的重要调节者,为修改源-库相互作用提供了可能[75]。
“(现有)电力市场是上世纪中叶设计的,而当时的体系如今已不再存在。我们看到,在许多地区多次出现一种情况,即电厂利润接近零,或者在一天的某个时段实际为负值,一些相对较旧的水电设施正在亏损。”
近年来有关糖在块茎诱导中作用的研究主要集中在其对植物激素水平的影响及其相互作用上[76]。相对于8%蔗糖,生长于含有1%蔗糖培养基中的马铃薯匍匐茎顶端含有较高水平的GA1,蔗糖被认为可以调节匍匐茎尖内源GA的含量,进而调控块茎形成[52]。高浓度GA处理可完全防止马铃薯结薯;但在培养基中添加高浓度蔗糖时,尽管植株内源GA含量高,但也会形成大量的块茎。因此,GAs和蔗糖调节块茎形成可能是两条平行途径[16]。
2.4.2 Ca2+信号 Ca2+是植物细胞信号转导中最重要的第二信使之一,并作为信号分子参与马铃薯块茎形成的诱导。在马铃薯中,蛋白质脱磷酸化是一些块茎形成相关基因转录激活所必需的[14]。植物中的钙依赖蛋白激酶(CDPK)是一类Ca2+信号受体蛋白。StCDPK1是马铃薯块茎诱导形成和发育期间蔗糖信号通路的一个关键因子,高浓度蔗糖和促进块茎形成的ABA和6-苄基腺嘌呤(BA)正向调控StCDPK1的表达,在马铃薯块茎形成的起始阶段,StCDPK1在匍匐茎膨大的部位大量表达,该部位同时也有蔗糖的大量积累,表明蔗糖可能通过对StCDPK1 特异性诱导表达促进结薯[52,70]。
细胞内钙离子浓度通过CDPK调节活性氧(ROS)爆发,参与NADPH氧化酶的激活过程[77]。在马铃薯块茎形成期间由Ca2+和 StCDPK1介导的活性氧爆发的作用值得被研究。尽管Ca2+和各种Ca2+调控蛋白在马铃薯块茎形成中发挥了积极作用,但Ca2+和Ca2+诱导的信号通路调控块茎形成的分子机制尚有许多待解之谜。
植物细胞产生的各种ROS在信号转导途径中发挥重要作用。H2O2激活Ca2+内流,胞内Ca2+浓度增加,进而引发植物对各种环境因子和内部信号的响应。最新的研究发现了植物细胞质膜表面存在过氧化氢受体HPCA1(hydrogen-peroxide-induced Ca2+increases 1),H2O2能够激活HPCA1的细胞内激酶活性,触发了Ca2+通道引起Ca2+内流,从而将环境信号传递到细胞内进而调节基因表达[78]。目前尚无关于ROS与马铃薯块茎形成相关的直接证据。另外,作为植物体内重要信号分子的NO和H2S,有没有可能参与马铃薯的块茎形成?至今尚未见报道。
马铃薯的块茎形成受到外部环境(光周期、温度、氮供应等)和内源激素及糖水平的共同调控。块茎形成对日长、温度、激素、碳水化合物和氮营养条件的响应是相互关联的,并具有适应性,它们构成了马铃薯发育的季节性策略。块茎形成的诱导是自身结薯能力和对有利环境信号感知相结合的结果。在适宜的环境条件下,各种各样的信号被激活并诱导块茎形成,这些信号或者在叶片中起作用,或者是在叶片中产生并向下移动到匍匐茎顶端诱导块茎形成。这些信号转导途径已日趋明晰,呈现出了一个复杂的块茎形成的调控网络。
3 马铃薯块茎形成的分子机制
马铃薯块茎形成是一个复杂的综合控制过程,外界环境和内源激素通过启动多条信号转导途径调节相关基因的表达,从而调控块茎形成。在适宜的环境条件下,马铃薯的块茎形成受到调节蛋白的激活,在这些调节蛋白中,有些是在叶片中起作用,另一些是产生于叶片并被运输到匍匐茎顶端诱导块茎形成。有3个最重要的调控块茎形成起始的调节蛋白是StCDF1、StSP6A和 StBEL5。StCDF1和StBEL5是转录因子,StSP6A是辅助调节因子家族的一个成员。这3种调节蛋白分别与其它相关蛋白形成复合物,通过相互作用调控块茎形成[47,49,57]。
3.1 StGI-StKFK1-StCDF1复合物
日长感知是通过FKF1/GI复合物来完成的,是开花和块茎形成共享的一个调节机制。SDs条件下,StGI-StKFK1-StCDF1复合物中的StCDF1可以结合StCO1/2启动子的特定区域抑制StCO1/2转录和激活StSP6A 基因的表达,诱导结薯[45,47,50,57]。
3.2 StBEL5/POTH1复合物
在块茎形成起始阶段,StBEL5和POTH1在叶片中相互作用,通过诱导StCDF1和 StSP6A的转录,而后信号放大发生在匍匐茎里,StBEL5在刚刚开始形成块茎的匍匐茎顶端通过自动调节增强自身的转录,在匍匐茎里StBEL5再次和POTH1相互作用诱导 StSP6A 和 StBEL5 的转录[47]。
StBEL5/POTH1复合物识别一个特定的顺式元件,该顺式元件是存在于StBEL5靶基因的一个TTGAC基序[1]。StBEL5过表达和抑制株系的发育研究表明,StBEL5与StSP6A基因的活性呈高度正相关[56]。分析表明StSP6A上游序列显示有5个TGAC串联基序[1]。作为StBEL5/POTH1的靶标基因,StCDF1的上游序列含有6个TTGAC串联的元件[56],StBEL5可以激活块茎形成相关基因StCDF1[47]。StBEL5/POTH1复合物能够抑制StGA20OX1的转录并提高StGA2OX1的活性[1]。研究发现,StGA20OX1启动子区域含有两个TGAC串联基序,StBEL5/POTH1可以与该序列结合并抑制StGA20OX1的活性。StGA2OX1启动子上也有10个TTGAC串联基序,过表达StBEL5植株中StGA2OX1的表达量增加,GA活性降低,促进块茎形成[79]。
总之,StBEL5和POTH1互作来调节上游的StSP6A 和StCDF1表达,进而调控下游多个块茎形成相关基因来诱导块茎形成。
3.3 成薯素复合物(tuberigen activation complex,TAC)
在匍匐茎顶端部位起作用的TAC由StSP6A、14-3-3调节蛋白和类FD(ferredoxin-like,FDL)蛋白组成。酵母双杂交分析表明,StSP6A蛋白与马铃薯的14-3-3蛋白和FDL蛋白相互作用。过表达StSP6A植株以一个14-3-3蛋白依赖的方式诱导早期结薯,抑制StFDL1则延迟块茎形成。这些结果表明该复合物的组件是块茎形成的局部触发器。然而,过表达StFD1对块茎形成没有影响[80]。块茎形成通常是通过在离散时间点产生块茎植株的百分比来判断的,不考虑整体的块茎产量,这表明该复合物的组件调控块茎形成的起始,但不一定影响整体块茎产量[80]。
在过去的20年,马铃薯块茎形成及其调控的分子机制方面的研究已取得了重要进展。蛋白质依赖的正向信号传导机制主要涉及StSP6A、StBEL5和POTH1转录因子及其许多靶基因。值得一提的是,StSP6A的靶基因还包括GA2-氧化酶GA2ox和蔗糖转运体SUT1。然而,碳水化合物平衡与其他信号通路之间的相互作用尚未得到充分的研究。基于已经获得的结果,包括自发形成块茎(spontaneously tuberizing,ST)植株中StSP6A丰度升高的结果,可以推测糖依赖和赤霉素依赖通路之间的信号交谈至少部分是由StSP6A介导的。然而,这个假设仍需实验来验证[16]。
根据上述的研究结果,本文构建了块茎诱导形成过程中可能的分子互作网络图示(图2)。
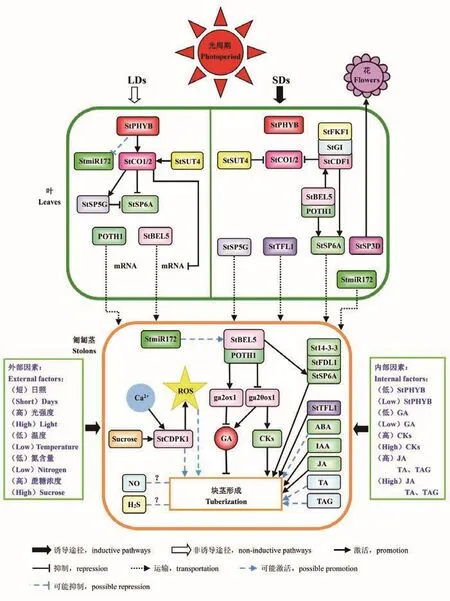
图2 马铃薯块茎诱导形成的可能分子互作网络图示Fig.2 Schematic diagram showing the possible molecular interaction network during tuber induction and formation in potato
4 展望
马铃薯块茎的诱导形成和生长是一个受各种外界环境信号和内源植物激素及信号分子调控的复杂过程。尽管历经数十年的研究,但块茎诱导和形成的信号转导途径和分子机制仍有许多待解之谜。面对全球气候变化和将马铃薯主粮化以满足日益增长人口的粮食和营养需求的期望,彻底阐明马铃薯块茎形成机制变得尤为重要和迫切。
近年来,各国研究人员一直在努力破解马铃薯块茎发生的分子机制,以识别和开发块茎发生的关键触发点和分子开关。这可能使马铃薯可以在一个更广泛的地域范围内结薯和种植,该范围包括大多数限制性的和关键的环境因素(如温度和光周期)。为了更好地了解马铃薯块茎形成的分子机制,科学家们对各种基因和蛋白质进行了鉴定。此外,一些参与从地上组织传递感知信号到匍匐茎的信号分子已经被识别出来并正在进行进一步的分析。虽然马铃薯基因组测序的完成[81]将有助于更好解析马铃薯块茎形成的分子途径,但进一步的功能基因组和蛋白组学研究将需要精确地描述与结薯过程相关的各个因子的相互作用。例如有一些证据表明StBEL5和 StSP6A可能协同工作。StSP6A 和 StBEL5在形成块茎的匍匐茎中共表达,激活一些相同的下游靶基因;两者都诱导StGA2OX1,但StSP6A作为一个辅助调节因子起作用,不能独立介导这种诱导。值得注意的是,StGA2OX1的上游序列包含6个串联的TTGAC元件,表明StBEL/POTH1或者StBEL/StSP6A复合物在该调节中起作用。凝胶位移实验证实StBEL5/POTH1特异性结合在StGA2OX1上游序列的这些串联基序上[1]。进一步阐明它们之间的互作及其在块茎形成中的作用无疑会有助于我们更好理解块茎形成的分子机制。
近年来兴起及广泛应用的各种生物技术和基因组学研究工具如基因编辑等[6,82]可用来确定块茎形成的关键分子靶点(基因和蛋白质),这些靶点可用于基因工程介导的马铃薯块茎形成过程的调控。如可 以 选 择 StSP6A、StPOTH1、StBEL5、miR172和StCDF等作为过表达的候选基因来正向调控块茎形成过程,而选择StPHYB、StCO、StSUT4和StSP5G等基因通过抑制靶点负向调控块茎形成,从而通过基因工程来提高马铃薯的产量。
调控块茎形成的多个信号转导途径之间存在相互作用,如高浓度蔗糖对StCDPK1的诱导表达表明Ca2+信号与蔗糖信号之间存在交互作用。且同一结薯基因可被不同的信号转导途径诱导表达,如高浓度蔗糖和SDs都可以特异性的诱导patatin class I 基因的大量表达。此外,尽管已知各种激素参与调控块茎形成,但关于激素的研究结果多是孤立的,没有确定任何一种激素作为块茎诱导形成唯一的发育开关。同样,也没有确切证据表明其它代谢产物(如蔗糖、氧化脂类、块茎贮藏蛋白或块茎酸等)能单独启动块茎形成。未来的挑战在于阐明参与块茎形成的多个信号分子和信号转导通路之间的相互作用及其这种互作对块茎形成的调控。
综上所述,马铃薯块茎形成是一个多种外界环境因素与内源植物激素和信号分子互作来激活或抑制多个特定基因表达、调控多条生化途径及同化物分配、最终使匍匐茎特定区域膨大的过程。基于现有和将来进一步细化的马铃薯基因组信息,通过多组学联合分析手段,可望全面解析控制马铃薯块茎形成的多重关键基因、代谢途径以及信号分子和转导途径之间如何互作来调控这些基因和途径,以最终阐明块茎形成的分子机制。这将有助于通 过精准分子育种手段来培育高产优质的马铃薯品种提供借鉴和新思路。

