利用RNA-Seq鉴定调控甘蓝型油菜叶片光合特性的低温胁迫应答基因
金姣姣 刘自刚 米文博 徐明霞 邹娅 徐春梅 赵彩霞
(1.陇东学院农林科技学院 陇东旱地作物种质改良及产业化协同创新中心 甘肃省旱地冬小麦种质创新与应用工程研究中心,庆阳 745000;2.甘肃省共建干旱生境作物学国家重点实验室 甘肃农业大学,兰州 730070;3.西藏自治区农牧科学院农业研究所,拉萨 860000)
低温会引起大豆、玉米、水稻等播期推后,生育期延迟[1],是造成农作物减产的主要因素[2-3],油菜作为中国主要的油料作物之一,也深受低温伤害[4]。长江中下游地区,甘蓝型油菜开花期倒春寒频发,光合作用被明显抑制,光合产物供应不足,造成落花落果,产量严重降低[5]。因此,研究甘蓝型油菜低温诱导光合特性,挖掘响应低温、调控光合作用的潜在基因,明确这些基因的分子功能和代谢途径意义重大。
低温主要是通过影响植物叶片、根系、生长点、花和果实[6-7],从而引起渗透物质、光合参数[8-9]、光合作用、呼吸作用及抗氧化酶系统等生理生化变化,造成植物发育不良、新陈代谢和分子功能障碍而,甚至死亡[10-11]。光合作用是植物营养器官构成的主要途径,低温胁迫能引起小麦光合速率、蒸腾速率、叶片气孔导度、胞间CO2浓度的等光合参数下降[11-12],抑制植物光合色素含量和光合作用等生理过程[13-16]。而叶绿体作为植物进行光合作用的主要细胞器,低温胁迫后,叶绿体形态结构发生明显变化,通过降低叶绿素含量来降低叶片对光的捕捉利用能力[14],基粒片层模糊,数目减少,嗜饿颗粒数目增加,淀粉颗粒含量下降甚至消失[15]。
近年,随着分子生物技术的不断提高,已经成功分离出很多低温胁迫响应基因[16-18]和抗冻蛋白[19-20],比如 RbohB[21]、COLD1[22]和 几丁质酶基 因(BnCHB4)[23],COR[24]、ICE[25]、HSF[26]、CBF[27]等抗冻蛋白。目前,组学分析在甘蓝型油菜上的研究比较成熟,但基于转录组学分析响应低温胁迫的光合调控机制研究较少。
本研究通过测定叶片超显微结构和光合气体参数,结合转录组分析,探究低温胁迫下甘蓝型油菜叶片光合调控途径,揭示低温胁迫下甘蓝型油菜参与光合调控的关键候选基因,为解析甘蓝型油菜光合特性对低温胁迫的响应提供理论基础。
1 材料与方法
1.1 材料
甘蓝型油菜NF24和17NS来自甘肃农业大学油菜课题组选育的纯合品系。品系17NS为耐寒品系;品系NF24为低温敏感材料。
1.1.1 实验设计 采用盆栽实验。将饱满干净大小一致的种子置于以两层滤纸为发芽床的培养皿中,人工气候箱25℃(6 000 lx光照25℃/14 h和20℃/10 h)培养20 h,种子萌发后点播于营养基质和蛭石以3∶1混合的花盆中,每个品系至少种6盆,每盆定苗3株。人工光照培养箱培养生长,光照25℃/14 h和20℃/10 h,相对湿度40%,待幼苗长至5-6叶期,低温-4℃光照培养箱开始低温处理0和24 h,其中2盆用于拍照,两盆用于测定光合指标,其余两盆用于取样。
1.1.2 取样 带口罩和无菌无酶手套,采集照片、测定光合参数和取完全展开的新叶待测样,灭菌的up水冲洗干净后液氮速冻,于-70℃超低温冰箱保存,用于测定试验各个指标。
1.2 测定指标和方法
1.2.1 光合指标测定 每份材料选取6片无遮阴、无损伤、无病虫害、生长状况良好的第4功能叶,挂小牌标记,按照刘自刚[28]的方法,采用美国生产的LI-6400型便携式光合仪测定低温处理0、12和24 h的光合气体交换参数变化(Gs、Ci、Tr、Pn),重复3次,设定光强为1 200 μmol/m2,叶室内温度为20℃。
1.2.2 叶绿素含量和相对电导率的测定 按照邹琦[29]《植物生理学实验指导方法》对叶绿素含量和相对电导率进行测定。
1.2.3 透射电镜 在低温处理0和24 h幼苗完全展开的新叶上,用刀片小心避过叶脉切取2 mm2的长方形叶片,投于含有2 mL 3%戊二醛的固定液中。按照电镜扫描的步骤,PB漂洗3次,15 min/次,饿酸固定4℃ 2 h,再用PB漂洗3次,15 min/次,按照50%、70%、80%、90%、100%、丙酮I和丙酮II梯度脱水,每次10 min。丙酮与树脂包埋剂按1∶1在35℃烘箱包埋12 h,再移至60℃烘箱直至材料完全聚合。超薄切片机切片,固定到铜网上用2%的乙酸铀酰和柠檬酸铅进行双染色。最后用日立JEM-1230投射电子显微镜进行照相。
1.2.4 转录组数据分析 利用耐寒品系17NS和低温敏感品系NF24进行转录组分析,以-4℃低温胁迫0 h为对照,-4℃低温胁迫24 h为处理,分别取样新鲜完整叶片,3个生物学重复,液氮速冻,-80℃超低温冰箱保存。
2个品系均分别处理0和24 h,共4个样(17NS-0 h、17NS-24 h、NF24-0 h 和 NF24-24 h),由基迪奥公司对样品提取总RNA后,用带有Oligo(dT)的磁珠富集mRNA,向得到的mRNA中加入fragmentation buffer使其片段成为短片段,再以断片后的mRNA为模板,用六碱基随机引物(random hexamers)合成cDNA第一链,并加入缓冲液、dNTPs、RNase H和DNA polymerase I合成cDNA第二链,经过QiaQuick PCR试剂盒纯化并加EB缓冲液洗脱经末端修复,加碱基A,加测序接头,再经琼脂糖凝胶电泳回收目的大小片段,并进行PCR扩增,从而完成整个文库制备工作,构建好的文库用Illumina HiSeqTM进行测序。对下机数据进行过滤得到clean data后,将reads比对到参考基因组上,并利用Cufflinks组装转录本,得到已知的转录本与新的转录本,然后对得到的基因进行表达量分析与统计,并进行差异表达分析和功能富集分析。
1.2.5 叶片总RNA提取 RNA提取按照Tiangen试剂盒(DP419)说明书提取17NS-0 h、17NS-24 h、NF24-0 h和NF24-24 h的叶片总RNA,反转录按TaKaRa cDNA第一链合成试剂盒(RR036A)说明书进行反转录得到单链cDNA,Bio Mater5超微量紫外分光光度计检测其浓度后置于-80℃冰箱保存、备用。
1.2.6 Real-time PCR 根据转录组数据,将上述反转录产物稀释到50 ng/mol,用Primer Premier 5.0设计引物,内参基因为Bnactin,由上海生工合成引物(表1),采用SYBR Premix Ex Taq(宝生物工程有限公司,大连)定量试剂盒,两步法扩增,每个反应均设置3个重复,反应体系见表2,反应程序为95℃ 30 s;95℃ 5 s,60℃ 30 s,40 个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。根据基因的扩增效率E,修正2-△△Ct为E-△△Ct计算相对定量结果,利用Excel 2010和SPSS 22统计分析。

表1 qRT-PCR鉴定引物Table 1 qRT-PCR primers used in this study

表2 qPCR反应体系Table 2 qPCR reaction system
1.2.7 生物信息学分析 通过NCBI寻找完整开放 阅 读 框(https://www.ncbi.nlm.nih.gov/orffinder/),DNAMAN软件进行序列比对分析,利用ProParam软件进行蛋白理化性质分析(https://web.expasy.org/protparam/)和氨基酸疏水性分析(https://web.expasy.org/protscale/), 通 过 WoLF PSORT 在 线 软件进行亚细胞定位预测(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/),用TMHMM 软件预测跨膜结构(https://embnet.vital-it.ch/software/TMPRED_form.html),使用SignalP 软件进行信号肽预测(http://www.detaibio.com/tools/signal-peptide.html), 利 用 NCBIConserved Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测保守结构域,经SOPMA软件预测蛋白二级结构(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl?page=npsa_sopma.html), 采 用SWISS-MODEL预测蛋白质三级结构(https://www.swissmodel.expasy.org/interactive), 通 过 ExPASy-PROSITE预测蛋白质活性中心(https://prosite.expasy.org/),通过DNAMAN软件进行多序列比对,通过MEGA 6.06软件进行系统进化树分析。
2 结果
2.1 低温胁迫对甘蓝型油菜植株形态及叶片发育的响应
2.1.1 低温胁迫对植株形态发育的影响 -4℃低温处理甘蓝型油菜24 h,观察植株的形态(图1),发现17NS和NF24 2个油菜品系叶片均发生萎蔫、下垂现象,其中敏感品系NF24叶片萎蔫现象明显,耐寒品系17NS叶片萎蔫现象较轻;对低温处理后的2个品系分别在室温恢复24 h,发现敏感品系NF24的老叶全部枯死,新叶恢复生机,而耐寒品系17NS恢复24 h后,全部新叶和部分老叶均呈绿色恢复生机。

图1 低温胁迫下的甘蓝型油菜形态观察Fig.1 Morphology of B.napus under low temperature stress
2.1.2 低温胁迫对甘蓝型油菜细胞超微结构的影响 对低温胁迫下的油菜叶片进行透射电镜观察,发现低温胁迫对叶片细胞中的细胞器结构和数量有较大影响,具体表现在叶绿体形态结构、嗜饿颗粒数量及淀粉粒等方面,抗寒性不同的品系,细胞器的变化程度不同。耐寒品系17NS低温胁迫24 h后,基粒片层明显弥散(图2-A1和图2-B1),淀粉粒数量增加(图2-A2和图2-B2),叶绿体数量和形态变化不明显(图2-A3和图2-B3)。敏感品系NF24中,低温胁迫前淀粉粒隐约可见(图2-C1),低温胁迫后消失,类囊体片层明显减少(图2-D1);嗜饿颗粒数量增加,叶绿体由紧贴细胞壁的单凸形变成远离细胞壁的草履虫形态,线粒体数量明显增加(图2-C2和图2-D2),单个细胞的叶绿体数量有所减少(图2-C3和图2-D3)。

图2 低温胁迫下甘蓝型油菜叶片超微结构观察Fig.2 Ultrastructure of B.napus under low temperature stress
2.2 低温胁迫对甘蓝型油菜光合特性的影响
2.2.1 低温胁迫对甘蓝型油菜细胞膜的影响 植物组织受到逆境伤害时,低温胁迫首先损伤的是细胞的膜体系,膜的功能受损或结构破坏,透性增大,细胞内的水溶性物质包括电解质将有不同程度的外渗。测定相对电导率,结果(图3)表明,耐寒品系17NS和敏感品系NF24受到低温胁迫前,相对电导率几乎一样,差异不显著,受低温胁迫后,相对电导率极显著增大,其中,敏感品系NF24的相对电导率增加量为86.90%,17NS的相对电导率增加量为76.10%。

图3 低温胁迫对油菜叶片相对电导率的影响Fig.3 Influence of low temperature to conductivity in rapeseed leaves
2.2.2 低温胁迫对光合速率、气孔导度、胞间CO2浓度和蒸腾速率的影响 通过对0(CK)-12h-24h低温胁迫下光合参数测定发现,低温极显著降低了叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr),提高了胞间CO2浓度(Ci)(图4),其中耐寒品系17NS叶片的Pn、Gs和Tr均高于冷敏感品系NF24,Ci则相反。耐寒品系17NS在低温胁迫0-12 h-24 h期间,叶片的Tr、Gs和Pn较对照极显著降低,降低幅度分别是67.15%、71.25%和32.23%,Ci较对照极显著增加,增幅为37.55%;冷敏感材料NF24在低温胁迫0-12 h-24 h期间,叶片的Tr、Gs和Pn较对照也是极显著降低,降低幅度分别是38.13%、58.33%和49.37%,Ci较对照极显著增加,增幅为18.91%。

图4 低温胁迫下不同抗寒品系的光合特征参数变化Fig.4 Photosynthetic characteristics of cultivars with different cold-resistance levels
2.2.3 低温对甘蓝型油菜叶绿素含量的影响 低温胁迫24 h后,不同甘蓝型油菜功能叶中叶绿素a(Chla)和叶绿素b(Chlb)含量均呈极显著下降趋势,类胡萝卜素(Chlx)呈极显著上升趋势(P<0.01)(图5)。其中敏感品系NF24的叶绿素a含量下降了0.184 mg/g FW,叶绿素b含量下降了0.387 mg/g FW,类胡萝卜素含量上升了0.224 mg/g FW;耐寒品系17NS的叶绿素a含量下降了0.076 mg/g FW,叶绿素b含量下降了0.175 mg/g FW,类胡萝卜素含量上升了0.089 mg/g FW。

图5 低温胁迫对油菜叶片叶绿素含量的影响Fig.5 Influence of low temperature on chlorophyll content in rapeseed leaves
2.3 低温胁迫下甘蓝型油菜的差异表达基因筛选
根据低温胁迫下甘蓝型油菜转录组数据,使用edgeR软件对组间基因表达量进行差异分析,利用FDR与log2FC来筛选差异基因,筛选标准为FDR<0.05且|log2FC|>1,在2个抗寒性不同的品系中,NF24 t0-17NS t0成对比较得到遗传背景差异基因共18 978个(表3),NF24 t-17NS t成对比较共得到22 019个差异基因,去除遗传背景差异,得到低温诱导显著差异表达基因共3041个(739个上调表达,2 302个下调表达)。

表3 RNA-Seq鉴定出的所有显著差异表达基因Table 3 All significantly differentially expressed genes identified by RNA-Seq
2.3.1 KEGG pathway分析 对差异基因进行KEGG Pathway分析,选择Q value≤0.05的通路为差异基因富集的通路。结果显示,在所有差异表达基因中,低温胁迫24 h后,NF24 t0-17NS t0和NF24 t-17NS t分别有4 229和4 675个差异表达基因,分别富集在131和132条通路中。通过P<0.05分别筛选出20条最为显著的通路作图展示(图6),其中核糖体蛋白(ribosome)和代谢通路(metabolic pathway)分别是低温胁迫前、后品种间最为显著的通路,均在亚麻酸代谢通路上(linolenic acid metabolism)富集量程度最高(绿色标记处)。
2.3.2 光合调控相关的差异表达基因分析 对低温胁迫后光合特性相关的2条显著通路进行分析发现,主要是能量代谢中的光合作用(photosynthesis)和光合作用-天线蛋白通路(photosynthesis-antenna proteins),其中光合作用-天线蛋白在NF24 t-vs-17NS t比较组中排名在前20个(图6-B:红色椭圆标记)。应用Venny在线软件(http://bioinfogp.cnb.csic.es/tools/venny/)对低温胁迫下不同品系差异表达基因进行交集和并集分析(图7),发现在这2条通路中,NF24 t0-17NS t0比较组得到的差异基因分别是50和12个,NF24 t-17NS t比较组得到的差异基因分别是69和30个。

图6 低温胁迫甘蓝型油菜差异基因表达支路(TOP20)Fig.6 Branch of differential gene expression in B.napus under low temperature stress(TOP20)

图7 光合调控相关通路上差异基因Venny图Fig.7 Venny diagram of differential expressed genes in photosynthetic regulatory pathways
2.3.3 低温胁迫诱导光合作用调控通路分析 在低温胁迫后,与光合调控相关的光合作用和光合作用-天线蛋白两条通路中,从NF24t-vs-17NSt的DEGs中去除与NF24t0-vs-17NSt0中重复的DEGs(遗传背景差异表达基因),共得到64个显著差异表达基因(图8),其中光合作用通路中DEGs共有38个,上调表达7个,下调表达31个,光合作用-天线蛋白通路中DEGs共有26个,上调表达1个,下调表达25个(图9-10)。
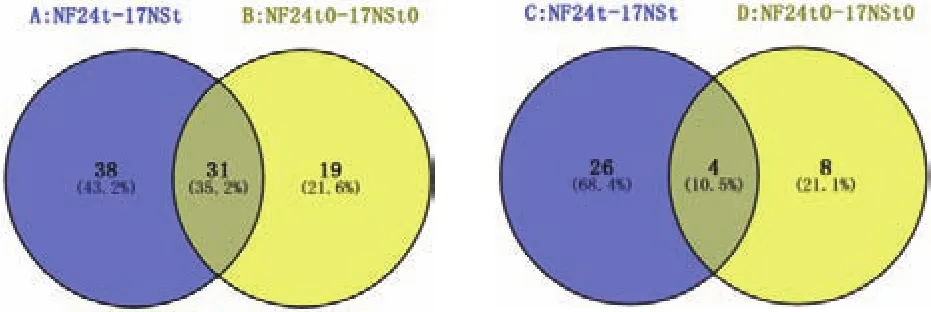
图8 光合作用-天线蛋白通路中低温诱导著差异表达基因Fig.8 Low temperature-induced the differential expressed genes in photosynthesis-antenna proteins pathways

图9 甘蓝型油菜光合相关显著富集通路中特异表达基因热图Fig.9 Heat map of specific gene expression in photosynthetic- pathway significantly enriched in B.napus
2.3.4 特异表达基因的GO功能分类 通过GO功能注释结果发现(图11),低温胁迫下特异表达的差异基因中关于光合调控的64个基因大多数注释到细胞组分过程和生物组分过程,在分子功能中的差异表达基因最少,主要集中在细胞过程、代谢过程、细胞、细胞组分、细胞器、结合、催化活性和转运活性。
2.3.5 特异表达基因的qRT-PCR验证 图11中的64个低温诱导特异表达基因中,敏感品系NF24和耐寒品系17NS在低温胁迫后大部分基因均下调表达,从光合作用通路中筛选上调表达的1个基因,下调表达的7个基因,在光合作用-天线蛋白通路中筛选出上调表达的1个基因和下调表达的8个基因进行qRT-PCR验证(表4),主要功能与光合系统Ⅰ、光合系统Ⅱ、放氧蛋白、铁氧还蛋白-NADP还原酶、叶绿素蛋白和ATP合成酶等相关。检测引物见表4。研究发现qRT-PCR的检测结果与RNA-Seq分析结果一致(图12),17个DEGs在qRT-PCR和RNA-Seq中的诱导表达变化趋势相同,证实了RNASeq分析结果的可靠性。

表4 17个DEGs的基因信息Table 4 Genetic information of 17 differentially expressed genes

图11 甘蓝型油菜叶片冷胁迫应答差异表达基因的GO分类Fig.11 GO categories of cold stress-responsive DEGs in leaves of B.napus

图12 17个DEGs的qRT-PCR验证Fig.12 Validaton of 17 differentially expressed genes by qRT-PCR
2.4 甘蓝型油菜响应低温胁迫调控光合作用的候选基因功能分析
根据qRT-PCR的检测结果,重点关注17个DEGs中上调表达的2个基因:光合作用通路的LOC106350097基因和光合作用-天线蛋白通路中的LOC106440450基因,分别命名为BnFd1和BnCP26。
通过NCBI寻找开放阅读框,发现BnFd1(Gene ID:LOC106350097;protein_id="XP_022576355.1")基因含有完整ORF,长度为447 bp,其产物是叶绿体上的铁氧还蛋白1(Ferredoxin-1;BnFd1),蛋白理化性质分析表明,BnFd1由148个氨基酸组成,不稳定指数为54.66,蛋白亲水性平均系数(grand average of hydropathicity,GRAVY)值为 -0.117,属于不稳定亲水蛋白(图13-A);亚细胞定位分析表明BnFd1蛋白定位于叶绿体和细胞质中,在第1-33个氨基酸位点存在一个信号肽(图13-B),属于PLNO3136超家族,在第1-148个氨基酸位点存在保守的Fd1结构域(图13-C)。二级结构预测显示,BnFd1蛋白的二级结构中α-螺旋占25%,β-折叠占5.41%,无规卷曲占45.95%,延伸链占23.65%(图13-D)。采用SWISS-MODEL在线软件以4zho.1.A为模板进行建模,预测BnFd1蛋白的三级结构,模型覆盖度为82.98%(图13-E)。

图13 甘蓝型冬油菜BnFd1蛋白的生物信息学分析Fig.13 Bioinformatics analysis of BnFd1 protein in B.napus

图10 低温胁迫甘蓝型油菜光合相关显著富集通路差异表达基因数Fig.10 Number of differentially expressed genes in the photosynthetic pathways significantly enriched in B.napus under low temperature stress
通过NCBI寻找开放阅读框,发现BnCP26(Gene ID:LOC106440450;protein_id="XP_013737568.1”)基因含有完整ORF,长度为846 bp,其产物是类叶绿体上叶绿素a-b结合蛋白CP26(BnCP26)。蛋白理化性质分析表明,BnCP26由281个氨基酸组成,不稳定指数为24.80,蛋白亲水性平均系数(GRAVY)值为-0.030,属于稳定亲水蛋白(图14-A),亚细胞定位分析表明BnCP26蛋白定位于叶绿体中,无信号肽(图14-B),属于叶绿素a_b结合超家族,在第18-266个氨基酸位点存在保守的叶绿素A-B结合蛋白结构域(图14-C)。二级结构预测显示,BnCP26蛋白的二级结构中α-螺旋占35.94%,β-折叠占4.27%,无规卷曲占51.60%,延伸链占8.19%(图14-D)。采用SWISS-MODEL在线软件以5mdx.1.7为模板进行建模,预测BnCP26蛋白的三级结构,模型覆盖度为97.39%(图14-E)。

图14 甘蓝型冬油菜BnCP26蛋白的生物信息学分析Fig.14 Bioinformatics analysis of BnCP26 protein in B.napus
2.4.2 甘蓝型油菜BnFd1蛋白和BnCP26蛋白的序列比较及系统进化树分析 将甘蓝型油菜中编码BnFd1蛋白的氨基酸序列,与白菜型油菜(Brassica rapa)、甘蓝(Brassica oleracea)、亚麻荠(Camelina sativa)、 荠 菜(Capsella rubella)、 萮 菜(Eutrema salsugineum)和萝卜(Raphanus sativus)等6个物种进行多序列比对,发现氨基酸序列相似性达到87.55%。构建系统进化树发现,甘蓝型油菜中的BnFd1蛋白与白菜型油菜的亲缘关系最近,氨基酸序列相似性达到98.65%,与荠菜的亲缘关系最远,氨基酸序列相似性为77.03%(图15)。

图15 甘蓝型冬油菜中BnFd1蛋白的氨基酸序列比对系统进化树分析Fig.15 Sequence alignment of amino acids and phylogenetic analysis of BnFd1 proteins sequence in B.napus
将甘蓝型油菜中编码BnCP26蛋白的氨基酸序列,与白菜型油菜(Brassica rapa)、甘蓝(Brassica oleracea)、芥菜型油菜(Brassica juncea)、亚麻荠(Camelina sativa)、鹰嘴豆(Cicer arietinum)、萮菜(Eutrema salsugineum)、萝卜(Raphanus sativus)、开心果(Pistacia vera)和拟南芥(Arabidopsis thaliana)等9个物种进行多序列比对,发现氨基酸序列相似性达到91.57%。构建系统进化树发现,甘蓝型油菜中的BnCP26蛋白与甘蓝的亲缘关系最近,氨基酸序列相似性达到99.64%,与鹰嘴豆的亲缘关系最远,氨基酸序列相似性为82.76%(图16)。

图16 甘蓝型冬油菜中BnCP26蛋白序列的氨基酸序列比对和系统进化树分析Fig.16 Sequence alignment of amino acids and phylogenetic analysis of BnCP26 proteins sequence in B.napus
3 讨论
低温是影响光合作用、呼吸作用和作物生长发育的最重要非生物胁迫之一。研究表明,CO2供应和同化CO2能力受阻除了气孔因素,还有非气孔因素的影响[31-32]。该研究发现,持续低温胁迫24 h能引起叶片变黄脱落,植株萎蔫,但是耐寒品系17NS的受损伤现象较轻,解除低温胁迫恢复24 h时,耐寒品系17NS恢复生机表现明显,这是因为耐寒材料在低温逆境中保持较高的光能转化、电子传递和弱光利用效率,亦可通过减少暗呼吸消耗和调整Gs降低幅度和速度来保持较高的光合速率,提高恢复能力,增强植株抗逆性[33]。低温胁迫下,敏感品系NF24较耐寒品系17NS相对电导率急剧上升,甘蓝型油菜叶片细胞膜的电解质大量外渗,可能是敏感品系的耐寒性和适应性较差,电解质外渗量较大,而耐寒品系具有较强的维持细胞膜系统的相对稳定和结构完整性的能力,更能抵抗低温伤害,说明植物可以通过增加渗透调节物质来缓解低温损伤,这与前人研究结果一致[34-37]。低温也能引物植物体内代谢缓慢,叶绿体功能紊乱而解体[38],合成叶绿素的原料受到抑制[39],使得叶绿体数目减少,体积收缩,基粒片层模糊,嗜饿颗粒数目增加,叶绿素a和叶绿素b含量显著降低,CO2同化能力受阻。小麦研究发现低温会导致气孔收缩,气孔导出受蒸发效率影响,细胞间隙的Ci上升[40],光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)显著降低,光合作用受到抑制,说明低温对光合速率的影响是由气孔因素转变为非气孔因素的。因此,低温不仅对油菜生理功能造成影响,也会对光合效率产生抑制作用。
本研究通过转录组学分析,得到2个显著光合调控通路,分别是光合作用和光合作用-天线蛋白通路,共64个差异表达基因,大多数注释到细胞组分过程和生物组分过程,说明低温对甘蓝型油菜生长发育的影响,其中主要集中在细胞过程、代谢过程、细胞、细胞组分、细胞器、结合、催化活性和转运活性方面,与本研究前期生理指标分析的低温影响细胞膜渗透率和光合作用等结论一致。通过qRT-PCR分析,鉴定出17个稳定表达的光合调控候选基因,其中15个基因下调表达,2个基因上调表达(BnFd1和BnCP26),证实了低温胁迫对光合作用的调控主要是通过抑制光合色素和光反应系统来进行的,反应了低温胁迫抑制了铁氧还蛋白:辅酶ii还原酶、光系统I反应、放氧蛋白、ATP合成酶、光系统II修复蛋白PSB27-H1、光系统I叶绿素a/b结合蛋白、叶绿素a-b结合蛋白等的表达,诱导了铁氧还蛋白和叶绿素a-b结合蛋白CP26的表达,说明低温是通过抑制光合色素和光反应系统来抑制光合作用的。2个上调表达基因中,BnFd1基因基因属于光合作用通路,能响应低温胁迫上调表达,编码148个氨基,其产物是叶绿体上的铁氧还蛋白1(Ferredoxin-1;Fd1),Fd与光合作用关系密切,它不仅通过与Fd-NADP+氧化还原酶(FNR)作用形成NADPH参与线性光合电子传递链,而且通过PGR5-PGRL1和NDH复合体参与循环电子传递,参与氮代谢、氢代谢和呼吸作用[41]。生物信息学分析发现,BnFd1蛋白定位于叶绿体和细胞质中,属于PLNO3136超家族,存在保守的Fd1结构域,铁氧还蛋白作为一个大的基因家族在植物中普遍存在,现已证实Fd基因可帮助水稻、烟草、拟南芥以及文心兰在内的许多植物获得广谱抗性[42],与本研究中Fd1能响应低温胁迫作出抗寒应答的结论一致。天线蛋白复合体是植物光合作用的关键组成部分,这一过程将光、二氧化碳和水转化为氧气和糖[43],PSII Lhcb5/CP26蛋白依赖的光参与调节叶黄素捕获,CP26和CP29的缺失可以损伤光合效率和光保护[44]。BnCP26基因属于光合作用-天线蛋白通路,能响应低温胁迫上调表达,编码281个氨基酸,其产物是类囊体上叶绿素a-b结合蛋白CP26,定位于叶绿体中,属于叶绿素a_b结合超家族,存在保守的叶绿素A-B结合蛋白结构域。关于候选基因的分子机理,还需进一步研究。
4 结论
低温胁迫可以诱导叶绿体上的铁氧还蛋白1(BnFd1)和类囊体上的叶绿素a-b结合蛋白CP26(BnCP26)表达,BnFd1蛋白和BnCP26蛋白可能会通过某种分子调控机制来应对低温逆境,以此来减弱其对植株的生理伤害和对光合作用的抑制。因此,BnFd1蛋白和BnCP26蛋白是甘蓝型油菜响应低温胁迫时光合调控的关键候选基因。

