Illumina MiSeq对热带环境血蜱属成蜱内共生真菌多样性分析
芦亚君,袁传飞,解芸芸,夏 琪,夏乾峰
蜱是寄生于多种动物体表的专性吸血节肢动物,宿主广泛,具有叮咬宿主吸血及更换宿主的习性。蜱是多种病原体的储存宿主和传播媒介[1]。蜱媒传染病种类多、范围广,已逐渐成为全球倍受关注的公共卫生问题,威胁人类健康和畜牧业的发展[2]。其中,血蜱属是引起严重危害的重要蜱属[3]。蜱媒病的传播与蜱的地理分布、自然环境、宿主行为等因素密切相关。温暖、潮湿的热带地区有蜱媒病逐步增加的趋势[4-5]。
真菌和昆虫都是物种极其繁多的类群。真菌广泛存在于几乎所有昆虫的体内,与昆虫存在着共生关系[6]。昆虫与真菌之间的共生关系包括双方都受益的互惠共生关系、只有一方受益的片利共生关系、一方受益另外一方受损的寄生关系及双方均受损的竞争关系[7]。真菌具有非常丰富的生物多样性,这也决定了天然代谢产物的化学多样性[8],挥发性和非挥发性的代谢产物可为昆虫宿主提供抵抗病原细菌的能力[9]。
昆虫体内的共生真菌群落组成具有高度动态变化特征,其相对丰度也随着自然环境、气候条件及昆虫不同的发育阶段转换而发生变化[10-11]。昆虫与内共生真菌之间存在复杂的相互作用关系体现在昆虫为真菌提供物理防护、生长条件和营养来源等;真菌及其代谢产物可影响昆虫摄食行为、提供营养元素,或者某些病原真菌可导致昆虫受损、死亡等[12]。微生物组学、转录组学、代谢组学等多组学研究[13]有助于更清晰地揭示真菌-昆虫互作的生物学现象及发生机制。本文以Illumina MiSeq高通量测序技术分析海南热带环境中植被表面上血蜱属成蜱的内共生真菌的群落组成及多样性,有助于探索蜱与真菌的互作关系及热带环境对蜱与真菌共进化的生态驱动因素。
1 材料与方法
1.1 蜱虫采集 使用布旗法[14]于海南省海口市郊区自然环境中的植被表面采集蜱,置于透气细胞培养瓶内保存。
1.2 形态学分类 采集后的蜱在尼康ECLIPSE Ni-E正置研究级显微镜下观察,根据外部形态特征和典型结构,筛选出血蜱属成蜱作为本实验的研究对象[15]。
1.3 蜱虫基因组DNA提取 取1只成蜱,用无菌生理盐水清洗3次,置于1.5 mL无菌离心管中,加入100 μL动物组织直接PCR试剂盒(北京百泰克生物技术有限公司)中的 AB溶液和研磨珠,置于高效组织细胞破碎仪(湖北新纵科病毒疾病工程技术有限公司)中,5 000 r/min 研磨30 s,重复5次,加25 μL AD Buffer,室温放置10 min后,95 ℃孵育5 min,加入100 μL AC溶液后即为蜱基因组DNA粗提物。
1.4 蜱虫分子鉴定 扩增COⅠ基因的上游引物COI-F:5′-GAGTCGGTAAAATGGCGCTAC-3′,下游引物COI-R:5′-GCTATCTTTAAGAGGGTAATA-3′[16](天一辉远基因科技有限公司合成)。PCR体系总体积为20 μL:2×PCR Mix 10 μL,上游引物、下游引物各0.8 μL,虫体粗提物4 μL,dd H2O 4.4 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸2 min,35个循环;72 ℃后延伸10 min。取5 μL PCR扩增产物于1%琼脂糖凝胶电泳检测,凝胶成像系统观察结果,并对PCR产物进行纯化、测序(华大基因科技有限公司)。所得序列在NCBI中进行BLAST比对。
1.5 Illumina高通量测序和数据分析 取20只成蜱,体表分别用75%乙醇和无菌生理盐水各清洗3次,研磨后的虫体组织以蛋白酶K裂解法提取基因组DNA。使用两步PCR法构建文库。扩增真菌ITS1基因的引物为ITS1-F:5′-CTTGGTCATTTAGAGGAAGTAA-3′和ITS1-R:5′-GCTGCGTTCTTCATCGATGC-3′。
一次PCR扩增体系50 μL,含5×PCR Buffer 10 μL,dNTPs (10 mmol/L) 1 μL,Phusion超保真DNA 聚合酶(南京诺唯赞生物科技有限公司) 0.5 μL,引物F(5′-TTCCCTACACGACGCTCTTCCGATCTCTTGGTCATTTAGAGGAAGTAA-3′)/ R(5′-GAGTTCCTTGGCACCCGAGAATTCCA-GCTGCGTTCTTCATCGATGC-3′) (10 μmol/L) 各1 μL,基因组DNA 1 μL,dd H2O 35.5 μL。PCR反应程序:94 ℃ 2 min;94 ℃ 30 s、50 ℃ 30 s、72 ℃ 30 s,循环40次;72 ℃ 5 min。取3 μL PCR产物于1.2%的琼脂糖凝胶电泳检测,AxyPrep DNA 凝胶回收试剂盒(爱思进生物技术有限公司)将目的片段进行纯化,纯化产物进行二次PCR扩增。二次PCR扩增体系40 μL,含5×PCR Buffer 8 μL,dNTP (10 mmol/L) 1 μL,Phusion 超保真DNA 聚合酶0.4 μL,引物F(5′-AATGATACGGCGACCACCGAGATCT-ACAC-barcode-TCTTTCCCT-ACACGACGCTC-3′)/ R (5′-CAAGCAGAAGA-CGGCATACGAGAT-barcode-GTGACTGGAGTTCCTTGGCACCCGAGA-3′) (10 μmol/L) 各1 μL,模板DNA 5 μL,dd H2O 23.6 μL。PCR反应程序:94 ℃ 2 min;94 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s循环8次;72 ℃ 5 min。PCR产物于1.2%的琼脂糖凝胶电泳检测、进行纯化后构建文库。
以Illumina MiSeq平台进行高通量测序(微基生物科技有限公司),将测序得到的有效序列进行质控、过滤、拼接,得到优化序列。优化序列使用mothur V.1.39.5软件进行OTU(Operational Taxonomic Units)聚类分析及alpha多样性分析。
2 结 果
2.1 蜱分子鉴定及系统发育分析 COⅠ基因PCR扩增产物在650~750 bp之间有特异性条带。测序结果经NCBI数据库中BLAST比对结果显示蜱虫样本为血蜱属(Haemaphysalisspp.),覆盖度为100%,相似度为89.52%。
2.2 真菌OTU聚类分析 高通量测序后有效序列数是45 858,优化序列数为44 073,碱基个数11 876 878,GC含量为49.02%,序列长度为183~433 bp,平均长度为269 bp(图1A,图1B),聚类为245个OTU。在序列相似性为97%以上的OTU稀释性曲线(rarefaction curves)显示该组数据具有足够的测序深度(图1C)。丰度等级曲线(rank abundance curves)不平滑,表明245个OTU聚类的物种分布不均匀(图1D)。

A:有效序列长度;B:优化序列长度;C:稀释性曲线;D:丰度等级曲线图1 海南热带环境血蜱属内共生真菌OTU聚类分析Fig.1 OTU cluster analysis of the endosymbiotic fungi in Haemaphysalis spp. from tropical environments in Hainan
2.3 真菌群落组成分析 血蜱属成蜱体内真菌群落组成(图2),在各个分类阶元上具有明确分类信息,且按相对丰度排序,其群落构成分布于3个门,分别是子囊菌门(Ascomycota)占80.56%、担子菌门(Basidiomycota)占15.43%及接合菌门(Zygomycota)占0.37%。纲水平的群落组成分布于19个纲,排在前3位分别是座囊菌纲(Dothideomycetes)占52.48%、银耳纲(Tremellomycetes)占9.34%及粪壳菌纲(Sordariomycetes)占7.94%;目水平的群落组成分布于12个目,排在前3位分别是煤炱目(Capnodiales)占35.84%、格孢腔菌目(Pleosporales)占14.62%及银耳目(Tremellales)占8.71%;科水平的群落组成分布于20个科,排在前3位分别是球腔菌科(Mycosphaerellaceae)占18.49%、小戴卫霉科(Davidiellaceae)占6.45%及畸球腔菌科(Teratosphaeriaceae)占3.11%;属水平的群落组成分布于29个属,排在前3位分别是平脐疣孢属(Zasmidium)占8.99%、枝孢属(Cladosporium)占6.45%及亚隔孢壳属(Didymella)占4.31%;种水平的群落组成分布于22个种及未明确分类地位物种,排在前3位分别是Zasmidiumcitri-griseum占7.72%、皱枝孢(Cladosporiumdelicatulum)占6.43%及Pseudocercosporadovyalidis占3.76%。

A:门水平物种分布;B:纲水平物种分布;C:目水平物种分布;D:科水平物种分布;E:属水平物种分布;F:种水平物种分布图2 海南热带环境血蜱属内共生真菌群落组成Fig.2 Endosymbiotic fungal community composition in Haemaphysalis spp. from tropical environments in Hainan
2.4 真菌Alpha多样性分析 Alpha多样性包括菌群多样性指标Shannon指数、Simpson指数;以及菌群丰度指标Chao指数和Ace指数。Shannon指数和Simpson指数反映了群落中的生物多样性,Shannon指数通常在0~5之间,大于1说明该群落具有较高的生物多样性。Shannon指数为4.45(图3A),说明该样本具有较高的真菌多样性[17-18]。Simpson指数无限接近于0,表示群落中生物多样性越高。Simpson指数为0.022 5(图3B),说明该样本具有较高的真菌多样性。Shannon指数和Simpson指数一致说明本研究中的血蜱属样本体内真菌具有较高的多样性[19]。
Chao指数和ACE指数反映样品中群落的丰富度。在一定数量范围内,Chao指数和ACE指数的曲线迅速上升至245(图3C,图3D),随着序列数的增加,曲线平缓,趋于饱和,测序深度基本覆盖所有物种[20-21]。
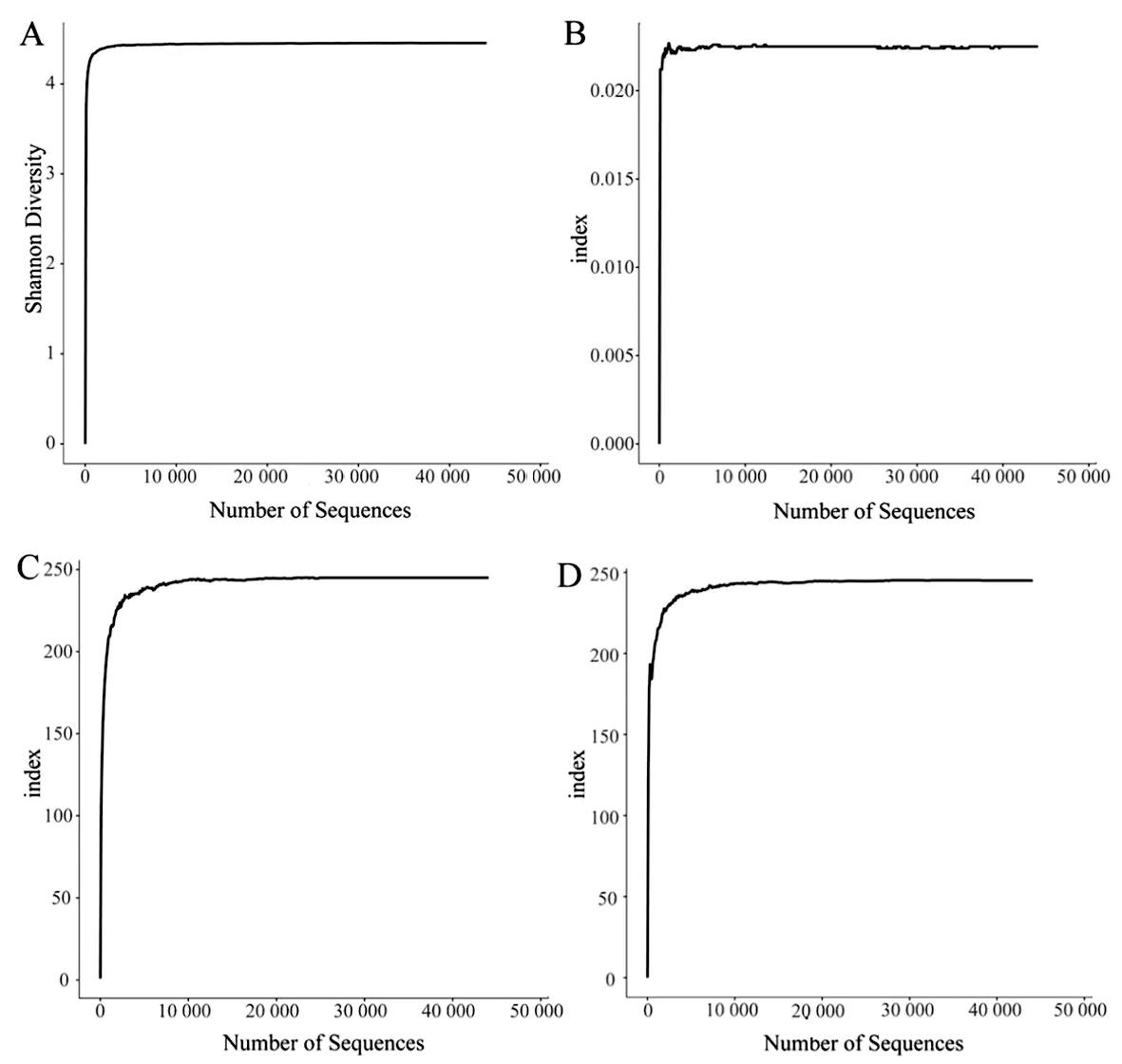
A:Shannon指数;B:Simpon指数;C:Chao指数;D:Ace指数图3 海南热带环境血蜱属内共生真菌Alpha多样性分析Fig.3 Alpha diversity analysis of the endosymbiotic fungi in Haemaphysalis spp. from tropical environments in Hainan
3 讨 论
蜱媒病是影响人类健康的一个显著危险因素。蜱在温带地区具有季节消长,而在热带地区全年可见。全球变暖的气候变化、宠物增加、畜牧业发展、户外旅游和探险活动增加,均导致蜱媒病感染呈上升趋势[22]。海南省是我国热带省份,全年长夏无冬、植被茂密,非常适合蜱孳生、活动,具有蜱媒病传播的自然条件。
蜱内共生真菌报道极少,本文以热带环境植被表面上的游离血蜱为研究对象,以真菌ITS1基因进行高通量测序,探讨血蜱属成蜱内共生真菌的群落组成,分析其多样性。来自热带环境植被表面的血蜱属成蜱内共生真菌聚类为245个OTU,且物种分布不均匀。在高阶元分类水平上,优势菌门为子囊菌门(Ascomycota),其次为担子菌门(Basidiomycota)。Alpha多样性分析数据表明血蜱属成蜱内共生真菌具有十分丰富的生物多样性。
内共生真菌的群落组成及其天然代谢产物是否影响蜱的生理变化,包括栖息特征、侵袭行为及宿主选择的偏好性等,还需进一步探讨。研究蜱与内共生真菌的互作关系、内共生真菌代谢产物与细菌之间的拮抗作用、热带环境的生态驱动能力及病原真菌在控蜱方面的应用[23],都为深入了解蜱的行为特征及建立有效的生物学防控措施提供了新的思路。
利益冲突:无
引用本文格式:芦亚君,袁传飞,解芸芸,等. Illumina MiSeq对热带环境血蜱属成蜱内共生真菌多样性分析[J].中国人兽共患病学报,2022,38(5):441-446. DOI:10.3969/j.issn.1002-2694.2022.00.047

