结核分枝杆菌德拉马尼和PA-824耐药相关机制研究进展
王晓英,罗 明,李俊刚,张汇征
由结核分枝杆菌(Mycobacteriumtuberculosis, MTB)感染导致的结核病仍是全世界十大死因之一,并且是最致命的传染性疾病之一。而耐药结核病的出现,尤其是耐多药结核病(multi-drug resistant tuberculosis, MDR-TB)和广泛耐药结核病(extensive drug resistant tuberculosis,XDR-TB)的出现,使得结核病的防控和治疗工作更加困难。据世界卫生组织(World Health Organization, WHO)估算,2020年全球耐多药结核病及利福平耐药结核病(rifampicin resistant tuberculosis, RR-TB)患者数约为15.8万。2019年,我国约有1.6万名MDR/RR-TB患者,约占全球MDR/RR-TB病例的10%。然而,RR-/MDR-TB的治疗非常困难,成功率仅为59%[1]。近年来,抗结核药物的研发取得了一些进展。2019年,WHO在耐药结核病治疗整合版指南中,将德拉马尼列为MDR-TB和XDR-TB治疗的C组药物[2]。PA-824(Pretomanid)是近半个世纪以来批准上市的第3个抗结核病新药。其与贝达喹啉和利奈唑胺组成的BPaL方案针对XDR-TB或无法耐受治疗/治疗欠佳的MDR-TB成人患者有较好的治疗效果。参加此治疗方案的109名高度耐药结核病患者在经过6个月治疗后,治疗成功率高达89.9%[3]。然而,德拉马尼和PA-824作为抗结核新药,也被报道存在MTB对这两种药物耐药的情况。因此,及时检测MTB对这两种药物的耐药情况,能够最大限度的降低耐药风险并提高治疗的有效性。本文对德拉马尼和PA-824的耐药机制及耐药相关基因突变情况进行了综述,以期为今后这两种药物耐药株的快速检测提供参考。
1 德拉马尼和PA-824的作用机理
德拉马尼和PA-824同属硝基咪唑类抗结核药物,均是一种前体药物,其作用机理类似。
1.1 德拉马尼的作用机理 德拉马尼是一种硝基二氢咪唑类衍生物的新型抗结核药物,于2014年被欧洲药品管理局批准用于治疗成人肺部MDR-TB。其作用机制是通过抑制MTB分枝菌酸的合成,尤其是甲氧基分枝菌酸和酮基分枝菌酸的合成,进而扰乱MTB细胞壁的合成,有助于药物对MTB的渗透,从而达到杀菌的效果[4-5]。另外,也有研究表明,德拉马尼对MTB的抑制作用可能与NO等活性自由基的释放有关[6]。
1.2 PA-824的作用机理 PA-824具有较高的抗MTB活性,对复制期和非复制期的MTB均有较好的杀菌作用。其对MTB的杀菌机制体现在好氧杀菌和厌氧杀菌两个方面。好氧杀菌机制主要通过将MTB细胞壁分枝菌酸酯上的羟基氧化为羰基,从而抑制MTB细胞壁分枝菌酸的合成而发挥作用[7-9]。因PA-824是一种前体药物,其在发挥抗MTB作用之前首先会被MTB激活。激活后的PA-824的4′端硝基咪唑基团能够形成活化的中间体,随后损伤MTB细胞内的其他分子。而在其厌氧杀菌机制中,PA-824可直接作为NO供体,而NO可直接抑制MTB呼吸链的电子传递,从而抑制MTB的生长[10]。
2 德拉马尼和PA-824的耐药机制
德拉马尼和PA-824同为硝基咪唑类抗结核药物,其耐药机制也基本相同(图1)。有研究认为,MTB对这两种药物耐药主要与激活前体药物所需的酶功能的丧失有关。作为前体药物,德拉马尼和PA-824需要脱氮黄素(辅因子F420)依赖性硝基还原酶[deazaflavin (F420cofactor)-dependent nitroreductase, Ddn]激活其抗结核活性,而脱氮黄素由4种F420生物合成蛋白(F420biosynthesis protein, Fbi)共同参与合成,包括原来已报道的FbiA、FbiB、FbiC以及最新发现的FbiD[11-12]。而且F420的氧化还原循环需要葡萄糖-6-磷酸脱氢酶(F420dependent glucose 6-phosphate dehydrogenase, Fgd1)的参与[13-15]。因此,ddn、fgd1以及参与F420生物合成途径的fbiA、fbiB、fbiC和fbiD中任一基因突变都可能会引起MTB对德拉马尼和PA-824的耐药。虽然德拉马尼和PA-824存在类似的耐药机制,但目前鲜有关于这两种药物耐药情况的比较分析。目前的研究表明,对德拉马尼和PA-824耐药的MTB存在部分相同的基因突变,但突变位点不尽相同。本文将对这两种药物耐药相关基因及其突变位点进行详细的分析,以期为这两种药物耐药株的快速检测及其在临床上的合理应用提供参考。
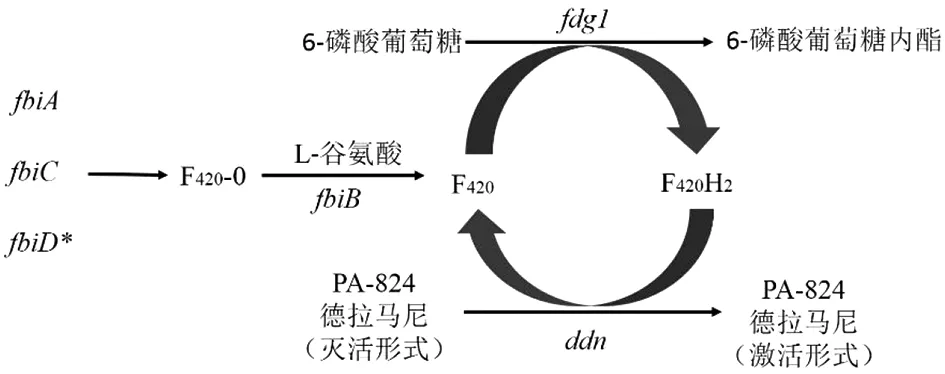
注:*为目前的研究尚未证实fbiD基因突变与德拉马尼耐药相关。图1 参与德拉马尼和PA-824生物激活的基因Fig.1 The genes participate in the activation of delamamid and PA-824
2.1ddn(Rv3547)基因 全长456 bp,编码F420依赖性的硝基还原酶,从而激活前体药物PA-824和德拉马尼。Ddn还原活化PA-824是以PA-824为底物、F420为辅酶直接还原PA-824,产生抑菌产物[7]。在MTB对德拉马尼耐药相关的研究中,Schena等的研究采用全基因测序技术对德拉马尼耐药菌株进行检测,结果发现仅ddn突变(Trp-88→STOP)可在德拉马尼耐药菌株中检测到,说明其与德拉马尼耐药相关[16]。Fujiwara等在临床MDR-TB分离株中检测到了德拉马尼耐药菌株中存在氨基酸改变为L107P以及nt59-101的删除突变[13]。Zheng等研究表明在4株德拉马尼耐药MTB菌株中,有2株存在ddn基因第81位密码子突变[17]。而在MTB对PA-824耐药的相关研究中,Haver等的研究表明,在183例PA-824诱导耐药的MTB菌株中,检测出53株中ddn基因存在19种突变,主要突变类型为C32A,导致的氨基酸改变为Ser11→STOP(58%,31/53)[12]。此外,多项研究表明,在体外诱导的PA-824耐药菌株中,发现了ddn基因突变,但突变位点不尽相同[4,18-19]。Lee等的研究表明,虽然德拉马尼和PA-824耐药菌株中均存在ddn基因突变,但德拉马尼和PA-824附着在Ddn上的位点不同。该研究发现,ddn基因S78Y突变的MTB对PA-824表现出耐药但对德拉马尼却仍旧敏感,而ddn基因L49P突变却导致MTB对德拉马尼和PA-824的交叉耐药[20]。
2.2fgd1(Rv0407)基因 全长1 011 bp,编码6-磷酸葡萄糖酸脱氢酶,催化葡萄糖6-磷酸氧化为磷酸葡萄糖酸内酯,进而将F420还原为F420H2[21]。Bolemberg等在MTB临床分离株中检测出了fgd1基因突变,发现密码子49的位置发生了移码突变[22]。而Fujiwara等在MDR-TB临床分离株中同样检测到了fgd1基因突变,发现在密码子320的位置发生了置换突变[13]。而在体外诱导的PA-824耐药菌株中,多项研究也检测到了fgd1基因突变,但突变位置比较分散,发生在密码子43和密码子230之间,且每一种突变类型只能在1株突变菌株中检测到,仅P43R突变在2株PA-824耐药菌株中重复检出[4,12, 18-19]。
2.3fbiA(Rv3261)基因 全长996 bp,fbiA编码2-磷酸乳酸转移酶,负责将2-二磷酸-5-鸟苷的磷酸乳酯部分转移到FO(7,8-二甲基-8-羟基-5-去氮杂黄素)中,FO随后参与F420的生物合成[23]。Bloemberg等及Hoffman等关于德拉马尼耐药机制的研究表明,在德拉马尼耐药的临床MTB分离株以及XDR-TB中检测到了第49位密码子突变(分别为D49Y和D49T)[22, 24],而Schena等则在德拉马尼耐药的XDR-TB临床分离株中检测到了第250位密码子突变(K250*)[16],提示第49位和第250位密码子突变可能与德拉马尼耐药有关。Battaglia等通过对德拉马尼耐药的MTB菌株进行检测,发现fbiA基因 K2E、V154I、I208V、I209V、K250*、S126P、R304Q突变与德拉马尼最低抑菌浓度(minimum inhibitory concentration,MIC)的升高有关[25]。在关于MTB对PA-824耐药机制的两个研究中,Haver等检测出了27个无义突变或者是移码突变,突变位点分布在第21-323位密码子之间,其中第56位(L56P,L56P[T167C])、第81位(Q81P[242C插入])、第119位(L119P,L119P[T356C])以及第192位(K192K[575A插入],K192S[575A插入])密码子突变分别在2株PA-824耐药菌株中检测到,而其他密码子突变仅在1株PA-824耐药菌株中检测到[12]。而Kidwai等的研究也发现由于fbiA基因灭活导致MTB对PA-824耐药,但本研究中并未列举具体的突变位点[19]。
2.4fbiB(Rv3262)基因 全长1 347 bp,fbiB编码L-谷氨酸连接酶,通过向F420-0中添加L-谷氨酸残基来催化F420生物合成途径的最后步骤,产生聚L-谷氨酸尾[26]。目前,关于MTB对德拉马尼耐药机制的研究中,Battaglia等通过对德拉马尼耐药的MTB菌株进行检测,发现fbiB基因P361A突变与德拉马尼MIC的升高有关[25]。然而,Nieto Ramirez等的研究表明,fbiB基因相关的突变仅在德拉马尼敏感的MTB菌株中检测到[27]。而关于MTB对PA-824耐药机制的研究中,Haver等的研究表明,在体外诱导的PA-824耐药菌株中,第39位(Y39*[G117A])、第153位(G153V[G458T])以及第361位(P361A[C1081G])密码子发生了基因突变且分别仅在1株耐药菌株中检测到[12]。虽然,Kidwai等的研究也发现了由于fbiB基因灭活导致的MTB对PA-824耐药,但研究中并未列举具体的突变位点[19]。因此,fbiB基因相关突变是否与德拉马尼耐药相关,还需要进行更深入的研究。
2.5fbiC(Rv1173)基因 全长2 571 bp,fbiC基因编码FO合酶,将羟基苄基从4-羟基苯丙酮酸转移到嘧啶二酮,随后参与嘧啶二酮和FO之间F420生物合成途径的一部分,FbiC对F420的合成至关重要[6]。fbiC基因的失活使MTB对氧化应激反应变得敏感。Pang等对德拉马尼耐药的XDR-MTB菌株进行检测,并在2株XDR-MTB菌株中检测到了fbiC第318位密码子突变(V318I),而且这2株XDR-MTB菌株中并未检测到fbiA、fbiB、fgd1以及ddn基因突变[28]。Zheng等也在1株德拉马尼耐药MTB菌株中检测到了fbiC第318位密码子突变(V318I)[17]。Battaglia等通过对德拉马尼耐药的MTB菌株进行检测,发现fbiC基因C105R、L228F、L377P、A856P、A835V、S762N突变与德拉马尼MIC的升高有关[25]。这些研究表明,fbiC基因突变可能与德拉马尼耐药相关。在关于MTB对PA-824耐药机制的研究中,Haver等在6株体外诱导的PA-824耐药菌株中,检测到了第720位密码子突变(V720I和V720G),并在4株体外诱导的PA-824耐药菌株中检测到了第843位密码子突变[12]。Manjunatha等的研究检测到了体外诱导的PA-824耐药MTB菌株中存在fbiC基因突变,突变位点为第630位密码子(V630E)[4]。其他两项研究也在体外诱导的PA-824耐药MTB菌株中检测到了fbiC基因删除突变,从而导致MTB对PA-824耐药[18-19]。
2.6fbiD(Rv2983)基因 FbiD为磷酸烯醇丙酮酸尿苷转移酶,用来合成部分磷酸烯醇丙酮酸并随后被FbiA转移到FO中,而FO为F420的前体。而且,F420的生物合成也被证实需要FbiD的参与[11]。Rifat等的研究表明,fbiD基因突变将会导致MTB对德拉马尼和PA-824耐药。该研究通过对来自于47只小鼠的161株PA-824耐药菌株进行全基因组测序发现了99个突变,其中91%的突变出现在已报道的5种基因上:fbiC(56%)、fbiA(15%)、ddn(12%)、fgd(4%)以及fbiB(4%),而剩余9%的PA-824耐药菌株存在fbiD基因突变,包括8种点突变导致的氨基酸改变(R25S, R25G, A68E, A132V, G147C, C152R, Q114R, A198P)和A27之后插入C以及I129 (-ATC)的删除突变[11]。fbiD基因突变导致了MTB对德拉马尼和PA-824耐药,但值得注意的是,fbiD和fbiB突变的菌株显示出对PA-824的高水平耐药,但对德拉马尼的敏感性却只有相对很小的改变[11],这也可能解释了在以往德拉马尼耐药的MTB菌株中未检测到fbiD和fbiB基因突变的原因。
3 展 望
德拉马尼和PA-824同属硝基咪唑类抗结核药物,对MDR-TB以及XDR-TB有较好的治疗前景,但目前研究表明,德拉马尼和PA-824的耐药相关基因突变却存在差异。目前报道的与MTB对德拉马尼耐药相关的基因包括ddn、fgd1、fbiA、fbiB以及fbiC;而与MTB对PA-824耐药相关的基因包括ddn、fgd1、fbiA、fbiB、fbiC以及fbiD,且突变位点比较分散。fbiD基因突变与PA-824的高水平耐药相关,但却并未表现出对德拉马尼的耐药。而fbiB基因突变是否与德拉马尼耐药相关还需要进一步的研究。虽然德拉马尼和PA-824耐药相关基因存在重叠,但突变位点却不尽相同。另外,对德拉马尼耐药MTB菌株的相关研究中均为临床分离菌株,而PA-824由于临床应用较少,其耐药相关菌株多是体外诱导。因此,在对德拉马尼和PA-824的耐药快速检测的相关研究中,应注意耐药相关基因突变位点分布的差异性。综上所述,本文对德拉马尼和PA-824耐药相关基因的突变情况进行了详细的分析,为进一步研究德拉马尼和PA-824耐药相关机制以及开发新的耐药快速检测方法提供了理论参考。
利益冲突:无
引用本文格式:王晓英,罗明,李俊刚,等. 结核分枝杆菌德拉马尼和PA-824耐药相关机制研究进展[J].中国人兽共患病学报,2022,38(5):423-427. DOI:10.3969/j.issn.1002-2694.2022.00.062

