放疗期间淋巴细胞最低点时相关血液参数对宫颈癌预后的预测价值
马飞艳,左权,刘健男,葛雪珂,张思琪,刘素坤#
1承德医学院研究生学院,河北 承德 067000
2保定市第一中心医院放疗科,河北 保定 071000
3湘西自治州人民医院肿瘤科,湖南 湘西 416000
4火箭军医学特色中心胃食管外科,北京 100071
宫颈癌是世界范围内女性最常见的妇科恶性肿瘤[1-3],也是发展中国家女性肿瘤相关死亡的主要原因[4]。目前认为肿瘤大小、淋巴结转移情况、临床分期、病理分级、分子类型是宫颈癌预后的独立预测因子[5]。对于局部晚期宫颈癌,目前同步放化疗是标准的治疗方法[6],但是经过积极治疗,仍有部分患者会复发。研究表明,肿瘤微环境在肿瘤发生、进展、转移及预后中发挥重要作用[7-9]。证据表明,中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)和其他以炎症因子为基础的血液指标,是预测各种实体肿瘤预后的有效指标[10-12],这些肿瘤中包括宫颈癌[13]。但是目前研究主要关注治疗前淋巴细胞相关血液指标(lymphocyte-related blood parameter,LRBP)对宫颈癌预后的影响,只有少数研究关注放疗期间LRBP对预后的影响。在目前研究中,LRBP的选取时间点都经过了特殊的选择,如放疗前及放疗后1个月。但是,不同的患者放疗期间LRBP存在差异,因此在放疗期间每周进行一次血常规检查,在所有的血常规结果中找到最具代表性的时间点的对应血常规结果进行分析,所得到的结果更具代表性。由于放疗会导致淋巴细胞(lymphocyte,LY)减少,放疗期间最低点时的LY可能比其他时间点的LY更能代表放疗期间的免疫状态。因此,本研究采用回顾性队列研究,探讨放疗期间LY最低点时LRBP对宫颈癌预后的预测价值,同时收集放疗前LRBP,与放疗期间LRBP进行比较分析,现报道如下。
1 资料与方法
1.1 一般资料
收集2011年11月至2018年3月在保定市第一中心医院确诊为ⅡB~ⅢB期且行同步放化疗宫颈癌患者的病历资料。纳入标准:①病理诊断为宫颈鳞状细胞癌,临床分期为ⅡB~ⅢB期;②有完整的血液参数结果;③行同步放化疗;④所有的治疗均在保定市第一中心医院完成。排除标准:①免疫功能障碍(如人类免疫缺陷病毒感染)或免疫功能亢进(如自身免疫性疾病);②血液疾病(如再生障碍性贫血和白血病)和其他致命疾病;③死于宫颈鳞状细胞癌以外的疾病或意外。根据纳入、排除标准,共纳入117例宫颈癌患者,年龄33~38岁,中位年龄54岁;国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期[14]:ⅡB期79例,ⅢA~ⅢB期38例;分化程度:低分化37例,中分化47例,高分化33例。本研究经医院伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2 收集资料
收集患者的临床资料,包括年龄、性别、病理结果(组织学类型、组织学分级)、临床分期及血常规结果,其中血常规结果主要包括白细胞(white blood cell,WBC)、血红蛋白(hemoglobin,HB)、中性粒细胞(neutrophil,N)、单核细胞(monocyte,MO)、嗜酸性粒细胞(eosinophil,EO)、LY。通过回顾电子病历、影像学检查和电话随访获得患者预后信息。最后一次随访时间为2021年3月。无进展生存期(progression-free survival,PFS)为从确诊到疾病进展、死亡或最后一次随访的时间,总生存期(overall survival,OS)为从确诊到死亡或最后一次随访的时间。
1.3 治疗方法
所有的患者均进行盆腔外照射放疗+腔内近距离放疗,接受或不接受辅助化疗。外照射放疗总剂量为45.0~50.4 Gy(每次1.8~2.0 Gy,每周5次,共25~28次)。以顺铂为基础同步放化疗,具体为顺铂每周同步化疗,40 mg/m2,共4~6个疗程。腔内近距离放疗采用二维高剂量率后装,总剂量为24~36 Gy(每次6 Gy,每周1次,共4~6次)。在同步放化疗后,60例患者接受紫杉醇联合铂类化疗,37例患者接受多西他赛联合铂类化疗,余下的20例患者在同步放化疗后未接受任何抗肿瘤治疗。
1.4 观察指标
收集放疗前及放疗期间的血液指标,主要包括WBC、N、HB、MO、EO、LY,计算 NLR,NLR=N/LY。放疗前数据是指患者确诊后,接受任何抗肿瘤治疗之前一周内的血常规结果。
1.5 统计学方法
采用SPSS 26.0软件进行统计分析。计数资料以例数及率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示,组间比较采用Wilcoxon秩和检验;预测价值分析采用受试者工作特征(receiver operating characteristic,ROC)曲线;采用Kaplan-Meier法绘制生存曲线,生存情况的比较采用Log-rank检验;单因素及多因素分析采用Cox比例风险回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 LRBP的比较
对于放疗期间LY最低点出现的时间,4例出现在治疗第1周,6例出现在治疗第2周,24例出现在治疗第3周,26例出现在治疗第4周,52例出现在治疗第5周,5例出现在治疗第6周。放疗前所有患者LY为(1.91±0.80)×109/L,明显高于放疗期间的(0.35±0.13)×109/L,差异有统计学意义(Z=9.388,P<0.01);放疗前所有患者NLR为(2.92±1.40),明显低于放疗期间的(8.86±7.62),差异有统计学意义(Z=-9.102,P<0.01)。
2.2 不同预后患者临床特征的比较
随访时间16~101个月,中位随访时间为84个月,截至随访结束,进展52例,其中Ⅱ期27例(51.9%),Ⅲ期25例(48.1%);死亡29例,其中Ⅱ期14例(48.3%),Ⅲ期15例(51.7%)。进展与未进展宫颈癌患者分化程度、FIGO分期及美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分比较,差异均有统计学意义(P<0.05);死亡与生存宫颈癌患者分化程度、FIGO分期比较,差异均有统计学意义(P<0.05)。(表1)
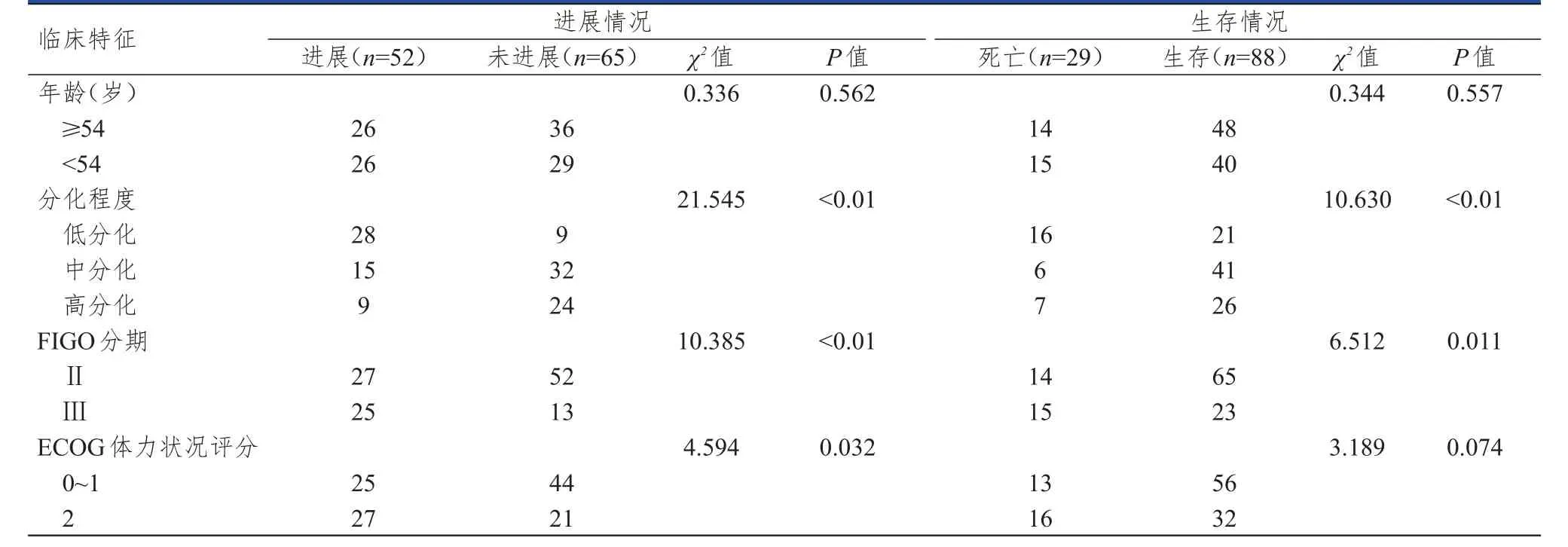
表1 不同预后宫颈癌患者临床特征的比较( n=117)
2.3 放疗期间LRBP对PFS及OS的预测价值
采用ROC曲线分别获得放疗期间LY、NLR预测PFS及OS的最佳截断值。放疗期间LY、NLR预测PFS的最佳截断值分别为0.265×109/L、8.857,LY、NLR预测OS的最佳截断值分别为0.235×109/L、9.151。(表2、表3、图1、图2)
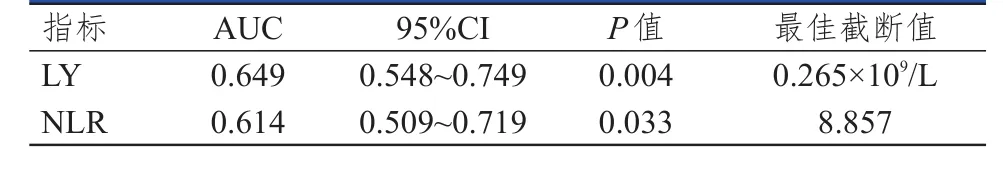
表2 放疗期间LRBP对PFS的预测价值
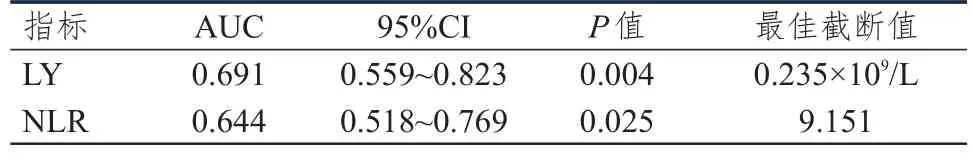
表3 放疗期间LRBP对OS的预测价值
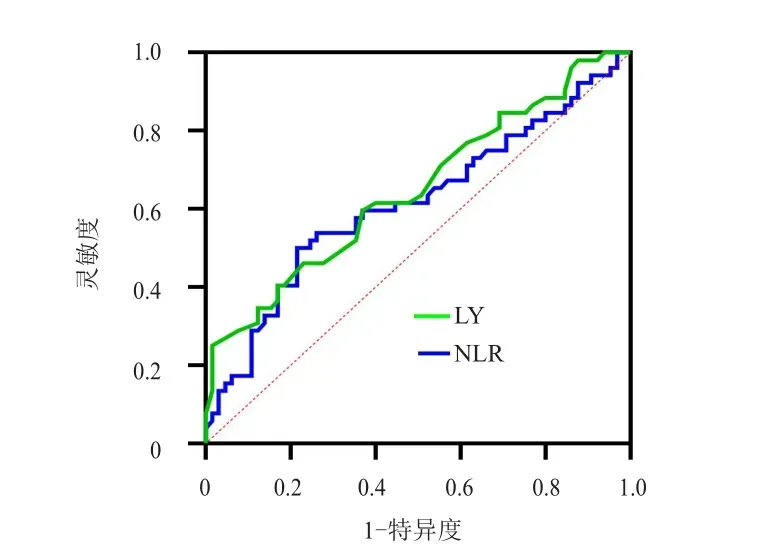
图1 放疗期间LY及NLR预测局部晚期宫颈癌患者PFS的ROC曲线
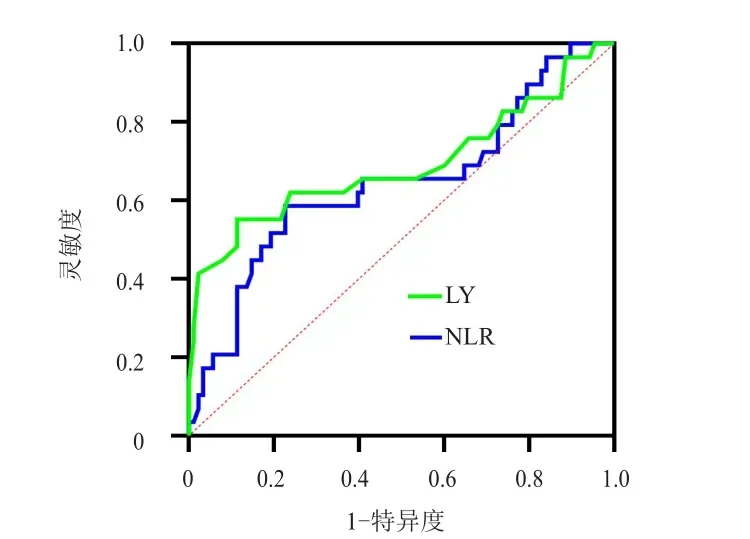
图2 放疗期间LY及NLR预测局部晚期宫颈癌患者OS的ROC曲线
2.4 放疗前LRBP对PFS及OS的预测价值
采用ROC曲线分别获得放疗前LY、NLR预测PFS及OS的最佳截断值。放疗前LY、NLR预测PFS的最佳截断值分别为2.185×109/L、2.590,LY、NLR预测OS的最佳截断值分别为1.435×109/L、3.432。(表4、表5、图3、图4)
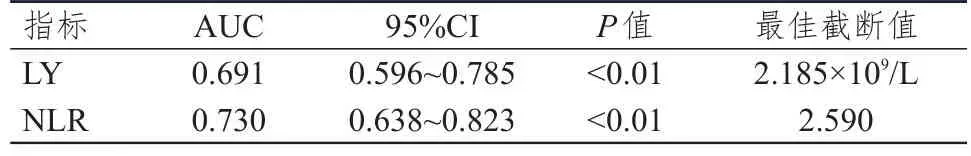
表4 放疗前LRBP对PFS的预测价值

表5 放疗前LRBP对OS的预测价值
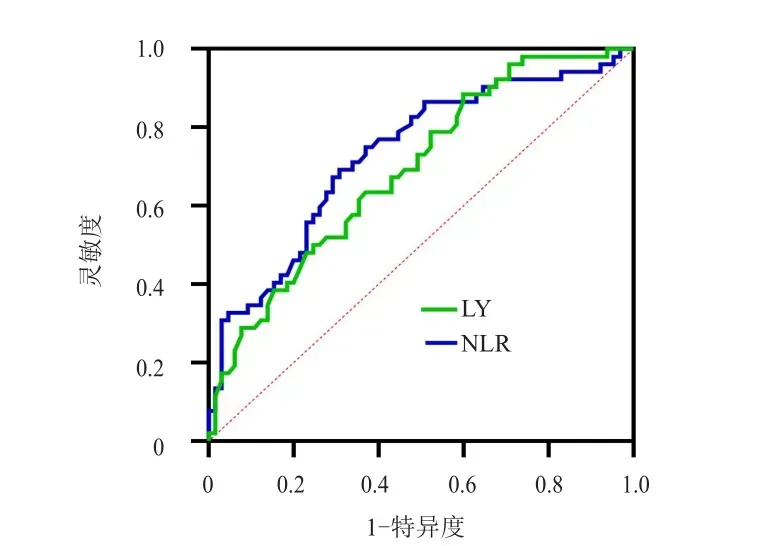
图3 放疗前LY及NLR预测局部晚期宫颈癌患者PFS的ROC曲线
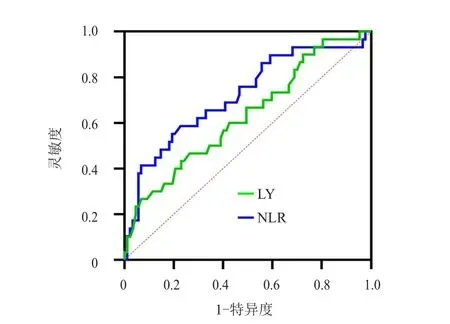
图4 放疗前LY及NLR预测局部晚期宫颈癌患者OS的ROC曲线
2.5 放疗期间PFS及OS的比较
放疗期间LY预测PFS的最佳截断值为0.265×109/L,>0.265×109/L为高LY组,≤0.265×109/L为低LY组,高LY组85例,低LY组32例;NLR预测PFS的最佳截断值为8.857,>8.857为高NLR组,≤8.857为低NLR组,高NLR组52例,低NLR组65例。放疗期间LY预测OS最佳截断值为 0.235×109/L,>0.235×109/L为高LY组,≤0.235×109/L为低LY组,高LY组91例,低LY组26例;NLR预测OS最佳截断值为9.151,>9.151为高NLR组,≤9.151为低NLR组,高NLR组37例,低NLR组80例。放疗期间,高LY组、低NLR组宫颈癌患者PFS及OS均明显优于低LY组、高NLR组患者,差异均有统计学意义(P<0.01)。(图5)

图5 放疗期间不同分组宫颈癌患者的PFS曲线及OS曲线
2.6 放疗前PFS及OS的比较
放疗前LY预测PFS的最佳截断值为2.185×109/L,>2.185×109/L为高LY组,≤2.185×109/L为低LY组,高LY组33例,低LY组84例;NLR预测PFS最佳截断值为2.590,>2.590为高NLR组,≤2.590为低NLR组,高NLR组40例,低NLR组77例。放疗前LY预测OS最佳截断值为1.435×109/L,>1.435×109/L为高LY组,≤1.435×109/L为低LY组,高LY组80例,低LY组37例;NLR预测OS最佳截断值为3.432,>3.432为高NLR组,≤3.432为低NLR组,高NLR组33例,低NLR组84例。放疗前,高LY组、低NLR组宫颈癌患者PFS及OS均明显优于低LY组、高NLR组患者,差异均有统计学意义(P<0.01)。(图6)
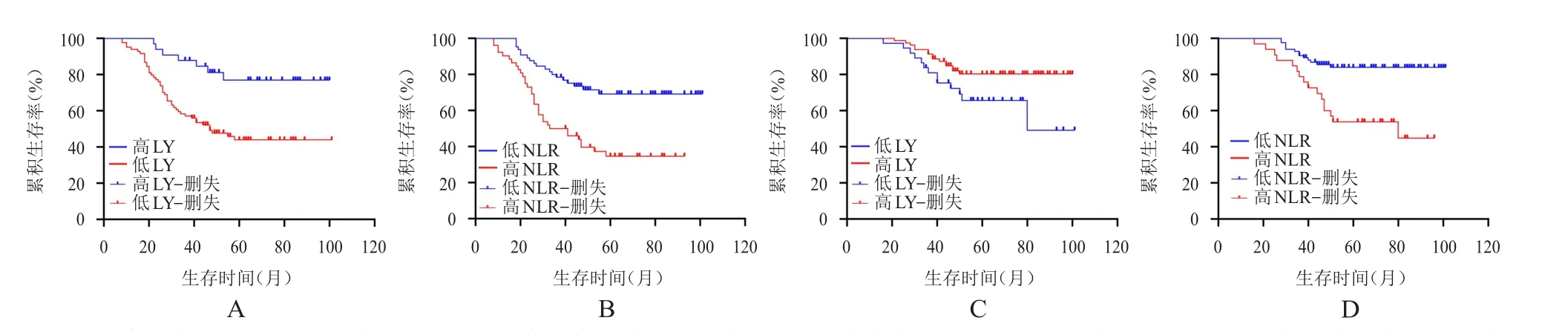
图6 放疗前不同分组宫颈癌患者的PFS曲线及OS曲线
2.7 PFS影响因素的单因素及多因素分析
对放疗期间收集的相关数据进行单因素及多因素分析。将单因素分析中差异有统计学意义(P<0.05)的因素代入多因素Cox比例风险回归模型进行分析。结果显示,高FIGO分期、低分化程度、放疗期间高WBC是PFS的独立危险因素(P<0.05)。放疗期间高LY是宫颈癌患者PFS的保护因素,放疗前高NLR是PFS的危险因素(P<0.05)。(表6)
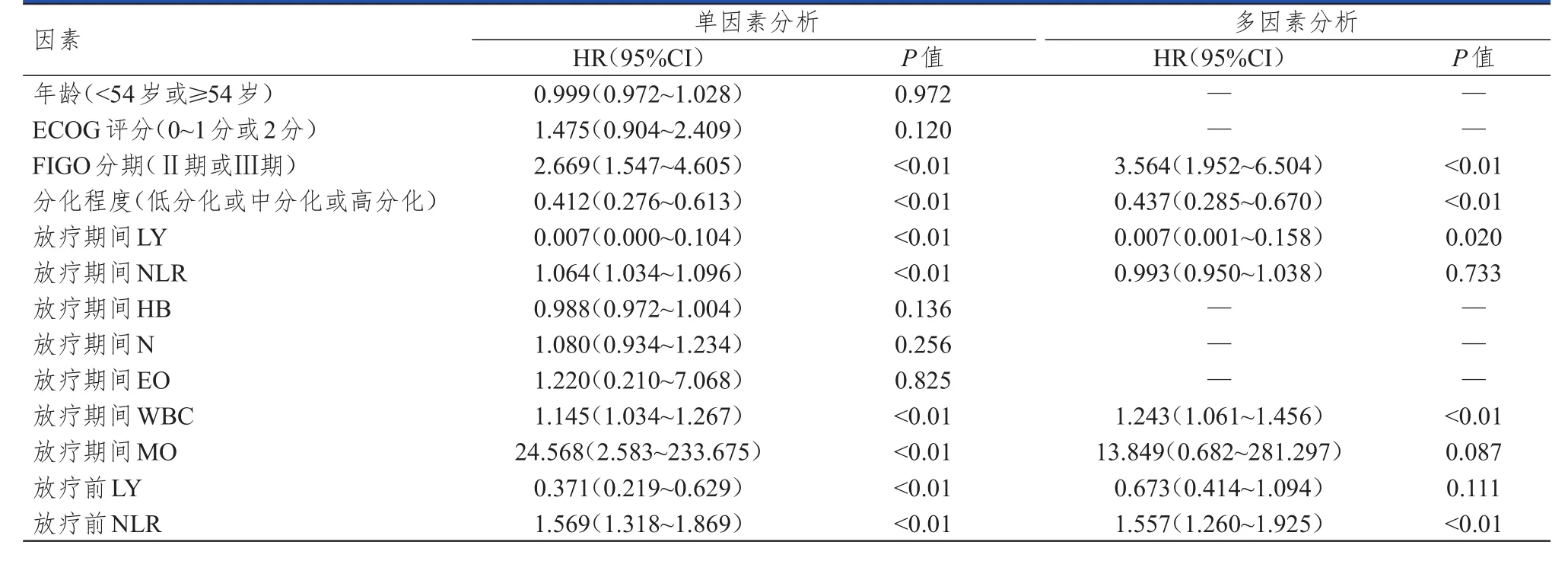
表6 PFS影响因素的单因素及多因素分析
2.8 OS影响因素的单因素及多因素分析
将单因素分析中差异有统计学意义(P<0.05)的因素代入多因素Cox比例风险回归模型进行分析。结果显示,放疗期间高NLR、放疗前高NLR均是OS的危险因素(P<0.05)。(表7)
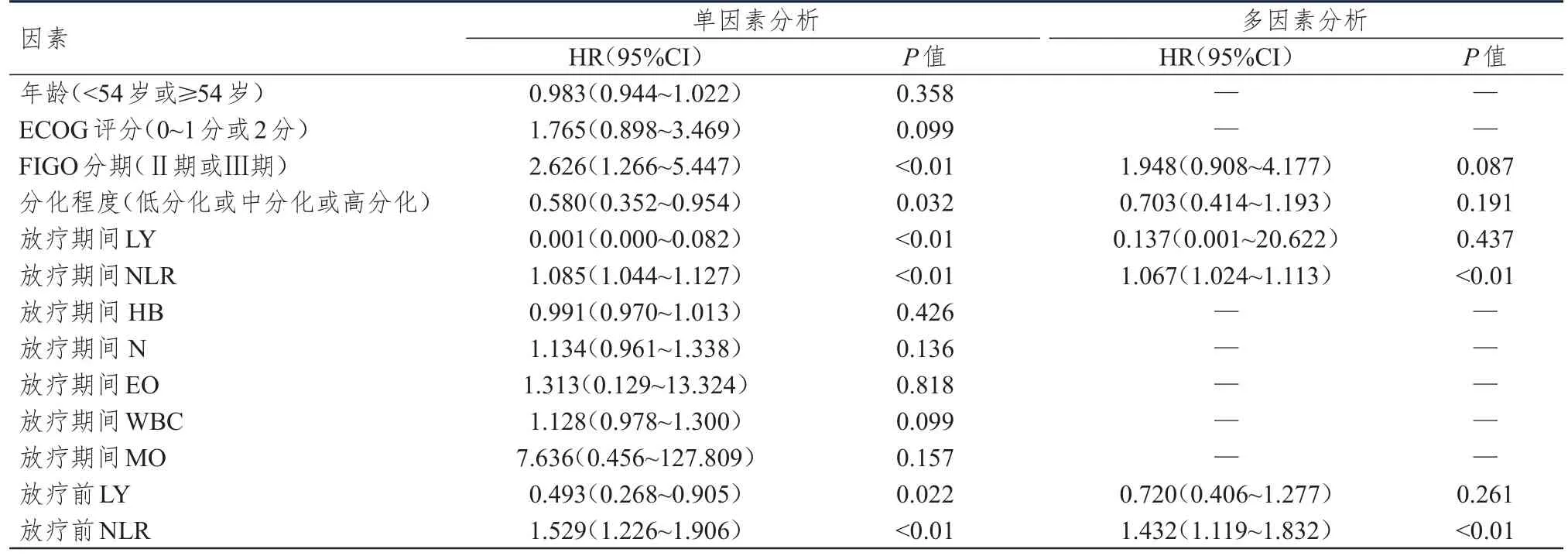
表7 OS影响因素的单因素及多因素分析
3 讨论
本文针对放疗期间LY最低点时LRBP对宫颈癌预后的预测价值进行了回顾性队列研究,同时也收集了放疗前LRBP,与放疗期间LRBP及既往研究进行了对比分析。结果发现,放疗期间高NLR与差的OS有关,放疗期间低LY是PFS的独立危险因素。放疗前高NLR与PFS及OS较差有关。大量研究发现LY、NLR与宫颈癌预后相关,但是目前多集中于治疗前及治疗后,对于放疗期间的研究很少。因此本研究主要研究放疗期间LY最低点时相关参数对宫颈癌患者预后的预测价值。
20世纪50年代提出了免疫监视概念,指出免疫细胞,特别是LY可以识别及清除新生的肿瘤细胞[6]。已经证实高LY与多种恶性肿瘤较好的预后相关,包括宫颈癌[15]。LY影响患者预后的作用机制主要以LY亚群的功能来解释。其中,CD8+T细胞可能通过细胞毒活性抑制肿瘤生长,介导恶性细胞凋亡,CD4+T细胞分泌的细胞因子是CD8+T细胞增殖和生长所必需的,二者协同作用所产生的抗肿瘤效果比单独的两个亚群更强[16-17],而目前强调CD8+T细胞的重要性,并把它作为早期宫颈癌患者术后达到无瘤生存的有意义指标[6]。
什么时间点的LY对肿瘤预后最有预测价值这一问题目前仍存在争议。目前的研究多集中于治疗前、治疗前后LY变化值及复发时的LY对患者预后的预测作用。对于放疗期间LY对宫颈癌患者预后的预测价值还很少涉及。Zhu等[15]研究显示治疗前较低LY与较差的PFS及OS相关。Han等[18]报道了中晚期宫颈癌患者在同步放化疗后,再进行辅助化疗前后外周血LY变化值与患者总生存率相关。Taguchi等[19]研究证实了放疗之后持续的LY减少是宫颈癌患者不良预后的危险因素[20],但是复发时,LY减少并不是OS的独立预测因素。Cho等[21]研究结果表明,在同步放化疗期间严重的LY减少与差的OS相关。在本研究中,放疗期间低LY是PFS的独立危险因素,但不是OS的独立危险因素。这种差异可能与复发前及复发后患者的体内微环境差异有关。
在本研究中,放疗期间及放疗前高NLR与较差的OS有关,放疗前高NLR与较差PFS有关。目前普遍认为高NLR是各种肿瘤的预后预测因素,在宫颈癌中较高的NLR与较差的OS及PFS相关[22-24]。在一项荟萃分析中,报道了治疗前高NLR对宫颈癌不良预后的预测作用[25-26]。Lee等[27]研究了同步放化疗前后NLR变化对中晚期宫颈癌患者预后的预测作用,结果显示治疗前后NLR变化,特别是NLR增加是宫颈癌患者预后的独立危险因素。然而,目前针对放疗期间NLR对宫颈癌预后预测价值的研究较少。在本研究中,证实了放疗期间NLR可能有助于局部晚期宫颈癌患者的预后预测。本研究放疗期间NLR中位数为7.36,比目前已报道的治疗前NLR中位数高(1.90~3.50)[22-24,28-29],比治疗后复发时NLR中位数(4.67)[19]也高。这一发现可以解释为NLR在一定程度上反映了恶性肿瘤持续诱发患者体内的炎症反应,同时说明了放疗会导致LY减少,并可能在放疗期间达到整个病程中的最低值。
本研究样本量较小,且为回顾性研究,具有一定的局限性。首先,患者数量偏少,只有117例,且所有患者均来自同一医院。其次,只对放疗期间的相关指标进行了分析,对于放疗前相关指标,只选择LRBP进行了简单的分析。虽然样本量偏少,但是本研究分析了LY最低点时LRBP对宫颈癌预后的预测价值,因此具有一定的研究意义。本研究发现放疗期间LY最低点时LY、NLR是中晚期宫颈癌患者的预测因子。低LY是PFS的独立危险因素,高NLR是OS的独立危险因素。

