Nomogram图预测乳腺癌患者脑转移的发生风险
——基于SEER数据库△
刘德总,李坤鹏,高娜,方源,刘泽森,范云鹏,杨颖涛#
1郑州大学第五附属医院乳腺外科,郑州 450052
2河南省胸科医院乳腺外科,郑州 450003
全球癌症统计数据表明,乳腺癌仍高居女性肿瘤发病率第一位[1]。4.8%的乳腺癌患者初诊即被确定为Ⅳ期,已发生远处转移[2]。乳腺癌是否发生远处转移取决于乳腺癌的分子亚型,其中人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌患者发生脑神经系统转移的比例为30%~55%[3],三阴性乳腺癌(triple negative breast cancer,TNBC)患者发生脑转移的比例为25%~46%[4-5]。乳腺癌脑转移被认为是远处转移的最后阶段,预后很差[6],而乳腺癌脑转移的概率明显低于骨、肝、肺转移[7]。本研究基于监测、流行病学及预后(Surveillance,Epidemiology,and EndResult;SEER)数据库,分析乳腺癌患者分子亚型、原发部位、组织学分级、病理类型、T分期、N分期等临床特征与乳腺癌脑转移的关系,建立乳腺癌患者脑转移发生风险的Nomogram图预测模型,为乳腺癌临床治疗和脑转移的预测、预防提供循证学依据,现报道如下。
1 资料与方法
1.1 资料收集
本研究是一项回顾性、以人群为基础的队列研究,探讨乳腺癌临床特征与脑转移的特异性差异。数据来自SEER数据库(https://seer.cancer.gov/),包含每例患者的年龄、种族、原发侧、原发部位、组织学分级、病理类型、T分期、N分期、分子亚型、雌激素受体(estrogen receptor,ER)状态、孕激素受体(progesterone receptor,PR)状态、HER2状态、转移情况等信息。分子亚型包括Luminal A型、Luminal B型、HER2+型、TNBC,其中TNBC是指ER、PR及HER2表达均阴性的乳腺癌亚型。原发部位参考《疾病和有关健康问题的国际统计分类第十次修订本》[8]。本研究使用SEERStat软件(version 8.3.6)获取2010—2015年在SEER数据库登记的242 361例经病理检查确诊为浸润性乳腺癌且年龄≥20岁的女性患者的病历资料,排除双侧乳腺癌、男性乳腺癌、经尸检证明是乳腺癌和无生存记录的患者。在开始这项研究之前,向SEER计划提交了一份数据使用协议,并被正式授予访问该数据库的权限。
1.2 统计学方法
采用SAS 9.4统计分析软件进行数据处理与分析,计数资料以例数及率(%)表示,组间比较采用χ2检验;影响因素分析采用多因素Logistic回归分析;根据多因素Logistic回归分析的结果,利用R语言软件(R 4.0.2)的rms程序包建立Nomogram图预测模型,采用Harrell’s C statistic进行一致性指数(C-index)及95%CI的计算,以评估列线图模型的区分度;预测价值分析采用受试者工作特征(receiver operating characteristic,ROC)曲线,并计算曲线下面积(area under the curve,AUC);以P<0.05为差异有统计学意义。
2 结果
2.1 临床特征的比较
本研究纳入2010—2015年SEER数据库中筛选出的242 361例乳腺癌患者,确诊时即发生脑转移的患者635例,脑转移发生率为0.26%。脑转移与非脑转移乳腺癌患者年龄、种族、原发部位、组织学分级、病理类型、T分期、N分期及转移类型比较,差异均有统计学意义(P<0.01);脑转移与非脑转移乳腺癌患者原发侧比较,差异无统计学意义(P>0.05)。(表1)
2.2 不同分子亚型乳腺癌患者脑转移发生情况的比较
不同分子亚型乳腺癌患者中,Luminal A型、Luminal B型、HER2+型、TNBC脑转移发生率分别为0.16%、0.48%、0.76%和0.53%,HER2+型和TNBC患者脑转移发生率较高。不同年龄HER2+型乳腺癌患者脑转移的发生率均最高(P<0.01)。对于有骨转移而无内脏转移的患者[骨(+)肝(-)肺(-)],HER2+型和TNBC患者的脑转移发生率均高于Luminal A型和Luminal B型(P<0.01);若同时合并骨、肝、肺转移[骨(+)肝(+)肺(+)]时,HER2+型和TNBC患者的脑转移发生率更高(P<0.01)。(表2)
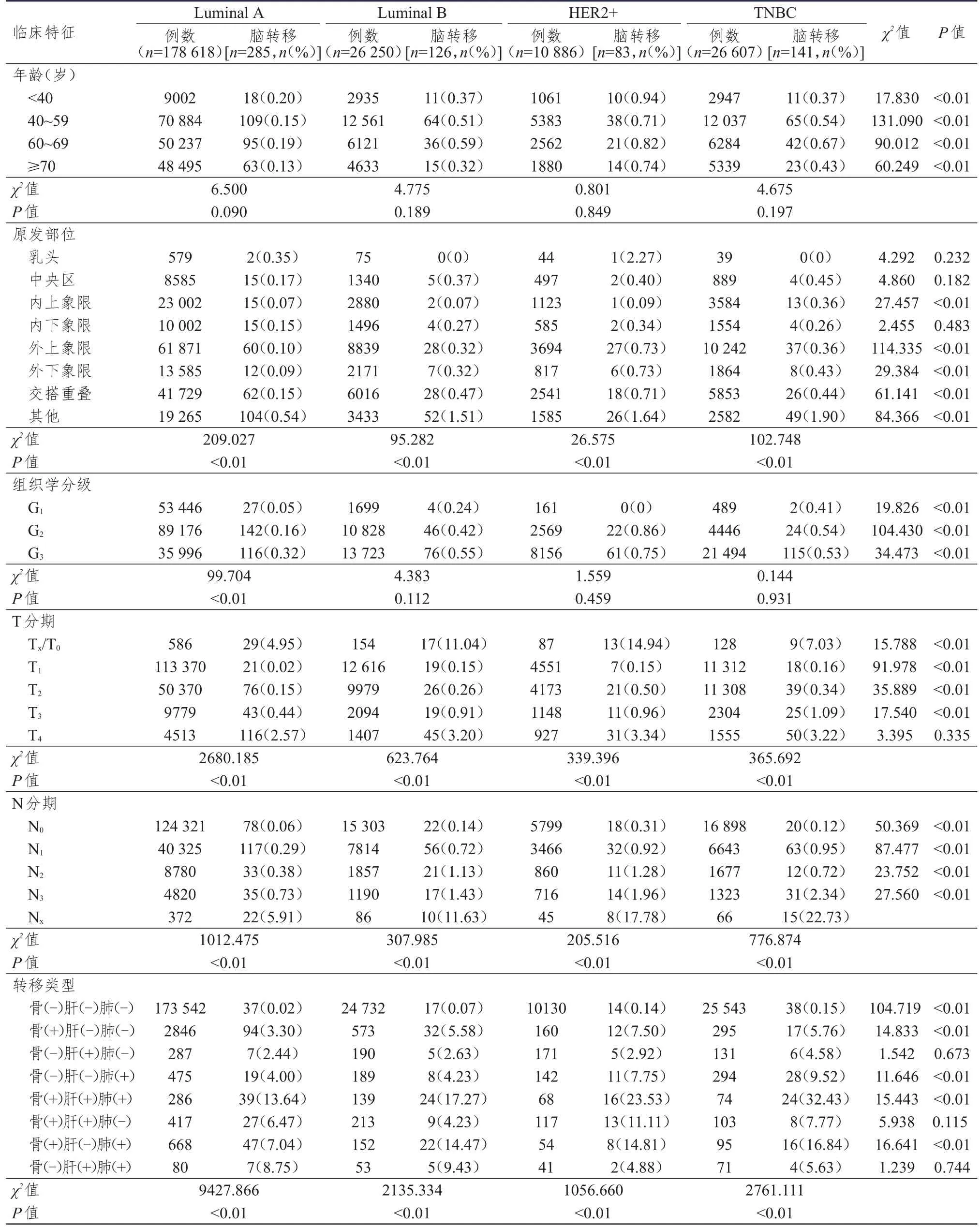
表2 不同分子亚型乳腺癌患者脑转移发生情况的比较
2.3 乳腺癌脑转移的Logistic回归分析
将年龄、种族、组织学分级、分子亚型、转移个数(除脑转移外)、T分期、N分期、病理类型和原发部位作为自变量纳入Logistic回归模型。将单因素分析中差异有统计学意义的因素纳入多因素Logistic回归分析,结果显示,组织学分级G3级、T(Tx/T0、T2、T3、T4)分期、N(N3、Nx)分期、分子亚型(Luminal B、HER2+、TNBC)、转移个数(除脑以外)(1个、2个、3个)和原发部位(中央区、内上象限、外上象限、交搭重叠)均是乳腺癌脑转移的独立危险因素(P<0.05)。(表3)

表3 乳腺癌脑转移影响因素的Logistic回归分析
2.4 预测乳腺癌患者脑转移发生风险的Nomogram图模型的建立及验证
根据多因素Logistic回归分析的结果建立预测乳腺癌患者脑转移发生风险的Nomogram图模型。列线图模型显示:年龄越小、组织学分级越高、T分期越高、TNBC、除脑以外的器官转移个数越多、原发部位为其他,列线图模型的相应评分越高,相对应的脑转移风险上升。对列线图模型的验证显示,预测脑转移发生风险的C-index为0.953(95%CI:0.943~0.962)。应用ROC曲线分析列线图模型预测乳腺癌患者脑转移发生风险的价值,AUC为0.958(95%CI:0.950~0.966)。(图1、图2)

图1 预测乳腺癌患者脑转移发生风险的Nomogram图

图2 Nomogram图模型预测乳腺癌患者脑转移发生风险的ROC曲线
3 讨论
脑转移癌是一种常见的中枢神经系统肿瘤,其发病率高于原发中枢神经系统肿瘤,乳腺癌是脑转移的第三大原因[9-10]。与早期乳腺癌相似,乳腺癌脑转移也是一种高度异质性的疾病,血-脑脊液屏障的存在极大地削弱了大部分化疗药物对脑肿瘤细胞的杀伤作用,使脑转移患者的预后极差。乳腺癌脑转移患者的基础与临床治疗,一直是困扰临床医师的难题,本研究为更好地理解乳腺癌的异质性提供了深入的见解。
Gong等[2]、赵晨宇等[7]的研究表明,乳腺癌患者远处器官转移发生率从高到低依次为骨转移、肺转移、肝转移和脑转移,脑转移的发生率偏低。本研究纳入的242 361例乳腺癌患者中,确诊时有635例发生脑转移或合并脑转移,脑转移的发生率为0.26%,低于Xiong等[11]乳腺癌脑转移发生率为0.35%(789/225 636)的研究结论,进一步分析两项研究的差异发现,原因可能是本研究纳入的患者是≥20岁的患者,而Xiong等[11]研究纳入的是≥18岁的患者。根据既往Hung等[12]的研究发现,≤35岁患者脑转移的发生率明显高于36~59岁、≥60岁患者。而本研究发现,相比年龄<40岁的患者,年龄40~59岁、60~69岁、≥70岁的患者具有更高的脑转移发生率。与T分期较低的患者相比,T4期的乳腺癌患者脑转移发生率最高(38.11%)。Xiong等[11]、Kim等[13]的研究也得出了相似的结论。与组织学分级较低的患者相比,组织学分级G3级的乳腺癌患者脑转移发生率最高(57.95%),这也与临床相符。N1期的患者脑转移发生率最高,这与既往的研究结论不一致,可能是因为本研究N1期脑转移患者较多(268/635),需要样本量大的队列研究加以验证。肿瘤所在的位置不同,脑转移的发生率也不同。肿瘤位置在“其他”部位时,脑转移的发生率最高(36.38%)。回顾文献,按照《疾病和有关健康问题的国际统计分类第十次修订本》乳腺癌患者原发部位分层可知,“其他”主要包括副乳腺,既往的报道显示,副乳腺癌患者临床分期多为Ⅲ~Ⅳ期,腋窝淋巴结转移个数多,组织学分级多为G3级,复发转移率更高,且肿瘤组织中HER2阳性表达的程度更高,预后更差[14-18],原因可能是:①副乳腺部位特殊,容易被误认为是肿大的腋窝淋巴结,易误诊、漏诊,耽误诊疗,导致就诊时分期较晚;②副乳腺区淋巴结丰富,容易较早发生淋巴结转移和扩散,预后差;③临床诊疗经验不足,治疗方案制订不合理,预后差。本研究这一结论也是以往的研究中极少提到的,可能对副乳腺癌预后差以及临床的治疗与研究提供更多的依据和思路。其次,肿瘤在外上象限的患者脑转移发生率也较高(23.94%)。
不同分子亚型乳腺癌患者中脑转移发生率由高到低依次是HER2+型(0.76%)、TNBC(0.53%)、Luminal B型(0.48%)、Luminal A型(0.16%)。虽然患者年龄不同,但HER2+型患者更容易发生脑转移,与Kim等[13]的研究结论一致。抗HER2靶向治疗延长了乳腺癌患者的生存期,提高了颅外病灶的控制率,但靶向药物不能透过血-脑脊液屏障,使中枢神经系统成为肿瘤细胞的聚集地,这是导致HER2阳性乳腺癌患者中枢神经系统转移率明显增高的原因之一[19]。本研究结果表明,当患者同时合并骨、肺、肝转移时,TNBC患者脑转移的发生率最高,这也与既往的研究[13]结论一致,从临床治疗角度分析,此类患者属于晚期合并多发转移,往往治疗效果差,疾病进一步进展,继而发生脑转移,影响患者预后和生活质量。
既往不同的研究表明,影响乳腺癌转移的危险因素是多方面、特异的,年龄、种族、肿瘤大小、病理类型、组织学分级、原发侧、T分期、N分期、分子亚型、淋巴结转移个数、受体状态均是影响因素,不同器官(骨、肝、肺、脑等)发生转移的影响因素也是不同的[7,13,20-21]。本研究表明,组织学分级、T分期、N分期、分子亚型、转移个数(除脑以外)、原发部位均是影响脑转移的独立危险因素。根据列线图预测模型发现,年龄越小、组织学分级越高、T分期越高、TNBC、除脑以外的器官转移个数越多、原发部位为其他时,列线图模型的相应评分越高,相对应的脑转移风险上升;HER2+型和TNBC患者脑转移的风险明显增加。赵晨宇等[7]的研究表明,年龄、T分期、N分期是脑转移的独立影响因素。Kim等[13]进行了以分子亚型为基础的乳腺癌脑转移患者临床特征的分析,结果显示,除脑以外转移器官的数量多、组织学分级高、高T分期、高N分期、HER2+或TNBC均是脑转移的独立危险因素,HER2+和TNBC患者脑转移的风险明显增加。
HER2状态已被报道与脑转移密切相关,HER2+乳腺癌与脑组织有潜在的亲和性[22],HER2过表达促进了脑内转移性乳腺癌细胞的生长[23]。一般认为,脑转移癌患者的血脑屏障被破坏,但HER2+和TNBC患者发生脑转移的进展是否相同,一项研究回顾性地对葡萄糖转运蛋白1和乳腺癌抵抗蛋白进行免疫组化染色,以评估脑转移后血脑屏障的状态,结果显示:TNBC或基底型乳腺癌患者的脑转移常破坏血脑屏障,而HER2+乳腺癌患者的脑转移则倾向于保留血脑屏障[24]。研究认为,HER2+乳腺癌和TNBC的脑转移进展可能在血脑屏障的保存或破坏方面有所不同,血脑屏障的破坏可能使TNBC和基底型乳腺癌的脑转移发展更具攻击性,导致TNBC患者比非TNBC患者更容易发生远处转移,更早发生脑转移,总生存期更短[25]。
本研究不仅探讨了乳腺癌患者临床特征与脑转移的关系,也开发了一种预测乳腺癌患者脑转移的工具——Nomogram图预测模型。Nomogram图是一种可视化特定事件风险的多功能工具,它可以帮助医师解释预后数据和对临床试验患者进行分层。本研究中,根据多因素Logistic回归分析结果建立了预测乳腺癌患者脑转移发生风险的Nomogram图预测模型,比如:某白人(得分6分)患者年龄40岁(得分10分),分子亚型为TNBC(得分14分),组织学分级为G3级(得分11分),T3期(得分40分),N3期(得分22.5分),除脑以外有3处转移(得分100分),Nomogram模型的总分为6+10+14+11+40+22.5+100=203.5分,对应的脑转移发生风险为0.2,即该白人患者有20%的风险发生脑转移,临床治疗和随访中,应注意预防发生脑转移。采用C-index和ROC曲线对模型进行验证,结果表明模型具有很好的区分度和准确度,该模型具有很好的临床推广和应用价值。
既往Nomogram图预测模型也被应用在乳腺癌研究的其他方面。Lin等[26]的研究表明,Nomogram图乳腺癌肝转移诊断模型是一种可靠的、强大的乳腺癌肝转移诊断预测工具(训练集和验证集的ROC曲线的AUC分别为0.6602和0.6511),根据Nomogram模型,在肿瘤内科医师和外科医师的合作下,可以更好地选择医学检查和优化治疗方案。Ye等[27]建立了基于临床病理参数的列线图模型,列线图的 AUC 为 0.735(95%CI:0.692~0.777),预测效果良好,可以准确预测区域淋巴结的术前状态,这种列线图有助于术前评估淋巴结状态,从而帮助患者进行治疗决策。
Nomogram图预测模型也可以用来预测乳腺癌患者的预后。Xiong等[11]的研究表明,Nomogram图模型在预测乳腺癌特异性生存时间(breast cancer specific survival,BCSS)方面的性能优于预测乳腺癌总生存时间(overall survival,OS)的性能(C-index:0.676vs0.668)。Marko等[28]的研究表明,在乳腺癌脑转移患者中,Nomogram生存预测策略优于现有的生存预测策略,原因可能是列线图比传统的TNM分期系统包含更多的预后变量[29]。Wang等[30]的研究首次使用中国数据库开发和外部验证Nomogram图模型预测非转移性乳腺癌患者无远处转移生存时间(no-distant transfer survival time,DMFS)的能力,结果表明,Nomogram图预测模型可以提供非转移性乳腺癌患者5年DMFS的个体预测(C-index为0.75),可以帮助临床医师制订适当的治疗方案和最佳的监测计划。
虽然在乳腺癌脑转移方面已经有了认识和进展,但需要探索的空间仍非常大;乳腺癌分子亚型、原发部位等临床特征可以帮助识别特定转移部位风险增加的患者;Nomogram图预测模型在乳腺癌诊疗领域的优势可以进一步研究与验证开发,形成统一的标准和系统,将更有益于乳腺癌的临床诊疗,改善患者预后;基于分子亚型的位点特异性转移的风险评估,在个体化医学时代可以发挥重要作用,有必要在这一领域共同努力取得更大的进展;在以后的诊疗、检查或随访时,还应考虑原发部位对脑转移的影响。但这项研究有一定的局限性,由于分子亚型是基于激素受体状态和HER2状态,没有纳入其他标志物,如Ki-67,而Ki-67是区分Luminal A型和Luminal B型的重要指标,这可能导致研究与临床应用之间存在一些差异。

