不同支持物及培养条件对幽门螺杆菌生物膜形成的影响
幽门螺杆菌(Helicobacter pylori,
)是一种螺旋状、微嗜氧、革兰氏阴性杆菌,具有鞭毛,主要寄生于人体胃内
。
可导致急、慢性胃炎,消化性溃疡,胃癌等多种消化道疾病,并且与多种胃外疾病相关。
感染了世界50%以上的人口
,我国成人中
感染率为40%~60%
。
胃炎京都全球共识
中指出,
阳性患者个体是传播的主要宿主,
感染者无制衡因素,均应该根除
。
对抗生素耐药是导致根除治疗失败的主要原因,而生物膜结构的形成是
获得非特异性耐药重要原因
。2006年,Carron等
在内镜及扫描电子显微镜第一次报道在人类的胃黏膜上可以形成
生物膜。
形成生物膜后比浮游细菌具有更强的生存优势,能够逃脱人体的免疫系统,且由于其物理屏障,导致抗生素无法穿透生物膜结构,从而保护膜内细菌。且生物膜内细菌可能由于其营养条件差,增加其突变的可能
。
生物膜内的细菌对抗生素的耐受作用与浮游状态相比高达1 000倍
。因此,干预
生物膜的行程成为解决其对抗生素耐药的出路之一。由于
在胃内多为局灶分布,且动物实验个体较小,定植数量少难以评价其生物膜形态,因而体外环境下生物膜模型的建立更有利于实验工作的开展。本研究通过观察不同培养方式、不同载体条件下
生物膜形态,以探讨更适宜的生物膜体外模型建立方法,为解决临床
耐药提供实验方法。
从表13的“假设方差相等”行读取数值,t值是8.9590,Sig.(双侧)是双尾T检验的显著性概率0.0001,远小于0.05。可以得出结论:高低侧裂缝严重程度有显著差异,表现为较低一侧的裂缝面积大于较高一侧,究其原因,主要是由于向心力,较低一侧的路面所受的荷载作用力更大,路面某点的荷载作用持续时间相对更长(车辆通过弯道的时间一定,而较低侧的路程更短),而沥青混合料是一种黏弹性材料,在持续荷载作用下易产生塑性变形,久而久之产生裂缝。
1 材料与方法
1.1.1 菌株:
SS1菌株由北京大学第一医院消化内科提供,-80 ℃冰箱保存。
1.1.2 试剂:哥伦比亚血琼脂(英国OXOID公司),脑心脊液(英国OXOID公司),脱纤维羊血(北京宝特英昊科技有限公司),布鲁氏肉汤(美国BD Difco/BBL公司),胎牛血清(FBS)(以色列BI公司),磷酸盐缓冲液(PBS)(以色列BI公司),4%戊二醛固定液(北京雷根生物技术有限公司),无水乙醇(生工生物工程股份有限公司,上海),氯化钠注射液(石家庄四药有限公司),0.2 μm硝酸纤维素膜(NC膜)(美国通用医疗公司,GE);甘油(北京索莱宝科技有限公司),直径15 mm的圆形玻片(无锡耐思生物科技有限公司,NEST)。
图1~2中
SS1为液体培养条件下培养,形态:
SS1成膜形态更为立体,可清晰地看到其鞭毛结构,但其密度较差,生长状态一般;成膜率:液体培养过程中,由于生物膜多分布于气液平面,体外培养时,其成膜率较低。
1.1.3 仪器:压力蒸汽消毒柜(中国上海博讯实业有限公司),洁净工作台(中国上海博讯实业有限公司),厌氧罐2.5 L(英国OXOID公司),隔水式培养箱(上海一恒科学仪器有限公司),10 μl接种环(山东巴罗克生物科技股份有限公司),1 μl接种环(北京普利智诚生物技术有限公司),细菌浊度仪(麦氏浊度计)(北京中慧天成科技有限公司),JSM-7900F热场发射扫描电子显微镜(日本捷欧路公司)。
1.2.1 菌株复苏、培养及冻存:将
SS1冻存管解冻后取100 μl,使用L棒将菌液均匀涂抹于含质量浓度为80 g/L脱纤维羊血的哥伦比亚血琼脂固体培养基上,于37 ℃微需氧环境下(15% CO
、5% O
、80% NO
)培养72 h,阳性者继续传代培养;将复苏阳性的
SS1使用无菌接种环传至固体培养基上,于上述环境中培养48~72 h;将生长状态良好的
SS1 2~4代使用无菌接种环研磨至冻存液,-80 ℃保存。
1.2.2 构建
生物膜:(1)液体培养及玻片载体:以圆形玻片为载体,将无菌直径15 mm的圆形玻片置于24孔板中,每孔中以500 μl含质量浓度为100 g/L胎牛血清的布鲁氏肉汤作为培养基,加入5 μl预培养的浓度为3×10
cfu/ml的
SS1,24孔板于37 ℃、5% O
、10% CO
、85% N
微需氧环境中振荡培养72 h。(2)固体培养及NC膜载体:以NC膜为载体,将约(1×1) cm
无菌NC膜上置于含质量浓度为80 g/L脱纤维羊血的哥伦比亚血琼脂固体培养基上,将10 μl预培养的浓度为3×10
cfu/ml
SS1均匀涂抹至NC膜上,将琼脂平板置于37 ℃、5% O
、10% CO
、85% N
的微氧环境中培养72 h。
2016年4月,习近平总书记提出:人类是劳动创造的,社会是劳动创造的,劳动没有高低贵贱之分。但同样的劳动者在退休后,退休待遇却相差甚远,有调查数据显示:同样为30年工龄公务员平均退休工资7000元左右,而同一地区的同样工龄的企业人员退休工资2600元左右,退休工资悬殊巨大。有研究指出,我国公务员养老金替代率高达80%~100%,而企业员工的养老金替代率为仅为40%左右。
1.2.3 扫描电镜:采用扫描电子显微镜观察
SS1生物膜模型。样本以无菌PBS冲洗3次后置于4 ℃、2.5%戊二醛中固定2 h,再次使用无菌PBS轻轻冲洗3次。玻片载体的生物膜采用乙醇梯度脱水处理(25%、50%、75%、95%、100%),NC膜载体的生物膜采用空气干燥的方法,样本干燥后,喷金,扫描电镜观察。
2 结果
讲评时,我采用“兵教兵”与“师教兵”相结合的方式,对于错误率低的题目,由平台随机挑选答对的学生进行讲评,而对于错误率高的题目,由我讲评,进行究因和纠错。讲评完后,我再推送“预习检测”答案解析,让学生深化理解,对于仍不明白的学生可在“提问区”进行提问,课后对提问的学生再给予指导。
2017年6月26日,苏州某地铁线路部分列车在ATO模式下,出现司机界面显示时间不正确,以及在站台停站时间过短的现象。
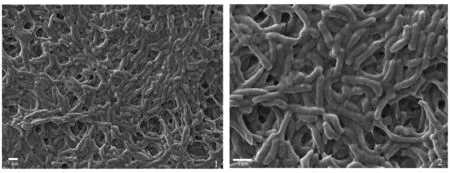
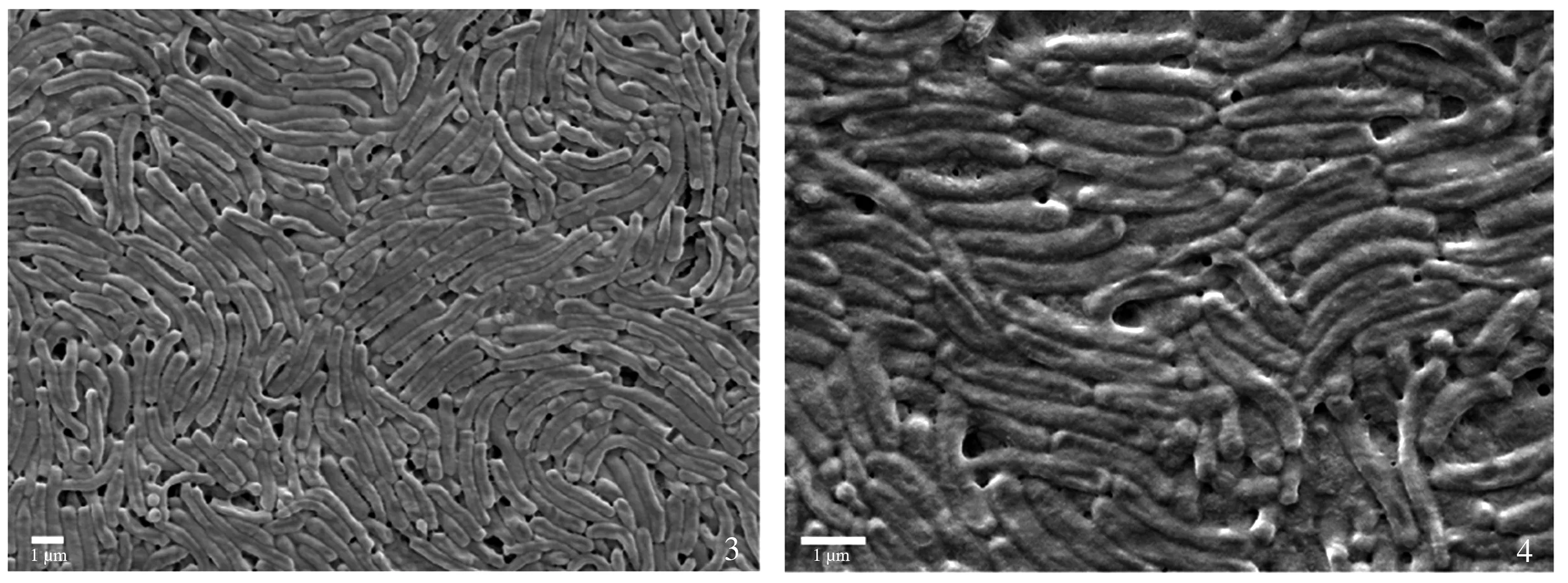
图3~4中
SS1为固体培养条件下培养,形态:
SS1形态较扁平,但生长状态良好,同样可见其鞭毛结构;成膜率:固体培养过程中,由于
直接接种于NC膜上,生物膜形成于NC膜上,其成膜率较高。
3 讨论
生物膜是一种由存活及凋亡的细菌组成的基质结构,覆盖细菌外的聚合物质有多糖、脂类、核酸和蛋白质等
。细菌生物膜形成包括以下5个环节
:(1)细菌在鞭毛运动下附着、到达表面并粘附;(2)形成覆盖细菌外的聚合物质(多糖、脂类、核酸和蛋白质);(3)形成早期生物膜结构;(4)形成成熟的生物膜结构;(5)单个细菌从生物膜脱离,处于浮游状态,扩散。细菌生物膜结构的形成会导致临床多种疾病,主要分为以下3种类型
:(1)植入式医疗器械相关生物膜疾病,如留置导尿管引发尿路感染等;(2)体内慢性生物膜疾病,如
感染;(3)细菌形成生物膜导致植入医疗器械发生故障,如假体关节失效等。细菌形成生物膜后,大大增加患者的死亡率、发病率,并导致巨大的经济损失。在临床诊疗中,抗生素治疗通过杀死体内的浮游细菌控制感染,但往往不能根除体内的生物膜细菌
。当抗菌治疗停止时,生物膜内细菌常常再次引发感染导致治疗失败。体外构建
生物膜模型利于进一步研究临床药物对
生物膜结构的破坏作用,从而指导临床用药,降低临床抗生素的耐药率,减轻患者负担。
本研究通过液体、固体培养的方法,以圆形玻片、NC膜为载体,详细介绍了
体外造模方法,并从形态及成膜率两方面介绍区别。实验结果发现,固定培养时选用NC膜为载体,成膜率远远高于液体培养时以圆形玻片为载体,因此,实验中无特殊要求时更推荐固体培养。但在操作过程中要注意以下几点:(1)圆形玻片、NC膜要注意灭菌后使用;(2)NC膜置于含质量浓度为80 g/L脱纤维羊血的哥伦比亚血琼脂固体培养基上时,培养基应未冷却凝固,保证NC膜可吸收含质量浓度为80 g/L脱纤维羊血的哥伦比亚血琼脂液体;(3)PBS冲洗培育成功的生物膜时要轻轻冲洗,以防冲毁生物膜,导致实验失败;(4)接种的菌液浓度为3×10
cfu/ml,不可过浓,否则
营养不足导致生长状态差;(5)NC膜载体的生物膜采用空气干燥的方法,不可使用乙醇梯度脱水的方法,NC膜置于乙醇中会发生皱缩,导致样本被破坏。本文通过介绍不同支持物及条件下
生物膜造模方法,为体外研究
生物膜提供方法依据。
[1]Kusters JG, van Vliet AHM, Kuipers EJ. Pathogenesis of Helicobacter pylori infection [J]. Clin Microbiol Rev, 2006, 19(3): 449-490. DOI: 10.1128/CMR.00054-05.
[2]Hooi JKY, Lai WY, Ng WK, et al. Global prevalence of Helicobacter pylori infection: systematic review and Meta-analysis [J]. Gastroenterology, 2017, 153(2): 420-429. DOI: 10.1053/j.gastro.2017.04.022.
[3]张万岱, 胡伏莲, 萧树东, 等. 中国自然人群幽门螺杆菌感染的流行病学调查[J]. 现代消化及介入诊疗, 2010, 15(5): 265-270. DOI: 10.3969/j.issn.1672-2159.2010.05.001.
Zhang WD, Hu FL, Xiao SD, et al. Prevalence of Helicobacter pylori infection in China [J]. Modern Digestion & Intervention, 2010, 15(5): 265-270. DOI: 10.3969/j.issn.1672-2159.2010.05.001.
[4]Sugano K, Tack J, Kuipers EJ, et al. Kyoto global consensus report on Helicobacter pylori gastritis [J]. Gut, 2015, 64(9): 1353-1367. DOI: 10.1136/gutjnl-2015-309252.
[5]Munita JM, Arias CA. Mechanisms of antibiotic resistance [J]. Microbiol Spectrum, 2016, 4(2): VMBF-0016-2015. DOI: 10.1128/microbiolspec.VMBF-0016-2015.
[6]Carron MA, Tran VR, Sugawa C, et al. Identification of Helicobacter pylori biofilms in human gastric mucosa [J]. J Gastrointest Surg, 2006, 10(5): 712-717. DOI: 10.1016/j.gassur.2005.10.019.
[7]Hathroubi S, Servetas SL, Windham I, et al. Helicobacter pylori biofilm formation and its potential role in pathogenesis [J]. Microbiol Mol Biol Rev, 2018, 82(2): e00001-18. DOI: 10.1128/MMBR.00001-18.
[8]Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms [J]. Lancet, 2001, 358(9276): 135-138. DOI: 10.1016/s0140-6736(01)05321-1.
[9]Yonezawa H, Osaki T, Kamiya S. Biofilm formation by Helicobacter pylori and its involvement for antibiotic resistance [J]. Biomed Res Int, 2015, 2015: 914791. DOI: 10.1155/2015/914791.
[10]da Silva DP, Schofield MC, Parsek MR, et al. An update on the sociomicrobiology of quorum sensing in gram-negative biofilm development [J]. Pathogens, 2017, 6(4): 51. DOI: 10.3390/pathogens6040051.
[11]Del Pozo JL. Biofilm-related disease [J]. Expert Rev Anti Infect Ther, 2018, 16(1): 51-65. DOI: 10.1080/14787210.2018.1417036.
[12]Del Pozo JL, Patel R. Are antibiotics and surgery sufficient to treat biofilm-associated infections? [J]. Enferm Infecc Microbiol Clin, 2013, 31(10): 641-642. DOI: 10.1016/j.eimc.2013.10.001.

