枯草芽孢杆菌生物膜生长条件的优化
潘晓鸿,洪纤纤,方 云,饶文华,陈芳容,聂丹玥,郭雪萍,张顶洋,关 雄
(福建农林大学闽台作物有害生物生态防控国家重点实验室/生物农药与化学生物学教育部重点实验室,福建 福州 350002)
枯草芽孢杆菌(Bacillussubtilis)是一种广泛分布于自然环境中的革兰氏阳性杆状细菌,具有形成快、营养简单的特点.其菌制剂由于容易生产、保存时间较长且田间使用方便,已成为应用最为广泛的生物农药之一[1],主要用于防治大多数丝状真菌引起的田间病害,如棉花枯萎病、荔枝霜疫病等[2].生物膜是指细菌通过分泌多糖、蛋白质等大分子物质以连结细菌群体而形成的具有黏附性有组织的膜状结构[3-6].生物膜能将细胞与细胞紧密连结起来,提高彼此之间的基因转移与交换频率,从而增强其环境适应能力,增加种群多样性[7],最终使其发挥正常的生防和促生作用.枯草芽孢杆菌在农田中通常以生物膜形式定殖于植物根系[8],这种特征可以保护植物根系免受其他病原物侵害,使根系上的细胞群体数量保持在较高水平,从而分泌较高浓度的抗生素和胞外酶;同时有利于细菌自身抵御外界不良环境,保持其生防能力.枯草芽孢杆菌生物膜形成能力越强,防治植物病害效果越显著[1].因此,研究生物膜的形成能力及形成条件将有助于今后生防细菌的遗传改良研究及合理使用.
当前学者们主要针对金黄色葡萄球菌(Staphylococcusaureus)[9]、大肠杆菌(Escherichiacoli)[10]、单增李斯特菌(Listeriamonocytogene)[11]的生物膜进行了研究,而有关产孢菌类生物膜的研究较少,枯草芽孢杆菌生物膜形成条件的优化研究则更少.李南薇等[12]利用平板菌落计数法针对蜡样芽孢杆菌(B.cereus)生物膜培养温度、pH值、培养基浓度、碳源、无机盐5个因素进行了优化;吴园园等[13]采用比浊法对枯草芽孢杆菌NCD-2生物膜培养基种类、温度、金属离子进行了优化;马悦等[14]结合上述两种方法探究了蜡样芽孢杆菌生物膜的形成条件.本研究以结晶紫染色法和烘干称重法相结合对枯草芽孢杆菌液体生物膜形成能力进行评估,同时对其培养基成分[葡萄糖、镁离子(Mg2+)、钙离子(Ca2+)浓度]和培养环境(pH值、温度)进行筛选,并通过L16(45)正交试验进行优化,为进一步合理利用枯草芽孢杆菌生物膜和研究该菌的生防机理奠定基础.
1 材料与方法
1.1 材料
1.1.1 供试菌株和培养基 枯草芽孢杆菌菌株BS-2,由福建农林大学生物农药与化学生物学教育部重点实验室保存.液体LB培养基:1%氯化钠,1%胰蛋白胨,0.5%酵母粉,调节pH值为7.2,高压灭菌.固定LB培养基:称取2.5 g琼脂粉缓慢倒入100 mL LB液体培养基中,高压灭菌.
1.1.2 试剂 Mg2+、Ca2+母液:称量适量的氯化镁、氯化钙,在水溶液中配制成浓度分别为 0.01、0.1、1、10、20、30 mmol·L-1的母液,高压灭菌.
葡萄糖母液:称取适量的葡萄糖,在水溶液中配制浓度为2、4、6、8、10、12 g·L-1的葡萄糖溶液,用超滤膜过滤.
1.2 生物膜形成能力的评估方法
1.2.1 菌液的制备 将-80 ℃保藏的BS-2菌株按1%接种到1.5 mL的LB培养基中,37 ℃、150 r·min-1隔夜培养后,将该菌液均匀地涂于平板活化,一段时间后挑取单菌落于试管LB中.待试管内溶液变浑浊,将菌液再次转接到LB培养基中,进行扩大培养,使菌液D600 nm≈2.8(约10 h)[15],用于后续试验.
1.2.2 96孔板染色法 按1%转接量将菌液接种到具有不同培养条件的LB液体培养基中,逐一分装入96孔板,每孔为180 μL,重复3次.培养结束后慢慢拿出平板,在每孔内加入200 μL 0.1%结晶紫染色液进行染色,将菌液充分甩干后轻柔地冲洗3次,再加入200 μL 95%乙醇,静置若干分钟后混匀[13].使用酶标仪测定其D595 nm值,以此判断生物膜的形成能力.
1.2.3 观察法 按1%转接量将菌液接种到装有新鲜LB液体培养基的锥形瓶中,每个处理设置3个重复.静置培养1 d后,观察锥形瓶内生物膜形成厚度,拍照记录.
1.2.4 烘干称重法 标记并称量锥形瓶净重,在不同试验条件下培养生物膜后,使用移液枪除去培养基,保留生物膜,并放入64 ℃干燥烘箱中烘干24 h,称量含有生物膜干物质的锥形瓶质量并计算前后之差,每个处理设置3个重复.根据生物膜烘干质量绝对值大小,确定最佳的培养条件.
1.3 影响生物膜形成的单因素试验
将培养温度分别调节为25、30、35、40、45 ℃,比较温度对生物膜形成的影响.用pH计调节液体培养基初始pH值至5.0、6.0、7.0、8.0、9.0,比较pH值对生物膜形成的影响.将培养基中Mg2+和Ca2+浓度分别调节为0.01、0.1、1、10、20 mmol·L-1,比较Mg2+和Ca2+浓度对生物膜形成的影响[13].在LB液体培养基中分别加入除菌过滤后的葡萄糖溶液,使其浓度为2、4、6、8、10、12 g·L-1,比较葡萄糖浓度对生物膜形成的影响.
1.4 正交试验设计
根据单因素试验的结果,设计葡萄糖浓度(A)、Mg2+浓度(B)、Ca2+浓度(C)、初始pH值(D)、温度(E)5个影响因素的L16(45)正交试验(表1),同时以纯LB培养基作为空白对照.按照1%转接量接种菌液,记录LB培养基中生物膜的干重.
1.5 数据统计与分析
所有数据均采用Excel 2010进行统计,使用SPSS 18.0软件进行方差分析和差异显著性分析,使用Origin 8.0软件作图.

表1 影响枯草芽孢杆菌生物膜形成的5个因素的水平设计Table 1 Levels of 5 factors affecting the formation of B.subtilis biofilm
2 结果与分析
2.1 生物膜形成能力的评估方法
从图1A可以看出,生物膜成熟后细胞聚集在一起且被胞外大分子团团包围在内部.当用结晶紫染色后,染色剂无法进入生物膜内部,造成染色不充分(图1B).试验过程中观察发现,新形成的尤其是气液界面的生物膜较为疏松,若漂洗太过用力将造成生物膜破坏、脱落、丢失,若漂洗不彻底又不容易洗去杂质,进而影响试验结果.因此,进一步采用烘干称重法定量评估生物膜形成能力.由图1C-E可见,去掉培养基后生物膜仍保留完整,说明生物膜烘干称重法可行.

A.生物膜于96孔板中培养;B.生物膜被结晶紫染色;C.气液界面的生物膜;D.生物膜烘干前;E.生物膜烘干后.图1 枯草芽孢杆菌生物膜形态Fig.1 The morphology of B.subtilis biofilm
2.2 影响生物膜形成的单因素试验结果
将菌液按1%转接量接种至高压灭菌的LB培养基中,探究不同温度下枯草芽孢杆菌生物膜的形成量.结果表明:过低(<30 ℃)或过高(>40 ℃)温度都不利于生物膜形成;35 ℃为生物膜形成的最适温度,该温度下生物膜的干重接近于45 ℃时的2倍(图2A).
调节培养基初始pH值,经过高压灭菌后接种菌液,并放入35 ℃培养箱中静置培养1 d.结果表明,枯草芽孢杆菌生物膜形成能力随着pH值升高而降低,初始pH=5.0时,生物膜干重最大(图2B).
将培养基初始pH值调节为5.0,高压灭菌后接种菌液,并分别向培养基中添加0.01、0.1、1、10、20、30 mmol·L-1Mg2+溶液,35 ℃下静置培养1 d.结果表明,Mg2+浓度在1~20 mmol·L-1时,对枯草芽孢杆菌生物膜起促进作用,浓度高于20 mmol·L-1时会抑制生物膜形成.当Mg2+浓度为20 mmol·L-1时,生物膜干重最大(图2C).
将培养基初始pH值调节为5.0,高压灭菌后接种菌液,并添加经过灭菌的20 mmol·L-1Mg2+溶液,再分别添加0.01、0.1、1、10、20、30 mmol·L-1Ca2+溶液,35 ℃下静置培养1 d.结果表明,Ca2+能促进生物膜合成,最优Ca2+浓度为20 mmol·L-1(图2D).
将培养基初始pH值调节为5.0,高压灭菌后接种菌液,并分别向培养基中添加20 mmol·L-1Mg2+溶液和20 mmol·L-1Ca2+溶液,同时分别添加2、4、6、8、10、12 g·L-1过滤除菌的葡萄糖溶液,35 ℃下静置培养1 d.结果表明:LB培养基添加葡萄糖后,生物膜形成能力逐步上升,当葡萄糖浓度为6 g·L-1时生物膜干重最大;当葡萄糖浓度进一步提高时,生物膜的形成能力逐渐下降,最后趋于平稳(图2E).

图2 培养温度(A)、pH值(B)、Mg2+浓度(C)、Ca2+浓度(D)和葡萄糖浓度(E)对生物膜形成的影响Fig.2 Effects of culture temperature (A),pH (B),Mg2+ concentration (C),Ca2+ concentration (D) and glucose concentration (E) on biofilm formation
2.3 正交试验结果
从表2的R值可得,各因素对枯草芽孢杆菌生物膜形成的影响大小依次为初始pH值(D)>葡萄糖浓度(A)>Mg2+浓度(C)>Ca2+浓度(B)>温度(E).由表3也可得,初始pH值对生物膜形成的影响程度最大(P<0.05).从k值可以看出,A因素表现为A4>A3>A2>A1,B因素表现为B3>B1>B2>B4,C因素表现为C2>C1>C3>C4,D因素表现为D4>D3>D2>D1,E因素表现为E1>E2>E3>E4.因此,最优组合为A4B3C2D4E1(15号组合),即葡萄糖浓度为12 g·L-1,Mg2+浓度为10 mmol·L-1,Ca2+浓度为1 mmol·L-1,培养基初始pH值为8.0,培养温度为25 ℃.此外,通过肉眼观察生物膜在气液界面的形态(图3)也可以发现,15号组合中生物膜最为致密、成熟.
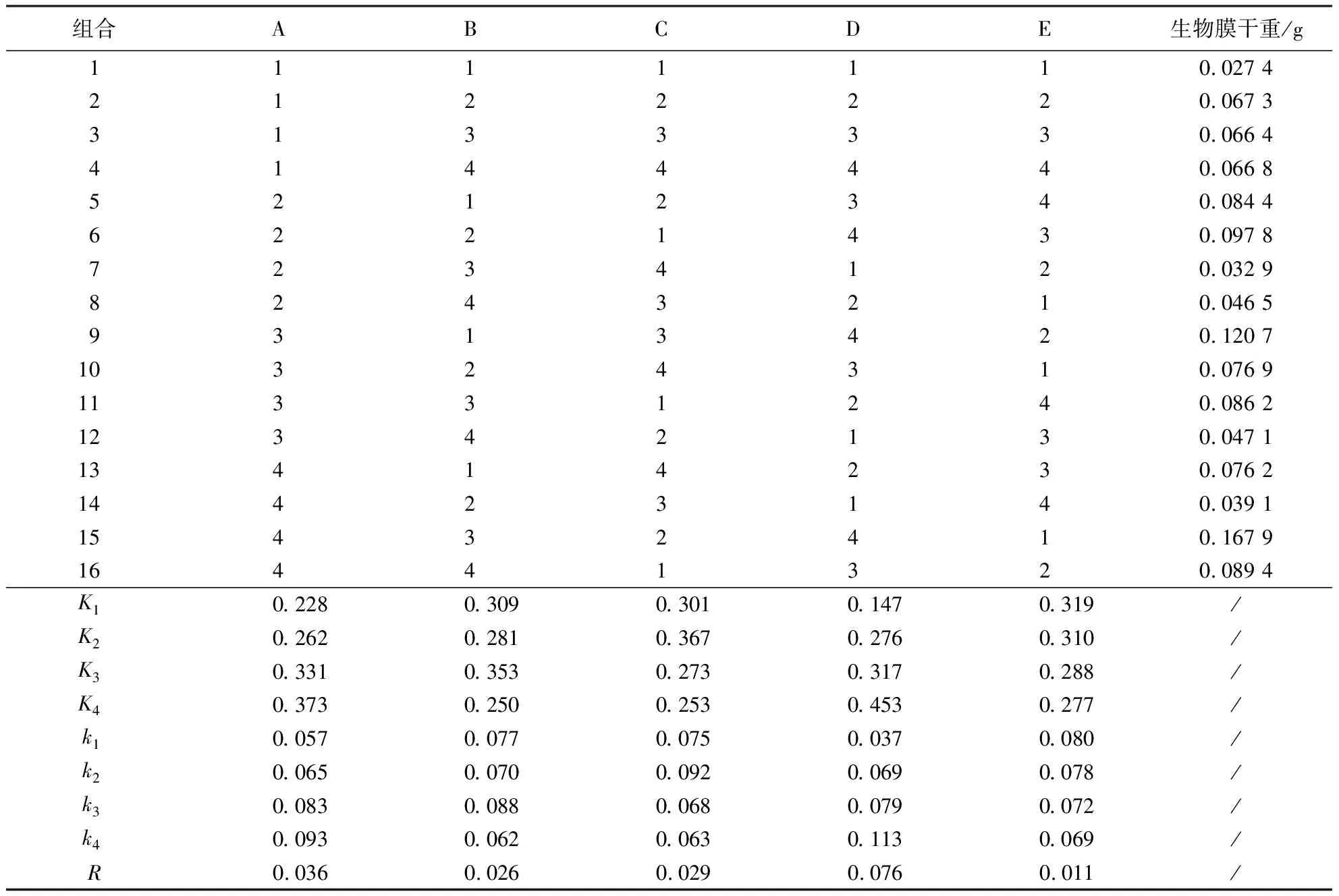
表2 枯草芽孢杆菌生物膜形成优化的正交试验设计方案与结果1)Table 2 Design and results of orthogonal experiment for the optimization of B.subtilis biofilm formation

表3 正交试验结果方差分析1)Table 3 ANOVA analysis of orthogonal experiment results
3 讨论与结论
当前,研究生物膜常用的方法有试管法、定量检测微孔板法、置片法等,这些方法能在一定程度上模拟生物膜的形成过程,但生物膜生长牢度不足,对生物膜形成的判断偏主观性,因而评估结果差异大,不够准确[16],并且相同的细菌在不同培养方法中形成生物膜的能力差异较显著[17].结晶紫法是观察生物膜形成的常用方法,它可以快速直接地观察到生物膜,但同时会出现染色不够充分,在漂洗过程中生物膜容易脱落、丢失,不能完整保存等缺点.平板菌落计数法也被用于生物膜的检测中,但由于大部分的微生物不可培养,可能造成检测出的生物量远小于实际的生物量.烘干称重法可以较为准确地评价生物膜的形成,但其存在有效性较差的缺点.因此,需要结合多种方法开展生物膜的研究.
枯草芽孢杆菌生物膜的形成与其产生的蛋白质、多糖等胞外基质浓度有关[18].据报道,葡萄糖相较于其他碳源对生物膜活性影响最显著[19].本研究发现,葡萄糖在低浓度(2~6 g·L-1)时对生物膜形成表现为促进作用,但过多葡萄糖则起抑制作用.金属离子Mg2+和Ca2+可影响细菌芽孢的形成[15],而枯草芽孢杆菌生物膜形成与其芽孢产生有关[20],因此Mg2+和Ca2+浓度能间接影响生物膜形成.据报道,适当浓度Ca2+可加快许多微生物形成速度[21-22].本试验结果表明,低浓度(0.01~20 mmol·L-1)Ca2+对枯草芽孢杆菌生物膜形成表现为促进作用,浓度大于20 mmol·L-1则表现为轻微抑制作用.与此类似,低浓度(1~20 mmol·L-1)Mg2+能够提高生物膜形成能力,但当其浓度大于20 mmol·L-1则会减弱生物膜形成能力.除了培养基成分会影响生物膜形成外,培养环境对其也有不同程度的影响.其中,pH值对生物膜形成的影响尤为显著,弱酸性与中性环境中细菌形成最旺[23];过高或者过低的温度都不利于生物膜形成.

1~16的试验方案见表2.图3 16个正交组合所得生物膜比较Fig.3 Comparison on biofilms in 16 orthogonal combinations
本研究在单因素试验基础上进行正交试验设计,结果发现:当培养基中含12 g·L-1葡萄糖、10 mmol·L-1Mg2+、1 mmol·L-1Ca2+,且初始pH值为8.0,在25 ℃下培养时,生物膜的形成能力最强,此时生物膜干重为0.167 9 g,与空白对照相比,生物膜干重提高了40%.

