利用流式细胞技术测定和评估金线莲基因组大小
林 瀚,王晶晶,黄华星,何碧珠,兰思仁,马晓开
(1.福建农林大学海峡联合研究院基因组与生物技术研究中心;2.福建农林大学兰科植物保护与利用国家林业和草原局重点实验室;3.福建农林大学园林学院;4.福建农林大学园艺学院,福建 福州 350002)
金线莲(Anoectochilusroxburghii),隶属于兰科(Orchidaceae)兰亚科(Orchidoideae)开唇兰属(Anoectochilus),是一种多年生草本植物,主要分布于中国、日本、斯里兰卡、尼泊尔和印度等国,生于海拔50~1 600 m的常绿阔叶林下或沟谷阴湿处[1].金线莲在我国作为传统名贵药材被人们广泛种植,具有滋阴降火、清热解毒、祛风除湿、消炎止痛等多种功效,且未发现毒副作用[2,3].在医疗上被应用于治疗和预防高血压、肿瘤、糖尿病、小儿发育不良、风湿病等症[4].在民间富有“金草”、“药王”等盛誉[5].从形态上来看,金线莲植株小巧优雅,金黄色的叶脉呈网状排列[6],具有较高的观赏价值.此外,由于野生金线莲结实率较低且种子萌发条件较为苛刻[7],加上遭受人类活动的长期破坏,目前金线莲野生资源已经处于极其濒危状态,其遗传保育研究工作刻不容缓.
基因组是一个生物物种所有遗传信息的总和,基因组大小的测算对象是该物种单倍体核的DNA含量,称为C值.其单位通常表述为碱基对的数目(bp)或质量(pg),是植物基本且重要的生物多样性参数[8].在每个物种中,细胞的染色体数和DNA含量即C值是固定的,可用于评估生物体的生物学特征,为其基因组和转录组学的研究提供依据,是比较和进化基因组学研究的基础,还在物种的鉴定、分类和进化等方面有重要意义.常用的基因组C值测算方法有孚尔根光密度测量法、脉冲场凝胶电泳、流式细胞术、实时荧光计量PCR法[9].流式细胞技术借助流式细胞仪和荧光染料,进行细胞内蛋白质和核酸的定量研究.事先制备好的细胞核悬液,使用特定荧光染料进行染色后,于设定的压强下进入流式细胞仪的流动室.细胞呈单列排序,经由喷嘴喷出形成液流,细胞液流与入射激光束相交被激发出荧光,利用滤片收集各个细胞的荧光强度,测得的荧光强度即可换算出待测样品的细胞核DNA含量[10].该技术操作简便高效、结果精准,属于目前基因组大小测定的主流方法.
目前,关于兰科植物分子生物学、基因组学层面的研究才刚刚起步,一些重要类群的基因组基本信息仍旧缺乏,与遗传育种相关的研究还相对滞后.作为药用、保育及观赏价值较高的兰科物种,亟待对其细胞遗传学和分子生物学等层面进行研究,探索其遗传基础和进化规律.对于开唇兰属植物的基因组DNA的C值含量和基因组大小的评估尚未开展.本研究建立基于流式细胞技术测定金线莲基因组大小的测定方法和流程,估算了金线莲的DNA含量,为后续金线莲和开唇兰属植物的全基因组测序提供依据.
1 材料与方法
1.1 试验材料
试验材料来自福建农林大学森林兰苑的兰科种质资源圃保存的福建野生金线莲,嫩叶为试验待测对象,福建农林大学海峡联合研究院基因组与生物技术研究中心的鸡红细胞核(chicken erythocyte nuclei,CEN,DNA 2C含量为2.5 pg)作为内标.
1.2 试剂、耗材和仪器设备
试验所用到的主要试剂、耗材及仪器包括:LB01分离缓冲液[11]、Galbraith′s分离缓冲液[12]、WPB分离缓冲液[13]、碘化丙啶(propylene iodide,PI)荧光染色剂、鸡红细胞核(chicken erythocyte nuclei,CEN)、RNAase(美国,Sigma公司)、过滤膜(孔径30 μm)、培养皿(直径5 cm)、双面刀片、试管(10 mL)、微量离心管(Eppendorf公司,1.5 mL),及FACScalibur流式细胞测定仪(美国Becton-Dickinson,San Jose,CA公司)、Micro CL17型微量台式离心机(美国Thermo Fisher Scientific公司).
1.3 缓冲解离液和荧光染料的制备
分别选用LB01分离缓冲液、Galbraith′s分离缓冲液、WPB分离缓冲液(表1),对金线莲的新鲜嫩叶进行裂解测试,从中筛选最适合的金线莲细胞测定的解离液.碘化丙啶(PI)具有非特异性标记作用,可作为细胞核荧光染料,进行基因组的绝对值测量[14],使用的终浓度为50 μg·mL-1,存放于4 ℃冰箱中备用.在检测核DNA含量前,需排除RNA干扰.因此在上机测定前需提前添加RNAase(工作液浓度50~150 μg·mL-1,贮存液1 mg·mL-1,-20 ℃保存)以降解RNA.
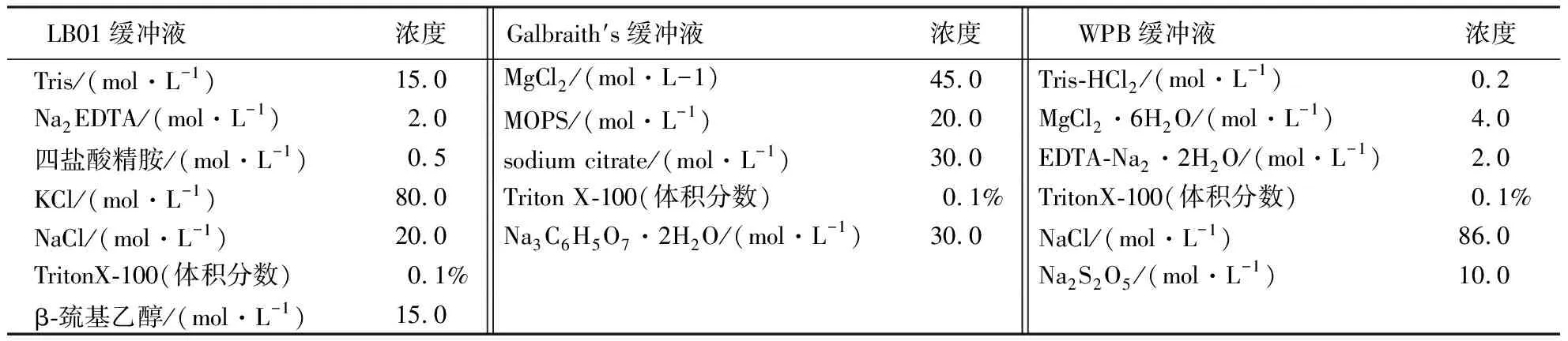
表1 3种细胞核裂解液的配方[11-13]Table 1 Components of 3 nuclear lysis buffers[11-13]
1.4 细胞核悬液制备与DNA特异性染色
细胞核悬液的制备与细胞核染色参照Dolezel et al[14]的方法进行.取金线莲的新鲜嫩叶4份,每份约0.5 g.用于放置的培养皿提前预冷,分别置入1 mL预冷的LB01、Galbraith′s、WPB分离缓冲液,使金线莲叶片完全没入液体中.用锋利双面刀片垂直迅速切碎并轻轻抽打,使得细胞核游离出细胞,过程中尽量避免小气泡产生.吸取培养皿中含有细胞核的解离液于孔径30 μm滤膜,进行过滤,后收集滤液至1.5 mL微量离心管管中.通过冷冻离心机800 r·min-1离心5 min,弃掉上清,倒置于纸上将残存液体沥干,收集沉淀的细胞,再加入150 μL预冷解离液.将待测样品与对照标样CEN进行混合制样(等比例混匀),吸取250 μL混合液,逐次加入RNAase和0.5 μL预冷的PI染料(终浓度100 μg·mL-1),进行荧光染色.轻轻晃动后置于4 ℃冰箱,避光孵育染色30 min,即可上机检测.
1.5 流式细胞仪检测和基因组大小估算
通过流式细胞测定染色的细胞核悬浮液的荧光强度,所用仪器为美国BD公司产FACScalibur流式细胞仪.仪器提前预热30 min,上机前样品再手动振荡 5~10 s,设置参数,PI激发波长为488 nm.通过扫描PI染色的1 000个悬浮的细胞核,收集FL2通道的荧光(FL2-A),每个样品重复4次,测得其荧光强度.PI染色剂嵌入DNA碱基对中,嵌入量信息反馈在荧光强度上,并和DNA含量形成正相关[15].每次检测结束之后,用清洗液和去离子水充分清洁.有研究表明[16],CEN的DNA 2C含量为2.5 pg,选择CEN为内标作对照,固定其横坐标,与待测样品金线莲充分混匀后进行检测,即可根据峰的位置,参考已知基因组大小的CEN进行比对,从而测得金线莲基因组大小.随后根据流式细胞仪测得的图像和1 000个细胞核的测算数据,使用仪器自带的CellQuest软件进行处理分析,获得金线莲测定样本及内标的G0/G1期的峰值.最后按照下列公式,计算出金线莲的基因组DNA含量:
2 结果与分析
2.1 分离缓冲液和参考标准的筛选
流式细胞技术简便高效,上机结果直观明晰.但在此之前,对细胞核悬浮液的选择有较高的要求.不同的分离缓冲液对待测材料的解离效果具有差异,本研究需要找到更适合金线莲的解离液.结合前人研究,本研究选取3种常用解离液(LB01分离缓冲液、Galbraith′s分离缓冲液、WPB分离缓冲液)进行比较,由于植物细胞有细胞壁及众多细胞器,兰科植物更是富含高浓度的淀粉和多糖、多酚等物质,这对核悬液提出了更高要求.针对这些特点进行尝试选用,结果发现Galbraith′s分离缓冲液对金线莲幼嫩叶片的解离效果更好,较为完整地释放了细胞核,且细胞碎片较少,干扰荧光少;而LB01、WPB分离缓冲液的解离效果一般.结合变异系数(CV值),最后得出Galbraith′s分离缓冲液最优;用CEN作为参照标准(内标)与金线莲嫩叶样品混合后进行流式细胞测定,发现测试样品与内标粒子的区分明确、清晰,且出峰稳定,无重叠峰,峰型集中.因此使用CEN作为内标测定金线莲基因组大小方法合理,结果可靠.
2.2 基因组C值和大小的测定结果
以CEN为内标测定4组金线莲样品(图1).其中二维散点图中FSC-H通过前向角散射信号强度揭示细胞大小;直方图中FL2-A显示染色后荧光信号的相对强度,Counts值表示计数.本研究根据混合样品中CEN和待测金线莲样品的PI发射荧光强度的差异和峰值之间的相对关系,可计算得到:金线莲基因组的2C DNA含量为(6.83±0.067 )pg(表2).为确保结果的可靠性,共进行4次生物学重复测量,观测浮动值,以确保测量的稳定性.另外,通过核DNA的含量换算(1 pg=0.978 Gb)可得金线莲的基因组为(3.34±0.033) Gb.
3 讨论
1983年,Galbraith et al[12]首次建立流式细胞术测定植物DNA C值的方法.如今,随着高通量测序技术的高速发展,越来越多的人们开始对不同物种进行基因组测序研究.因此需要更便捷高效的方法对植物基因组大小进行前期估算、探索基因组特征.流式细胞技术经过不断改进,已成为测定植物基因组大小的标准方法[17].流式细胞技术也在植物遗传及育种研究中取得了广泛的应用,不仅可以对基因组大小进行测定,而且可以对植物的倍性和生殖途径进行鉴定和分析[18].通过流式细胞技术测基因组大小,操作简便高速,能得到准确直观的结果,可重复性强,是一种高通量技术手段.但用流式细胞技术测定植物基因组大小时,也出现过相同物种的测定结果间有所差异的案例[14,19],这与多方面因素有关.测定具有核内多倍性的植物以及具有渐进式局部核内再复制(progressively partial endoreplication)的植物(如兰科)基因组大小时,技术上的挑战更大[20].因此在试验中应当充分考虑样品制备、细胞裂解方法和参标选择、混样染色等问题,尽可能减小误差.
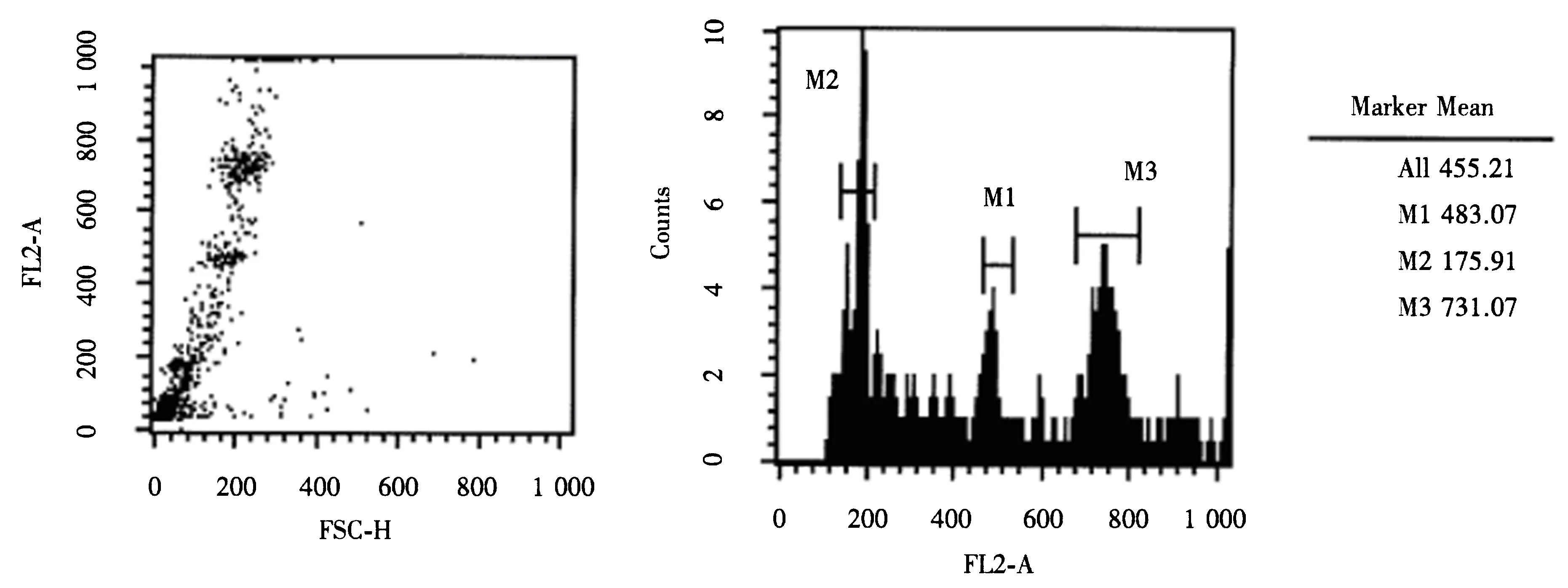
图1 金线莲和鸡红细胞混合样品流式细胞检测结果Fig.1 FCM detection images for the mixed samples of A.roxburghii and chicken erythocyte nuclei
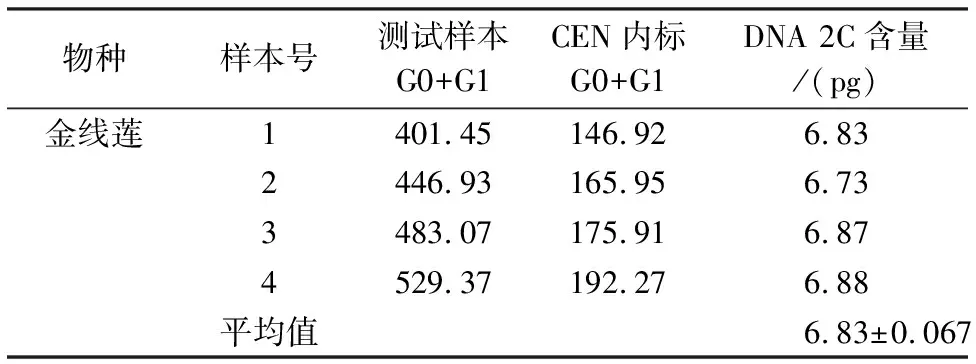
表2 金线莲的DNA 2C含量测定结果Table 2 Results of the 2C values for A.roxburghii
首先,在测定前,选择新鲜的金线莲幼嫩叶片作为试验材料.使用幼嫩的植物组织可以有效避免组织成熟、老化后带来的更高浓度的淀粉、多糖、多酚或其他代谢产物,减小误差.样品的制备和保存需要多加注意.
其次,裂解液(分离缓冲液)的选取也是相当重要的,适当的裂解液能抑制核酸酶、维持细胞核的完整性并能提供核酸染料染色最佳条件,使测定结果更加准确.目前国际上还没有通用的植物细胞核裂解液,不同种属、植物的不同部位所需要的裂解液也各不相同[21].因此本试验中,结合前人研究,选取3种裂解液进行尝试.试验中发现Galbraith′s分离缓冲液的裂解效果最好,WPB分离缓冲液、LB01分离缓冲液效果相对一般.可以推测可能和Galbraith′s分离缓冲液中含有MgCl2有关,MgCl2可作为染色质稳定剂,保持细胞核的稳定,并且其含有柠檬酸钠和TritonX-100等物质,能进行通透处理,有效清洗,减少金线莲中富含的糖类、多酚等黏性杂质,防止其与细胞核黏连[22],降低了测定时信号的干扰,且其化学性质比较温和,也保障了细胞核的稳定[23].WPB分离缓冲液虽然也含有MgCl2,但是裂解后细胞碎片较多,CV值较高,WPB还是更适用于木本植物细胞核的裂解.如经多次尝试发现结果仍不理想,应考虑对现有分离缓冲液的配方进行改进,寻找其他成分以期获得更佳的细胞核裂解效果.
分离缓冲液制备后,选择PI作染料进行荧光染色.PI染色剂可嵌入金线莲细胞核的DNA,充分激发出荧光,供给流式细胞仪检测.PI染料也是目前DNA流式细胞术的常规染料.近年来,有毒性较低、分辨率更高的新染料出现,值得进行更多试验和推广[17].
在选择内标时,本研究使用CEN作为内标来测定金线莲的C值,所用内标均采用同一批标准样本.测定结果表明,CEN与待测样品无重叠峰,区分度较好,用其作为内标估算金线莲基因组大小,准确可靠.同时,为了降低试验误差,测试材料均为活体植株新长出的幼小叶片.如具备更好试验条件,内标选择已知基因组大小的植物,会更为适合.尽量保证内标物与待测样品的基因组大小相近,但又不宜太近,防止混样后测得的荧光峰重合.Doležel et al[14]在所著文中提及的标准包含8种DNA含量在1.10~34.89 pg的植物,已经稳定用于植物基因组大小的测定.其研究机构——捷克共和国实验植物学研究所分子细胞实验室,以种子的形式向全球科研者免费提供这些标准植物样本.这些植物的细胞学性质稳定,少有次级代谢产物,且种类常见,是很好的参照材料.汪琛颖等[24]使用流式细胞术,以铁皮石斛为参标,以Galbraith′s缓冲液为解离液,测出兰科兰属的蕙兰(Cymbidiumfaberi)基因组DNA 2C含量为8.98 pg.该试验也指出Galbraith′s缓冲液裂解对参标铁皮石斛和待测材料蕙兰的解离效果均最优.这与本试验对兰科金线莲的测定相类似,可互为佐证.
目前,兰科植物的细胞遗传学、分子生物学和组学的研究多集中于传统热带兰品种,如蝴蝶兰属(Phalaenopsisssp.)和文心兰属(Oncidiumssp.)[25],而对开唇兰属的研究极少.已有研究主要集中在对其生理生化指标(如成分含量)等进行评价[26-28].作为开唇兰属最为珍稀濒危的金线莲,其药用、观赏和保育价值非常显著,因此应该加强对其相关领域的研究.2009年首个兰科植物的全基因组草图公布后[29],经过数年各方努力,科学家们克服了兰科植物基因高杂合度的技术难题,陆续完成了4种兰科植物的全基因组序列的组装和分析,包括小兰屿蝴蝶兰(Phalaenopsisequestris)[30]、铁皮石斛(Dendrobiumofficinale)[31-32]、深圳拟兰(Apostasiashenzhenica)[33]、天麻(Gastrodiaelata)[34]等,获得了高精度的基因组序列图谱和大量的基因信息.作为被子植物第二大科[33],兰科植物在适应环境,不断进化中形成了极高的丰富度,成为科学家们研究的热点,各类群全基因组序列的破译及进化基因组学的研究将为揭示兰科植物的起源、进化及重要创新性状的遗传基础及其分子机理提供强大的基因工具包.本研究利用流式细胞术,对金线莲基因组大小的测算方法进行探索,最后成功估测金线莲的C值和基因组大小.由于不同于模式植物,兰科开唇兰属在研究和试验上的参照数据有限,对金线莲基因组基本特征的研究可为其进一步的分子生物研究、种质保育、基因挖掘等提供依据.随着测序成本的大幅下降,对开唇兰属植物进行全基因组测序已可提上日程.通过对金线莲的基因组大小的测定,可提前预估测序成本,并为其测序方法、组装策略的选择等提供依据,也为将来开唇兰属植物的细胞遗传学、分子生物学、基因组和转录组学等研究提供依据.

