滨海沙地大头典竹叶片响应盐胁迫差异蛋白的鉴定与分析
郑俊鸣,陈思凯,陈礼光,洪小龙,何天友,郑郁善
(1.福建农林大学园林学院;2.福建农林大学林学院,福建 福州 350002;3.福建省东山赤山国有防护林场,福建 漳州 363400)
福建滨海沙地防护林以木麻黄、湿地松等为主,其退化快,生产力弱,结构单一,影响了生态系统的稳定性.大头典竹(Bambusabeecheyanavar.pubescens)根系发达,适生性强,竹材纤维长,抗风性相对较强,具有极强的滨海沙地防护林应用的潜力.2002年引种大头典竹至福建东山岛滨海沙地,其成活率较高、生态适应性较强,且能有效改良土壤环境、林分结构,定植成功后能有效提高其他生物的引种成活率,如水黄皮、潺槁木姜子等,产生了极大的生态效益[1].滨海沙地的土壤盐分或盐煞对植物生长造成较大的影响,根系或叶片细胞渗透压改变,导致植物失水或死亡[2].目前,关于竹类对盐胁迫的响应主要集中在生理、生化方面[3-4].在蛋白质组学方面的研究相对较少[5].蛋白质组学是通过蛋白质表达水平来解释生命活动现象.不同植物在盐胁迫下的蛋白响应不同,黑麦草、燕麦和草地早熟禾等抗氧化酶以及水稻根中的抗病蛋白、β-1-3葡聚糖酶等在盐胁迫下出现表达上调[6-7],可能与抗盐性有关[8-9].叶片是植物进行光合作用和呼吸作用的营养器官,是进行二氧化碳固定和碳同化的主要场所,能较快地反映盐胁迫对植物的影响.本文通过分析与鉴定不同NaCl溶液胁迫下大头典竹叶片的蛋白表达量,进一步揭示大头典竹的蛋白功能和代谢通路对盐胁迫的适应情况,为培育适宜滨海沙地生长的耐盐品种提供依据.
1 材料与方法
1.1 试验材料
试验材料来源于福建省漳州市东山岛滨海沙地,选取长势良好、均匀一致的2年生侧枝扦插到福州市福建农林大学的盆钵中,待侧枝萌发长出新叶,以供试验需要.试验前测得样地盐分为0.6%.因此,试验分别用0% (CK)、0.4%、0.6% NaCl溶液处理(用1/2 Hoagland营养液配制).处理7 d后,对大头典竹进行取样,选取长势一致的叶片作为试验材料,液氮保存,并提取竹叶蛋白,放入冰箱内-80 ℃保存.样品的制备和2-DE试验均设置3次生物学重复以确保试验的精确性和重复性.
1.2 试验方法
1.2.1 全蛋白提取 叶全蛋白提取方法参考陈思凯等[10].称取0.2 g叶片加入2 mL离心管内,加入少量聚乙烯吡咯烷酮.液氮冷却后研磨至粉末,移至离心管,再加入液氮进行冷却,加满10% TCA/丙酮溶液后进行涡旋振荡.在4 ℃,17 000×g离心10 min,去除上清液.用80%甲醇、0.1 mol·L-1醋酸铵溶液和80%丙酮溶液进行清洗.风干30 min后,加入SDS提取液和Tris饱和酚,涡旋振荡,17 000×g离心,提取上层酚相后加满甲醇醋酸铵溶液,待沉淀后离心,去除上清液,并干燥.依次加入80%丙酮溶液、100%甲醇溶液,并进行涡旋振荡和离心.重复3~4次至洗净,风干30 min,获取蛋白干样.
1.2.2 蛋白裂解和定量 称取10 mg叶蛋白干粉,加入500 μL裂解液,涡旋振荡10 min,超声5 min,冰浴5 min.在4 ℃,17 000×g离心10 min,提取上清液,即纯净蛋白.运用Brafford法[11]对蛋白质含量进行测定,选择牛血清蛋白作为标准.
1.2.3 双向电泳分析 采用BIO-RAD公司的17 cm的pH 5~8 IPG胶条,具体操作步骤参考陈思凯[10].
1.2.4 差异蛋白的质谱分析 显色的胶片用UMAX Power Look 2100XL扫描仪采集图像.凝胶图像分析在PDQURST 8.0中完成.差异蛋白点运用MALDI-TOF-MS 5800质谱分析仪进行蛋白鉴定.差异蛋白表达量以对照组的凝胶为参考胶,分别与0.4%、0.6% NaCl处理的凝胶进行两两对比,筛选差异蛋白在蛋白表达量上调或下调差异大于1.5倍,并通过t检验有显著差异(P<0.05)的蛋白[12].
1.2.5 生物信息学分析 运用Blast2GO软件(https://www.blast2go.com/)对差异蛋白进行GO功能注释[13].通过基因本体数据库计算GO分类的差异蛋白数量,按照生物过程、分子功能和细胞组分对已鉴定的差异蛋白进行比较分析[14].利用在线分析工具KAAS(https://www.genome.jp/tools/kaas/)对差异蛋白进行KEGG代谢通路注释.通过比对KEGG数据库(https://www.kegg.jp/),找到匹配度最高的蛋白质,进行KO归类,继而获取蛋白序列参与的通路信息[15].
1.3 数据处理与分析
运用Excel 2013对数据进行整理和统计.运用ImageMaster 2D Platinum 7.0进行双向凝胶谱图分析.运用Photoshop CS 5.0进行作图.
2 结果与分析
2.1 不同盐浓度处理下叶片差异蛋白的表达情况
0.4%和0.6%NaCl溶液处理的竹叶蛋白的清晰凝胶图谱,每个处理得到蛋白点约600个(图1).不同含量NaCl溶液处理检测的差异蛋白数量不同.经PDQuest 8.0检测,在0.4% NaCl处理下,34个差异蛋白表达量差异显著,其中12个差异蛋白表达量显著上调,22个差异蛋白表达量显著下调.在0.6% NaCl处理下有40个表达量差异显著的蛋白,其中有27个蛋白表达量显著下调,13个蛋白表达量显著上调.

图中数字表示成功鉴定的蛋白样品编号.图1 双向电泳分析不同NaCl溶液处理大头典竹叶片蛋白表达图谱Fig.1 Protein expression maps under different concentrations of NaCl by 2-DE analysis
从差异蛋白中挑选出18个蛋白进行质谱分析,成功鉴定了15个差异蛋白(图1,表1).15个成功鉴定的差异蛋白分别涉及光合作用、能量代谢、碳代谢和细胞防御等相关蛋白.涉及的光合作用相关蛋白有3个,分别为叶绿体PsbP(2个)和放氧增强子蛋白1(1个);能量代谢相关蛋白有4个,分别为ATP合酶α亚基(1个)、ATP合酶β亚基(2个)和磷酸甘油酸激酶(1个);碳代谢相关蛋白有5个,分别为核酮糖-1,5-二磷酸羧化酶(5个);细胞防御蛋白相关蛋白有2个,分别为谷氨酰胺合成酶(1个)和抗坏血酸过氧化物酶(1个);其他和未知蛋白有1个.其中,涉及碳代谢相关蛋白所占比例最大,达到33.33%,其次为能量代谢、光合作用相关蛋白,所占比例分别为26.67%和20.00%.由此说明,盐胁迫主要影响碳代谢、能量代谢和光合作用相关蛋白,从而影响植物的正常生命活动.
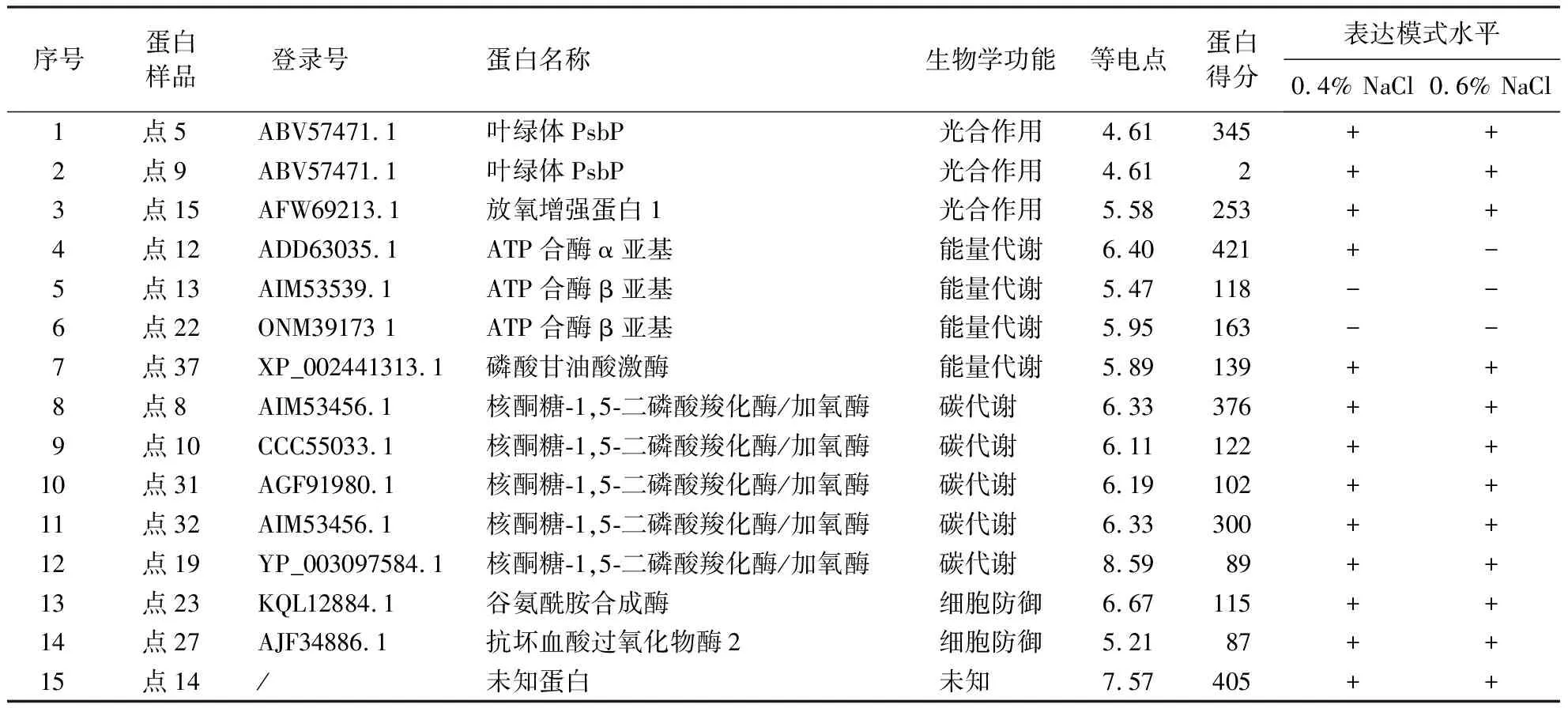
表1 盐胁迫响应蛋白质谱鉴定结果1)Table 1 Protein spectrum under salt stress
在0.4%和0.6% NaCl处理时,叶绿体PsbP、放氧增强子蛋白1、核酮糖-1,5-二磷酸羧化酶、谷氨酰胺合成酶、抗坏血酸过氧化物酶2、磷酸甘油酸激酶的蛋白表达量显著上调.而ATP合酶β亚基蛋白表达量在0.4%和0.6% NaCl处理时显著下调.ATP合酶α亚基表达量在0.4% NaCl处理后呈现上调趋势,在0.6% NaCl处理后呈现下调趋势.
2.2 差异蛋白GO注释和KEGG通路分析
15个成功鉴定的差异蛋白GO功能注释,涉及生物过程、分子功能和细胞组分等3个方面(表2).生物过程涉及细胞过程、代谢过程、刺激反应、定位过程等,蛋白数量分别为11、6、1、1个.分子功能可分为离子结合功能、转运活性功能、催化活性功能,蛋白数量分别为9、3、10个.细胞组分包含有细胞、细胞部件、细胞膜、细胞器,蛋白数量分别为10、10、4、9个.
在GO注释的基础上,对差异蛋白参与的代谢通路进行分析.15个差异蛋白的代谢通路参与了光合作用代谢通路、氧化磷酸化代谢通路、碳代谢作用、乙醛酸和二羧酸代谢等10条代谢通路(表3).1种差异蛋白可能参与多条代谢通路.其中,碳代谢作用、乙醛酸和二羧酸代谢、光合作用和氧化磷酸化涉及的蛋白数量相对较多,说明盐胁迫对大头典竹生长的影响主要在这些代谢途径.

表2 盐胁迫下大头典竹叶片差异蛋白的GO功能分类Table 2 GO functional classification of differential proteins under different concentrations of NaCl

表3 盐胁迫下大头典竹叶片差异蛋白 的KEGG代谢通路分析Table 3 KEGG pathway analysis of differential proteins under different concentrations of NaCl
3 盐胁迫相关蛋白功能及代谢通路分析
3.1 大头典竹响应盐胁迫中光合作用相关蛋白
3个与光合作用相关的蛋白在0.4%、0.6% NaCl胁迫下蛋白表达量显著上调,分别为2个叶绿体PsbP和1个放氧增强子蛋白1(表1).叶绿体PsbP(又称放氧增强子蛋白2)和放氧增强子蛋白1位于PSⅡ内部,而PSⅡ是植物光合作用光反应的重要成员[16-18].PSⅡ结构中的放氧机构易受到环境胁迫的影响[19].因此,叶绿体PsbP和放氧增强子蛋白1在盐胁迫下,放氧反应会遭受抑制,光合速率降低,造成植物光合作用的代谢通路受到影响(表3).
盐胁迫使得放氧增强子蛋白1遭到破坏,释放大量的氧气以保持PSⅡ的稳定和机体的代谢水平[20].植物的放氧增强子蛋白1表达量显著上调以适应盐胁迫.叶绿体PsbP蛋白表达量显著上调,有利于PSⅡ的稳定,维持光合速率,进而抵御盐胁迫对植物生命活动的伤害[18].由此,盐胁迫下植物叶绿体PsbP和放氧增强子蛋白1显著上调.
3.2 大头典竹响应盐胁迫中能量代谢相关蛋白
15个差异蛋白中有4个蛋白涉及能量代谢,分别为1个ATP合酶α亚基、2个ATP合酶β亚基和1个磷酸甘油酸激酶.磷酸甘油酸激酶主要参与糖酵解途径,生成ATP,而糖酵解途径是植物体内能量代谢和碳代谢的主要途径,也是植物对盐胁迫的适应性策略之一.应对胁迫的响应,香蕉和盐芥的磷酸甘油酸激酶表达丰度均呈现上调[18,21].受到盐胁迫的大头典竹需要更多的ATP提供能量,所以,磷酸甘油酸激酶蛋白表达量出现了显著上调,以维持生命活动.
ATP合成酶α亚基和β亚基分布在线粒体内膜和叶绿体类囊体上,完成ADP和ATP的转化,是生物体能量代谢的关键[22].大头典竹在0.4%和0.6% NaCl胁迫下,ATP合酶β亚基呈现下调的趋势.盐胁迫导致植物ATP合成受到抑制,ATP合酶降解,从而ATP合酶β亚基蛋白表达量下调.ATP合酶α亚基的蛋白表达量在0.4% NaCl处理后显著上调,在0.6% NaCl处理后下调.大头典竹通过调节ATP合酶亚基的表达能力,以缓解蛋白表达量下调对植物生长发育造成的影响,从而适应盐胁迫[18].
3.3 大头典竹响应盐胁迫中碳代谢相关蛋白
差异蛋白中核酮糖-1,5-二磷酸羧化酶/加氧酶是碳代谢途径中重要的羧化酶,参与了碳固定、三羧酸代谢等代谢通路;同时,核酮糖-1,5-二磷酸羧化酶/加氧酶又是植物中含量最高的蛋白质,具有催化羧化的功能,也能起到催化氧化的作用[23].羧化酶活性对植物光合速率有显著影响[24].在0.4%和0.6% NaCl处理后核酮糖-1,5-二磷酸羧化酶/加氧酶的蛋白表达量显著上调,通过加强碳代谢活动,提高植物的光合速率为植物应对逆境胁迫提供更多的能量.
3.4 大头典竹响应盐胁迫中防御型相关蛋白
叶片在干旱处理后,抗氧性相关蛋白表达量显著上调[22],以提高植物对逆境的适应能力.在0.4%和0.6%NaCl处理后,2个防御型相关蛋白表达量显著上调,分别为谷氨酰胺合成酶和抗坏血酸过氧化物酶2.其中,谷氨酰胺合成酶起到细胞防御作用[25].谷氨酰胺合成酶的蛋白表达量显著上调,可能是通过增强氮同化以维持植物正常生理代谢.抗坏血酸过氧化物酶2起抗氧化作用,能减缓活性氧对植物的伤害[26].清除类囊体边缘产生的H2O2,稳定光合机构[27].大头典竹在0.4%和0.6% NaCl胁迫下,坏血酸过氧化物酶2的蛋白表达量升高,以维持正常的生理代谢,增强自由基清除系统功能,提高植物对盐的忍耐度.
3.5 代谢通路
GO功能分析显示,盐胁迫使大头典竹生命活动的细胞过程和代谢过程受到较大影响.盐胁迫的危害主要为离子毒害、渗透胁迫等[28].大头典竹通过渗透调节,维持离子平衡,缓解渗透胁迫,因此离子结合功能及催化活性功能的差异蛋白表达显著,通过离子结合以降低离子对生长的胁迫,并通过催化活性提高代谢速率来抵御盐胁迫.植物处于逆境胁迫时,会在分子、细胞及生理水平上产生自我调节,从而适应逆境[29].KEGG代谢通路分析结果表明,大头典竹在受到盐胁迫时,光合作用、碳代谢、乙醛酸和二羧酸代谢等代谢途径受到显著影响[30].蛋白质之间通过相互作用,直接或间接参与各种代谢通路,从而实现相互调节的目的[31].因此,盐胁迫对植物代谢通路的影响多达10条.乙醛酸和二羧酸代谢为机体提供能量,促进植物生长发育.香蕉、甜高粱等植物受到盐胁迫时,光合作用途径、碳代谢、乙醛酸和二羧酸代谢等途径也受到显著的影响[18,31],从而影响植物的生长发育.
4 结论
大头典竹在0.4%和0.6% NaCl胁迫下,共鉴定出15个差异显著的蛋白.15个差异蛋白涉及生物过程、分子功能和细胞组分等方面,KEGG代谢通路参与了10条,以碳代谢作用、乙醛酸和二羧酸代谢为主.0.4%和0.6% NaCl溶液处理的叶绿体PsbP、放氧增强子蛋白1、核酮糖-1,5-二磷酸羧化酶/加氧酶、谷氨酰胺合成酶、抗坏血酸过氧化物酶2、磷酸甘油酸激酶的蛋白表达量显著上调,ATP合酶β亚基蛋白表达量显著下调,而ATP合酶α亚基表达量呈现先上调后下调的趋势.差异蛋白对盐胁迫的响应反映了植物在蛋白功能表达和代谢途径上对逆境的协调和自适应,为进一步探索大头典竹的耐盐机理提供基础.

