HELLS在食管鳞状细胞癌组织中的表达情况及其与临床病理的相关性研究
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是常见的恶性肿瘤之一,其发病率及死亡率在全球仍居前5位
,但该病早期多无典型临床表现,约50%患者就诊时已为晚期,导致目前ESCC预后差。因此,探索其发生发展机制以期早诊早治具有重要临床意义。
淋巴特异性解旋酶(helicase lymphoid-specific,HELLS)是一种ATP依赖的染色质重塑因子,属于SNF2家族
,主要参与细胞增殖过程中DNA甲基化调控,也有研究
发现,HELLS参与细胞糖代谢。HELLS在肿瘤中相关研究表明,其在胰腺癌、结肠癌、肾癌等多种肿瘤中发挥促癌作用
,但确切的促癌机制目前尚不明确。此外,HELLS高表达与肿瘤预后不良
及化疗耐药性相关
。但其在ESCC中尚无相关研究数据。
《诗志》大多数地方属于纯粹文学批评,喜好以后世的诗歌与《诗》相比较,相对其他文学性解经书籍更为鲜明成熟。如牛氏评点《诗经·汉广》说“汉广不可泳,江永不可方,言游女有二汉之隔,婷婷独立,可望而不可即也。正与‘盈盈一水间,脉脉不得语’相似”[19]。评点《诗经·柏舟》说:“忧极不能自遣,算到奋飞一着,真烦骚无聊之至。‘愿为双黄鹄,奋翅起高飞’,古之忧患人于此踌躇多少。”[19]用后世诗句与《诗》对照阐发,注重的是《诗》作为文学的神理气味,读者自行比较不同诗句,则诗歌的妙味不言而自然领悟。这明显不同于汉人注解《诗经》的方式,以考据训诂追求字词确义。
本研究通过在ESCC组织芯片中采用免疫组化检测ESCC及癌旁组织中HELLS表达情况,初步明确其与ESCC临床病理特点的相关性。
功夫不负有心人。慢慢地,我在太平路小学变得小有名气了。领导感觉这个年轻人有天赋、有激情,于是开始让我尝试在学校做教学研究课。有一次,五一小学的王副校长到太平路小学听课,正好听了我的一节《葡萄沟》,听后王校长对我大加赞赏。这似乎是我和“五一”人的第一次接触。
1 资料与方法
(1)微波抗原修复,常规脱蜡水化;(2)3% H
O
封闭内源性过氧化物酶活性,随后再用山羊血清封闭;(3)孵育HELLS一抗;(4)加入通用型二抗;(5)DAB 显色;(6)苏木精复染,脱水透明,中性树胶封片;(7)显微镜下观察。
龙斌的目光离开了电脑屏幕凝视着竹韵清秀的脸庞,伸手为她理了一下掉在额头手头发,然后紧紧地握住她柔软的小手久久不肯松开。
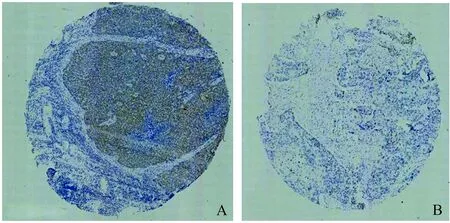
400倍光镜随机选5个高倍镜实验,每视野数100个细胞,HELLS阳性结果:胞核出现棕黄色染色为阳性,阳性细胞占肿瘤细胞的百分比>10%。
进入虚拟漫游培训场景后,可以通过手柄摇杆控制场景中的漫游动作。将场景中的主摄像机Main Camera替换为MojingMain预设摄像头,添加脚本组件MojingWalk挂在MojingMain上,实例代码如下:
选取47例ESCC组织,其中23例有配对癌旁组织,所有ESCC组织和癌旁组织均来源于组织芯片(上海芯超生物科技有限公司,货号HEso-Squ127Lym-01)。肿瘤分期根据国际抗癌联盟食管鳞癌临床病理分期标准(第7版)
确定。
小鼠HELLS单克隆抗体(货号:sc-46665)购自美国 Santa Cruz公司。通用型试剂盒(小鼠/兔聚合物法检测系统)(编号:PV-6000)购自北京中杉金桥生物技术有限公司。
免疫组化结果显示,HELLS在ESCC及癌旁组织中均有表达,阳性表达主要定位于细胞核,表现为黄褐色染色(见图1)。在47例癌组织中28例(59.57%)呈阳性表达,23例癌旁组织中2例(8.70%)呈阳性表达,与癌旁组织相比,HELLS在癌组织中的表达率明显升高(
<0.001)(见表1)。
2 结果
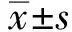

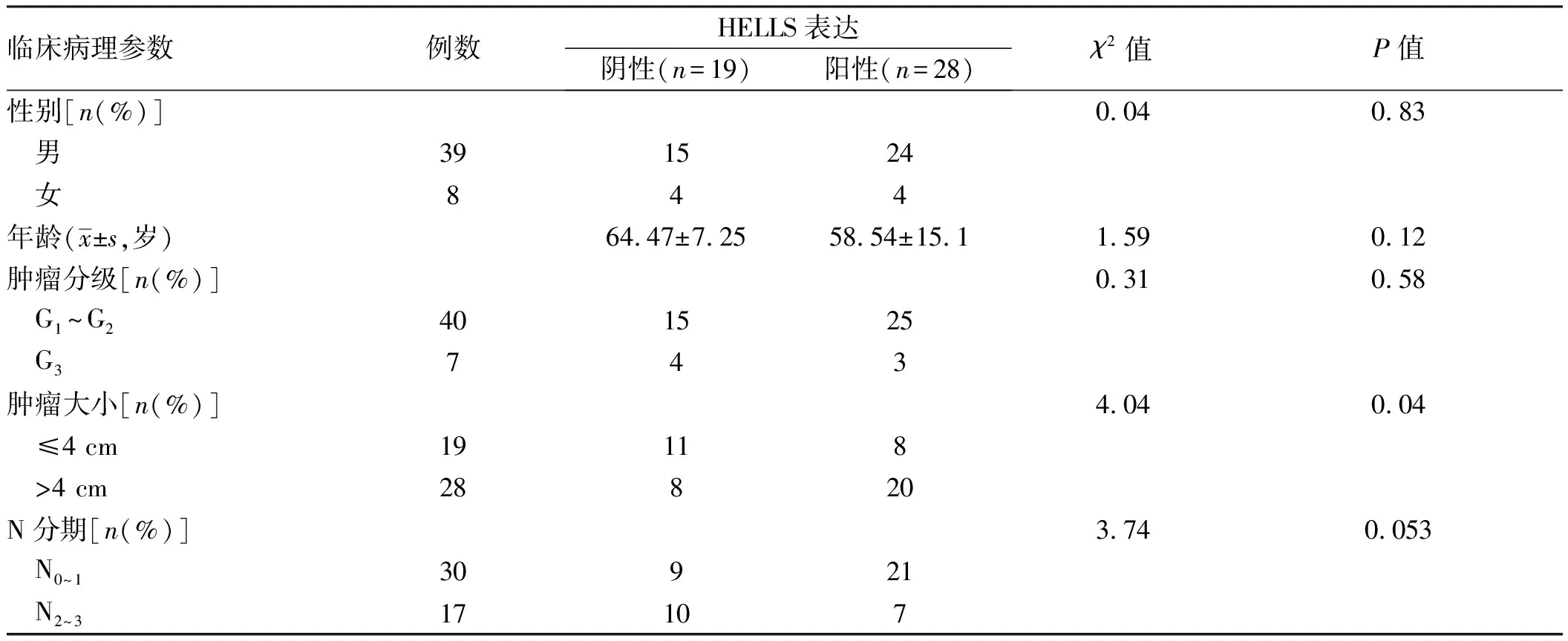
本研究进一步分析了HELLS表达与ESCC患者临床病理参数的关系,结果发现,HELLS高表达与ESCC患者肿瘤大小(
=0.04)有相关性,而与性别、年龄、肿瘤分级及N分期无相关性(
>0.05)(见表2)。
3 讨论
HELLS在维持基因甲基化及染色质重塑过程中发挥重要作用
,在肿瘤领域的研究越来越广泛。目前研究表明,在肝癌、胰腺癌、胃癌及肾透明细胞癌等多种肿瘤中呈高表达,且其高表达与肿瘤进展及生存期缩短相关
。本研究结果也发现,HELLS在ESCC组织中呈高表达。进一步分析其表达与临床病理参数的关系表明,HELLS表达与肿瘤大小相关。此外由于本研究所用芯片组织T分期数据缺失,且均未发生远处转移,因此,需要通过扩大样本量及样本种类进一步验证HELLS与临床参数的关系。
关于HELLS作用机制目前尚未明确,目前研究结果提示其可能通过3种途径发挥作用。首先,HELLS可通过改变组蛋白与DNA间的相互作用,改变核小体位置以暴露DNA
,使得转录调控因子与裸露的DNA结合进而调控下游基因的表达发挥作用。在肝癌细胞中,HELLS通过增加转录起始点核小体占位阻止无核小体区域形成,进而抑制抑癌基因E-cadherin、FBP1、IGFBP3、XAF1及CREB3L3的表达发挥作用
。其次,HELLS可与特定的转录因子相互作用调控靶基因转录。在视网膜母细胞瘤的研究中发现,HELLS是RB/E2F通路中关键的下游蛋白,可能作为E2F3的转录共激活因子调控下游细胞周期蛋白的表达,影响细胞增殖
,在胶质母细胞瘤中的研究也表明,HELLS通过与转录因子E2F3及MYC相互作用影响细胞周期发挥促癌作用
。在肝癌中HELLS可激活着丝粒蛋白F(centromere protein F, CENPF)的转录而影响细胞周期发挥促癌作用
。最后,HELLS参与调控细胞代谢。研究表明,HELLS参与胃癌细胞有氧糖酵解
,在肺癌中通过抑制铁死亡发挥促癌作用
。关于HELLS在食管癌中的作用机制目前尚无相关研究。
总之,本研究发现HELLS在ESCC中呈高表达,其高表达与患者预后不良相关。本研究结果表明,HELLS表达水平与肿瘤大小相关,但与浸润深度、淋巴结转移等病理特征的相关性需进一步开展大样本量的临床研究。此外,目前研究结果均提示HELLS在肿瘤靶向治疗中有很大机制,因此,还需进行HELLS在ESCC中的机制研究,为后续实现临床转化提供研究基础。
[1]Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI: 10.3322/caac.21492.
[2]Raabe EH, Abdurrahman L, Behbehani G, et al. An SNF2 factor involved in mammalian development and cellular proliferation [J]. Dev Dyn, 2001, 221(1): 92-105. DOI: 10.1002/dvdy.1128.
[3]Yang R, Liu G, Han L, et al. MiR-365a-3p-mediated regulation of HELLS/GLUT1 axis suppresses aerobic glycolysis and gastric cancer growth [J]. Front Oncol, 2021, 11: 616390. DOI: 10.3389/fonc.2021.616390.
[4]Hou X, Yang L, Wang K, et al. HELLS, a chromatin remodeler is highly expressed in pancreatic cancer and downregulation of it impairs tumor growth and sensitizes to cisplatin by reexpressing the tumor suppressor TGFBR3 [J]. Cancer Med, 2021, 10(1): 350-364. DOI: 10.1002/cam4.3627.
[5]Chen D, Maruschke M, Hakenberg O, et al. TOP2A, HELLS, ATAD2, and TET3 are novel prognostic markers in renal cell carcinoma [J]. Urology, 2017, 102: 265.e1-265.e7. DOI: 10.1016/j.urology.2016.12.050.
[6]Law CT, Wei L, Tsang FH, et al. HELLS regulates chromatin remodeling and epigenetic silencing of multiple tumor suppressor genes in human hepatocellular carcinoma [J]. Hepatology, 2019, 69(5): 2013-2030. DOI: 10.1002/hep.30414.
[7]Liu X, Hou X, Zhou Y, et al. Downregulation of the helicase lymphoid-specific (HELLS) gene impairs cell proliferation and induces cell cycle arrest in colorectal cancer cells [J]. Onco Targets Ther, 2019, 26, 12: 10153-10163. DOI: 10.2147/OTT.S223668.
[8]Zhu W, Li LL, Songyang Y, et al. Identification and validation of HELLS (helicase, lymphoid-specific) and ICAM1 (intercellular adhesion molecule 1) as potential diagnostic biomarkers of lung cancer [J]. PeerJ, 2020, 8: e8731. DOI: 10.7717/peerj.8731.
[9]Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM [J]. Ann Surg Oncol, 2010, 17(6): 1471-1474. DOI: 10.1245/s10434-010-0985-4.
[10]Ren J, Briones V, Barbour S, et al. The ATP binding site of the chromatin remodeling homolog Lsh is required for nucleosome density and de novo DNA methylation at repeat sequences [J]. Nucleic Acids Res, 2015, 43(3): 1444-1455. DOI: 10.1093/nar/gku1371.
[11]Yu W, McIntosh C, Lister R, et al. Genome-wide DNA methylation patterns in LSH mutant reveals de-repression of repeat elements and redundant epigenetic silencing pathways [J]. Genome Res, 2014, 24(10): 1613-1623. DOI: 10.1101/gr.172015.114.
[12]Yang X, Miao BS, Wei CY, et al. Lymphoid-specific helicase promotes the growth and invasion of hepatocellular carcinoma by transcriptional regulation of centromere protein F expression [J]. Cancer Sci, 2019, 110(7): 2133-2144. DOI: 10.1111/cas.14037.
[13]Zhang G, Dong Z, Prager BC, et al. Chromatin remodeler HELLS maintains glioma stem cells through E2F3 and MYC [J]. JCI Insight, 2019, 4(7): e126140. DOI: 10.1172/jci.insight.126140.
[14]Ren J, Finney R, Ni K, et al. The chromatin remodeling protein Lsh alters nucleosome occupancy at putative enhancers and modulates binding of lineage specific transcription factors [J]. Epigenetics, 2019, 14(3): 277-293. DOI: 10.1080/15592294.2019.1582275.
[15]Niu J, Chen T, Han L, et al. Transcriptional activation of the senescence regulator Lsh by E2F1 [J]. Mech Ageing Dev, 2011, 132(4): 180-186. DOI: 10.1016/j.mad.2011.03.004.
[16]Zocchi L, Mehta A, Wu SC, et al. Chromatin remodeling protein HELLS is critical for retinoblastoma tumor initiation and progression [J]. Oncogenesis, 2020, 9(2): 25. DOI: 10.1038/s41389-020-0210-7.
[17]Jiang Y, Mao C, Yang R, et al. EGLN1/c-Myc induced lymphoid-specific helicase inhibits ferroptosis through lipid metabolic gene expression changes [J]. Theranostics, 2017, 7(13): 3293-3305. DOI: 10.7150/thno.19988.

