MF59和甘油-3-磷酸复合佐剂对甲型H1N1流感抗原体液免疫效果的作用
王 珂 毛双双 马心怡 李玉卓 李雅林
山东第一医科大学(山东省医学科学院)临床与基础医学院,山东泰安 271000
甲型H1N1流感是由甲型流感病毒感染引起的急性呼吸系统传染病,传染性强且危害严重[1]。现行流感疫苗产能远不能满足控制流感大流行的实际需求,且存在一定不良反应和保护作用时间短等问题,因此开发更安全、更有效的新型甲型H1N1流感疫苗势在必行[2]。佐剂具有增强疫苗免疫效果的独特优势,有增强免疫反应低下人群如婴幼儿和老年人的免疫应答效应、增强抗原的免疫原性、加速对疫苗的反应、节省剂量等优点。现行流感疫苗使用的铝佐剂、MF59和AS03是影响目前甲型H1N1疫苗效果的重要因素[3-5]。尽管MF59佐剂甲型H1N1疫苗在保护率方面优于铝佐剂和AS03佐剂疫苗,但保护率仍不理想。近年来,甘油-3-磷酸(glycerol-3-phosphate,G3P)作为糖酵解和脂肪代谢过程的重要组成部分,被发现是一种安全、高效的佐剂[6]。鉴于MF59为佐剂的流感疫苗保护率不理想,以及G3P佐剂的安全性较好,本研究拟制备复合佐剂MF59和G3P,探讨复合佐剂用于甲型H1N1流感疫苗的效果,为未来开发人用新型甲型H1N1流感疫苗提供实验依据。
1 材料与方法
1.1 实验动物
健康8周龄雌性BALB/c小鼠,50只,鼠龄8周,体质量18~22 g,购自北京维通利华实验动物技术有限公司。所有动物均在山东第一医科大学实验动物中心SPF级环境饲养。本研究经山东第一医科大学动物伦理委员会审核通过。
1.2 试剂与仪器
Span-85购自于上海阿拉丁生化科技股份有限公司。Tween-80和角鲨烯、胰酶均购自于北京索莱宝科技有限公司。G3P购自上海麦克林生化科技有限公司。甲型H1N1流感裂解疫苗,购自北京天坛生物制品有限公司,0.5 mL/支,总蛋白含量169µg/mL,血凝素(hemagglutinin,HA)含量30.2µg/mL。编码全长HA(A/California/05/2009)和NA(A/Ohio/07/2009)的cDNAs由人工合成,并克隆到哺乳动物表达载体pVRC的多克隆位点中,由中国疾病预防控制中心病毒所提供。受体破坏酶(receptor destroying enzymes,RDE),购自美国Sigma公司。HRP标记的羊抗小鼠IgG购自上海碧云天生物技术公司。本研究用到的主要仪器有生物安全柜(香港力康生物医疗科技控股有限公司,HFSafe1200LC)、乳化机(南通博莱德机械科技有限公司,AYD-100)、酶标仪(上海赛默飞世尔,Multiskan FC)、荧光显微镜(日本奥林巴斯,BX53)。
1.3 方法
1.3.1 制备MF59佐剂[7]将Tween−80、Span 85、角鲨烯和10 nM柠檬酸钠分别按照体积比0.5%(2.5 mL)、0.5%(2.5 mL)、4.3%(21.5 mL)和94.7%(473.5 mL)进行混合,用乳化剂乳化10 min,变成乳白色匀质状,制成MF59乳剂,用0.22µm滤膜过滤除菌备用。
1.3.2 制备MF59和G3P复合佐剂甲型H1N1流感疫苗 分别将MF59(250µL)、G3P(2 mg),单独或二者一起和甲型H1N1流感抗原(含2.5µg HA)按一定比例混合,制成0.5 mL体积,在2~8℃中保存或直接进行免疫。
1.3.3 动物实验分组及免疫方案 选取8周龄雌性BALB/c小鼠,将50只小鼠分5组:空白对照组、单纯甲型H1N1流感抗原组、甲型H1N1流感抗原+MF59佐剂组(简称MF59佐剂组)、甲型H1N1流感抗原+G3P佐剂组(简称G3P佐剂组)、甲型H1N1流感抗原+MF59和G3P复合佐剂组(简称复合佐剂组)。单纯甲型H1N1流感抗原组腹腔注射甲型H1N1流感抗原0.5 mL,其他组进行腹腔注射0.5 mL疫苗,空白组腹腔注射等量0.01 M PBS(pH 7.2~7.4)。于第0天和第28天进行免疫2次。于初免后第28天和初免后第42天即第二次加强免疫后2周,于尾静脉采血,分离血清待检。
1.3.4 疫苗安全性检测[8]接种后连续3 d观察小鼠有无明显异常,如蜷缩、流泪、体质量减轻,重点观察鼻孔及口腔处是否有炎症、溃疡及脱毛现象,并抽检接种部位有无溃疡。
1.3.5 抗H1N1特异性抗体ELISA检测[9]将重组HA用包被液稀释至2µg/mL,加至96孔酶标板中,每孔100µL,4℃包被过夜。用洗液洗板3次,每孔加入100µL封闭液,37℃温育1 h。用稀释液将血清样品从1∶100开始2倍系列稀释,每孔100µL,37℃温育1 h。用洗涤液洗板3次,每孔加入10µL HRP标记的羊抗小鼠IgG,37℃温育1 h。洗板3次,加入底物液100µL。显色10 min,加入100µL终止液,用酶标仪测定OD492nm值。
1.3.6 血凝抑制试验检测血凝抗体效价[9]按常规方法用生理盐水将鸡红细胞配成1%溶液。分别取每个血清样品4µL,加入RDE 16µL,混匀,37℃过夜。次日,将经RDE处理后的血清于56℃水浴50 min以灭活多余的RDE。以2009 H1N1灭活全病毒(380µg/mL)为抗原,用生理盐水稀释至2µg/mL,从原液开始,按倍比稀释法连续稀释至1∶64稀释度,每孔50µL加入96孔圆底板中。每孔再加入生理盐水50µL,1%鸡红细胞50µL,室温放置45 min。判定抗原的血凝效价,以出现完全凝集的HA最高稀释度为1个血凝单位。将RDE处理的血清用生理盐水从1∶100开始2倍系列稀释,每孔50µL。用生理盐水将抗原稀释成4个血凝单位,每孔50µL,室温作用1 h。每孔加入1%鸡红细胞50µL,室温作用45 min后观察结果。以出现完全抑制的血清最高稀释度的倒数为血凝抗体效价。
1.3.7 流感病毒假病毒的制备及假病毒中和试验 按常规脂质体转染方法,将质粒25µg(其中HA∶NA∶gag-MuLV∶EGFP-MuLV=3∶3∶10∶10)转染50%融合的293 T细胞,转染72 h后,收集细胞培养上清,3 000 r/min 4℃离心10 min,取上清冻存于-70℃。胰酶消化A549细胞,重悬于50 mL DMEM完全培养基,取100µL加入96孔细胞板,18~24 h后进行中和试验。按1∶50的体积比向假病毒中加入10 mg/mL胰酶,37℃水浴1 h。用DMEM完全培养基在96孔细胞板上从1∶20开始倍比稀释血清样品,每孔50µL。将上述经预处理的假病毒加入已稀释的待测血清中,每孔50µL,室温孵育1 h,转移到细胞培养板中,于细胞培养箱中培养48 h,在荧光显微镜下计数每孔GFP阳性细胞数,并计算90%中和抗体滴度。
1.4 统计学分析
采用SPSS 22.0软件进行数据统计分析,计量数据采用均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用q检验。检验水准α=0.05。
2 结果
2.1 疫苗安全性检测
接种后连续3 d观察各组小鼠均未发现小鼠有明显异常,无蜷缩、流泪、体质量减轻;鼻孔及口腔处均无明显炎症、溃疡及脱毛现象;抽检的接种部位未见溃疡;生活习性均正常。表明制备的疫苗具有良好的安全性。
2.2 免疫后小鼠血清抗H1N1 IgG水平检测
各实验组小鼠接受流感疫苗免疫接种后,小鼠血清中的抗H1N1 IgG抗体水平逐渐升高,而对照组小鼠无抗体产生。MF59佐剂组和G3P佐剂组抗H1N1 IgG均高于单纯流感抗原组(P<0.05),而MF59和G3P复合佐剂组抗H1N1 IgG最高,高于MF59佐剂组和G3P佐剂组,差异均具有统计学意义(P<0.05),详见表1。
表1 不同组小鼠血清中抗H1N1 IgG抗体滴度比较(±s)(GMT,Log10)
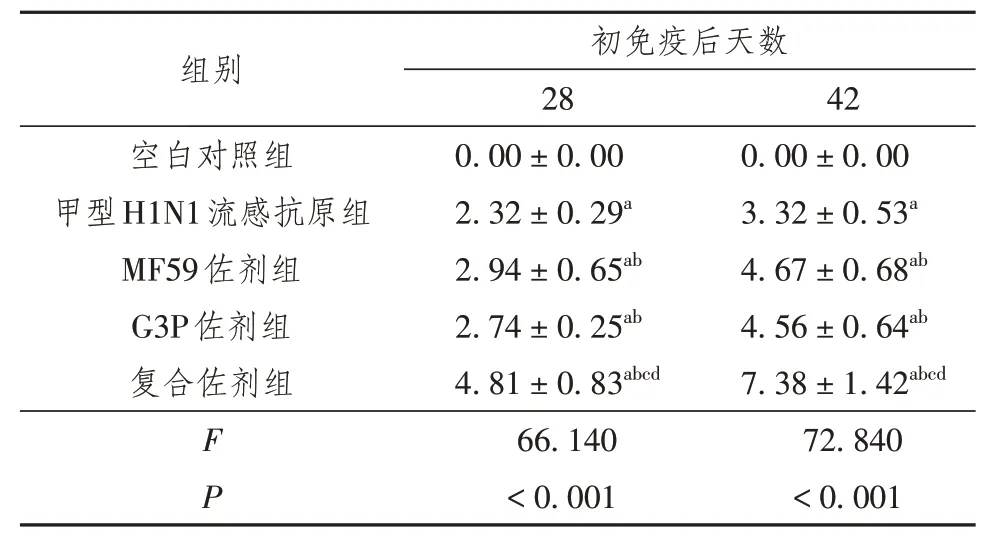
表1 不同组小鼠血清中抗H1N1 IgG抗体滴度比较(±s)(GMT,Log10)
注:G3P为甘油-3-磷酸;与空白对照组比较,a P<0.05;与流感抗原组比较,b P<0.05;与MF59佐剂组比较,c P<0.05;与G3P佐剂组比较,d P<0.05
组别空白对照组甲型H1N1流感抗原组MF59佐剂组G3P佐剂组复合佐剂组F P初免疫后天数28 0.00±0.00 2.32±0.29a 2.94±0.65ab 2.74±0.25ab 4.81±0.83abcd 66.140<0.001 42 0.00±0.00 3.32±0.53a 4.67±0.68ab 4.56±0.64ab 7.38±1.42abcd 72.840<0.001
2.3 血凝抑制(haemagglutination inhibition,HI)抗体测定结果
各实验组小鼠接受流感疫苗免疫接种后,小鼠血清中的抗H1N1 IgG HI抗体水平逐渐升高,而对照组小鼠无HI抗体产生。MF59佐剂组和G3P佐剂组HI水平均高于单纯流感抗原组(P<0.05),而MF59佐剂组和G3P复合佐剂组HI水平最高,高于MF59佐剂组和G3P佐剂组(P<0.05)。详见表2。
表2 不同组小鼠血清中流感病毒疫苗HI抗体滴度的比较( ±s)(GMT,Log10)

表2 不同组小鼠血清中流感病毒疫苗HI抗体滴度的比较( ±s)(GMT,Log10)
注:G3P为甘油-3-磷酸;与空白对照组比较,a P<0.05;与流感抗原组比较,b P<0.05;与MF59佐剂组比较,c P<0.05;与G3P佐剂组比较,d P<0.05
组别空白对照组甲型H1N1流感抗原组MF59佐剂组G3P佐剂组复合佐剂组F P初免疫后天数28 0.00±0.00 2.02±0.22a 2.44±0.46ab 2.35±0.46ab 3.81±0.64abcd 27.820<0.001 42 0.00±0.00 2.82±0.37a 3.46±0.59ab 3.25±0.45ab 4.85±0.64abcd 10.990<0.001
2.4 假病毒中和抗体测定结果
对上述免疫血清进行流感病毒假病毒的中和抗体滴度的测定。结果显示,与无佐剂单纯流感抗原组相比,MF59佐剂或G3P佐剂在初次免疫28 d后并没有提高中和抗体滴度,但加强免疫2周后可提高8倍。MF59和G3P复合佐剂诱导产生了更高滴度的中和抗体,初次免疫后可提高4~32倍,加强免疫后可提高16~64倍。详见表3。

表3 不同组小鼠免疫血清对2009 H1N1流感病毒假病毒的90%中和抗体滴度的比较
3 讨论
甲型H1N1流感病毒是人类最常见的流感病毒之一。在流感流行季节之前对人群进行流感疫苗接种可有效减少接种者感染流感机会或减轻流感症状[4]。目前全球使用的流感疫苗包括全病毒灭活疫苗、裂解疫苗和亚单位疫苗等,尽管各类流感疫苗已经能够大批量生产,但流感的全球发病率和死亡率仍不容忽视[5]。因此开发高效、普适、安全的流感疫苗对于预防流感的发生以及应对大流行性流感和季节性流感至关重要。
佐剂因具有增强疫苗免疫应答的作用而广泛用作疫苗的制备,MF59是一种水包油佐剂,它在许多国家被许可用于大流行性流感和季节性流感疫苗的生产。研究表明,MF59在人体内安全且耐受性良好[10-12]。最初将MF59与CpG联合使用是在流感领域,其诱导了高于单独佐剂的抗体滴度和Th1应答[13]。G3P是糖酵解和脂肪代谢过程的重要组成部分[14-15]。已有研究表明,G3P诱导甲型肝炎病毒(hepatitis A virus,HAV)产生特异性的抗HAV抗体效果明显好于铝佐剂的诱导效果,能够迅速产生免疫应答,是一种安全、高效的佐剂[16]。本研究制备了MF59佐剂,在此基础上制备了MF59和G3P复合佐剂流感疫苗、MF59流感佐剂疫苗、G3P佐剂流感疫苗以及单纯流感疫苗,于初免和加强免疫后通过ELISA检测抗H1N1 IgG抗体水平分析疫苗的体液免疫效果,通过HI试验检测HI抗体滴度和假病毒中和试验评价体液免疫的保护效果。结果发现各组小鼠均无不良反应,表明疫苗有良好的安全性。MF59和G3P复合佐剂组通过腹腔免疫诱导抗H1N1 IgG的水平最高,HI抗体最高,假病毒中和抗体滴度最高,优于MF59佐剂组和G3P佐剂组,表明复合佐剂疫苗具有增强甲型H1N1流感疫苗效果的显著优势。本研究为开发用于人的新型甲型H1N1流感疫苗提供了实验依据。尽管本研究取得初步结果,但由于实验条件限制,未深入研究复合佐剂流感疫苗诱导体液免疫作用的机理,在今后的工作中,将深入研究复合佐剂H1N1流感疫苗诱导体液免疫的作用机制。
利益冲突所有作者均声明不存在利益冲突

