错株种植和增施菌肥对太白贝母光合特性、产量及品质的影响
张建海,王向平,冯彬彬,周晓旭,陈洪源,潘声旺,吴翠色
(1.重庆三峡医药高等专科学校,重庆 404120; 2.河南省洛阳市洛龙区农林技术推广站,河南洛阳 471023;3.成都大学,成都 610106;4.重庆市神女药业股份有限公司,重庆 404700)
太白贝母(FritillariataipaiensisP.Y.Li)为《中国药典》2020年版(一部)川贝母的基源植物之一[1],具有很高的药用价值[2-3]。目前川贝母类资源匮乏,太白贝母是人工种植成功的极少数川贝母品种之一,但太白贝母在中国种植规模小,产量低,如何提高其产量和品质为太白贝母规范化种植提出了新的课题。目前有关太白贝母的研究报道主要在农残、重金属、提取研究等[4-5],而种植密度不变,适当地改善植株的布局,可以缓解植物的叶片重叠、透光率下降等的影响,从而提高植物对光照的利用率,提高植物的产量[1-2,6-7]。同时AM真菌与植物形成共生体,可促进宿主植物对土壤矿质元素和水分的吸收,调节植株代谢活动,提高植物抗逆性,从而促进植物生长。笔者课题组前期研究表明,不同AM真菌均可不同程度改善太白贝母的生长,对太白贝母的产量和品质提升有较大作用[3,8]。因此,研究植株不同配置方式与增施菌肥对太白贝母生理特性的调控机理、品质和产量形成具有重要的理论指导意义。本试验在前期工作的基础上[3],旨在通过研究太白贝母错株配置方式辅以菌肥对中药材太白贝母生长发育的影响,探索配置方式配合植物菌肥对太白贝母光能利用率及产量形成的调控机理,为太白贝母的规范化种植、提高产量提供试验基础。
1 材料与方法
1.1 试验地概况
本试验于 2018-2019 年在重庆巫山笃坪(重庆市神女药业股份有限公司)太白贝母种植基地和重庆三峡医药高等专科学校(国家级三峡库区中药种植与加工协同创新中心)进行。基地属于亚热带季风气候,海拔约1 900 m,年平均气温12 ℃左右,年平均日照数1 180 h,土壤为棕壤土,土壤肥力高,种植太白贝母基地土壤基础地力养分情况见表 1。

表1 太白贝母种植区土壤养分含量Table 1 Nutrition content of Fritillaria taipaiensis P. Y. Li in soil
1.2 试验材料
太白贝母产自重庆巫山笃坪太白贝母基地,经重庆三峡医药高等专科学校付绍智教授鉴定为百合科贝母属太白贝母[FritillariataipaiensisP. Y. Li(属于川贝母)]。于2018年、2019年9月底至10月初在基地进行鳞茎移栽。
供试西贝母碱苷(批号111917-201202)、贝母碱甲(批号110750- 201612)、贝母碱乙(批号110751-201712)、贝母辛(批号111892-201402)对照品,均购自中国食品药品检定研究院;聚丛球囊霉[Glomusaggregatum(GA)]和地表球囊霉[Glomusversiforme(GV)]均购自北京市农林科学院植物营养与资源研究所中国AM真菌种质资源库。
SPAD-502 Plus 叶绿素计(Konica Minolta),高效液相色谱仪(Agilent1260);1860PC紫外可见分光光度计等;LI-6400便携式光合作用测定仪;M-PEA 植物效率仪。
1.3 试验设计
2018年和2019年9月底10月初分别采挖 4 a鳞茎进行移栽,数据取2 a的平均值,试验小区为常规种植区(A1)、常规种植+增施菌肥(地表球囊霉)区(A2)、常规种植+增施菌肥(聚丛球囊菌)区(A3)、常规种植+增施菌肥(地表球囊霉+聚丛球囊霉)区(A4)及错株种植区(B1)、错株种植+增施菌肥(地表球囊霉)区(B2)、错株种植+增施菌肥(聚丛球囊霉)区(B3)和错株种植+增施菌肥(地表球囊霉+聚丛球囊霉)区(B4),每小区种植设计为1 m×1 m,行株距为10 cm×10 cm,每个小区种植太白贝母约100株,每个处理设置3个重复小区。参照课题组前期试验结果[8],增施菌肥的各小区分别施相对应的菌肥500 g,其他日常管理均按照太白贝母常规管理方式进行。错株种植模式为不同行每株是斜向排列,常规种植模式为不同行每株平行排列,所有试验均在大棚中进行。
1.4 测定项目与方法
1.4.1 太白贝母生长指标的测定 于太白贝母开花前叶片完全伸展后,分别取不同处理区域的太白贝母10株进行测定,测定每株太白贝母的叶片数,采用直尺或游标卡尺测定植株的高度、茎粗及叶片厚度。
1.4.2 太白贝母叶面积指数的测定 在太白贝母开花前20 d、开花期及开花后20 d分别选取不同处理小区太白贝母10株,利用直尺或游标卡尺测定叶片长度和中部宽度,计算太白贝母的叶面积和叶面积指数。叶面积指数(LAI)=A×ρ/S,公式中A代表单株叶面积;ρ代表单位土地面积株数;S代表单位土地面积。
1.4.3 太白贝母光合参数、光合色素含量及叶片荧光特性的测定 采用乙醇研磨法测定太白贝母光和色素含量[9],于太白贝母生长旺盛期的每天10:00左右,利用LI-6400便携式光合作用测定仪,于光照条件下测定太白贝母叶片净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)和蒸腾速率(Tr)[10]。
于太白贝母生长旺盛期的每天10:00左右,采用 M-PEA 植物效率仪测定光适应下的最大荧光(Fm’)、稳态荧光(Fs)等荧光参数;暗适应30 min后测定初始荧光(Fo)、最大荧光(Fm)和光系统Ⅱ的最大光化学效率(Fv/Fm)。
1.4.4 太白贝母保护酶系统及丙二醛(MDA)含量测定 于太白贝母生长旺盛期10:00左右,取0.5 g鲜叶片,加入8 mL磷酸缓冲液,冰浴中研磨,匀浆转入离心管,于4 ℃、8 000 r/min离心10 min,上清液用于保护酶系统测定。参照文献[11],超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑法,过氧化物酶(POD)活性的测定采用愈创木酚法,过氧化氢酶(CAT)活性的测定采用高锰酸钾滴定法,MDA含量的测定采用硫代巴比妥酸法,以上指标均采用紫外分光光度计测定。
1.4.5 鳞茎产量检查 收集地上部分枯萎前约20 d和10 d各组10株,及完全枯萎后收集每个处理组太白贝母的地下鳞茎,将每次采集的样本洗净,计算其单个鳞茎质量。
1.4.6 太白贝母品质检测 参照课题组前期测定方法[8],将不同小区太白贝母样品干燥粉碎后,测定不同处理组太白贝母中总生物碱、贝母辛、西贝母碱苷、贝母碱甲、贝母碱乙含量。色谱条件:色谱柱Agilent Extend-C18(4.0 mm×250 mm,5 μm),以0.03%二乙胺水-甲醇为流动相梯度洗脱,柱温30 ℃,流速1 mL/min,进样量10 μL。
1.5 数据分析
采用Excel 2010和SPSS 22软件对试验数据进行统计分析,用Bouferroni法进行方差分析。
2 结果与分析
2.1 错株种植和增施菌肥对太白贝母生长的影响
按照“1.4.1”的方法对各处理组太白贝母生长指标进行测定,结果见表2,同时将各组与对照组指标进行比较,结果见图1。
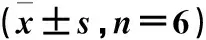
表2 不同处理组太白贝母的生长指标Table 2 Growth index of Fritillaria taipaiensis P.Y.Li under different

图1 不同处理太白贝母生长指标较对照提高比例的比较Fig.1 Comparison of growth indexes of Fritillaria taipaiensis P.Y.Li under different
由表2和图1可以看出,错株种植和增施菌肥对太白贝母的生长有一定的影响。不同处理组叶片数、株高、茎粗及叶片厚度等指标较对应的常规种植组高,除B1组外,各处理组均较常规种植组生长指标差异有显著性(P<0.05)。从试验数据可以看出,错株种植模式能使植株更加充分地利用光照,相对增加了株距,改善了株距密度;而菌肥可以和太白贝母根系形成良好的共生关系,从而促进植株生长;试验结果也显示,错株与菌肥配合使用,尽管都能改变植株的生长,但并不是二者的简单加和。
2.2 错株种植和增施菌肥对太白贝母叶面积及叶面积指数的影响
不同处理组叶面积和叶面积指数的测定结果见表3,对不同处理的叶面积和叶面积指数进行了比较,结果见图2。
从表3和图2可以看出,不同处理组叶面积和叶面积指数均比常规种植组高(A1组),其中增施菌肥+错株种植(B4组)开花前20 d、开花期、开花后20 d分别较常规种植组高出25.08%、 23.25%、23.95%;叶面积指数较常规组高出100.32%、97.36%、98.52%,差异有显著性 (P<0.05)。数据显示,错株种植模式改善了种植密度,调整了植株叶片空间排列,叶面积增大使植株光合面积增大,减弱了植株个体间对资源的竞争,从而达到增产目的。
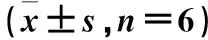
表3 不同处理太白贝母不同时期叶面积和叶面积指数Table 3 Leaf area and leaf area index of Fritillaria taipaiensis P.Y.Li in different periods under different

图2 不同处理太白贝母不同时期叶面积和叶面积指数比较Fig.2 Comparison of leaf area and leaf area index in different growth periods of Fritillaria taipaiensis P.Y.Li under different treatments
2.3 错株种植和增施菌肥对太白贝母光合参数、光合色素含量及叶片荧光特性的影响
不同处理太白贝母光合参数和光合色素含量测定结果见表4、表5,同时对太白贝母光合参数、光合色素含量及叶片荧光特性进行比较分析,结果见图3。
由图3和表4可以看出,太白贝母净光合速率(Pn)、气孔导度(Gs)等光合参数各组均较常规组(A1组)高,其中B2、B3、B4组较A1组净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)和蒸腾速率(Tr)分别高出25.87%、43.59%和 68.82%;11.49%、18.05%和30.13%;37.83%、 44.68%和62.61%;15.34%、29.63%和 44.10%;由图3和表5可以看出,各组光合色素含量均较常规种植组(A1组)高,其中B2、B3、B4组较A1组光合色素含量有显著性差异(P< 0.05);由图3可以看出,PSⅡ的最大光化学量子产量(Fv/Fm)不同处理组均较常规种植组都有所增加,不同菌肥组较常规种植组有显著性差异 (P<0.05),错株种植较常规种植组Fv/Fm有所提高,错株种植加菌肥组具有显著性差异 (P<0.05),且A4组Fv/Fm最高。

图3 不同处理太白贝母光合参数、光合色素含量及叶片荧光特性比较Fig.3 Comparison of photosynthetic parameters,photosynthetic pigment content and leaf fluorescence characteristics under different treatments of Fritillaria taipaiensis P. Y. Li
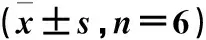
表4 不同处理组太白贝母的光合参数Table 4 Photosynthetic parameters of Fritillaria taipaiensis P.Y.Li under different
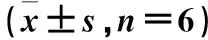
表5 不同处理组太白贝母的光合色素含量Table 5 Photosynthetic pigments of Fritillaria taipaiensis P.Y.Li under different
净光合速率等光合参数的增加、光合色素含量的增加及荧光特性的提高都说明错株种植增加了植株空间利用度,使植株利用光能的能力增加,有利于植株进行光合作用,有利于植株光合物质的合成;增施菌肥有利于根系的吸收,可以为光合作用提供更多的原料,从而促进光合作用。说明错株种植和增施菌肥有利于光合色素含量的累积,两种菌肥有较好的协同效应,对植物的生长有利。
2.4 错株种植和增施菌肥对太白贝母保护酶系统及MDA含量的影响
太白贝母保护酶系统及MDA含量测定结果见表6。对不同处理组太白贝母保护酶系统及MDA含量进行比较,结果见图4。
由表6和图4可以看出,菌肥和错株种植对太白贝母抗氧化系统的影响有所不同。SOD、CAT和POD活性与增施菌肥呈正相关,错株种植对抗氧化系统影响不大,不同菌肥对SOD、CAT和POD活性影响不同,较常规组有显著性差异(P<0.05),B4组效果最好;错株与菌肥配合使用能够提高SOD、CAT和POD活性,说明增施菌肥可以增强植株抗氧化的能力,减轻对细胞的伤害。
由表6和图4还可看出,不同处理组MDA含量与对照组比均有下降,B4处理效果最好;说明增施菌肥和错株种植可以降低植株膜脂过氧化应激下细胞损伤。试验数据显示增施菌肥对植株氧化酶系统保护较强,使植株未受破坏可正常生长。
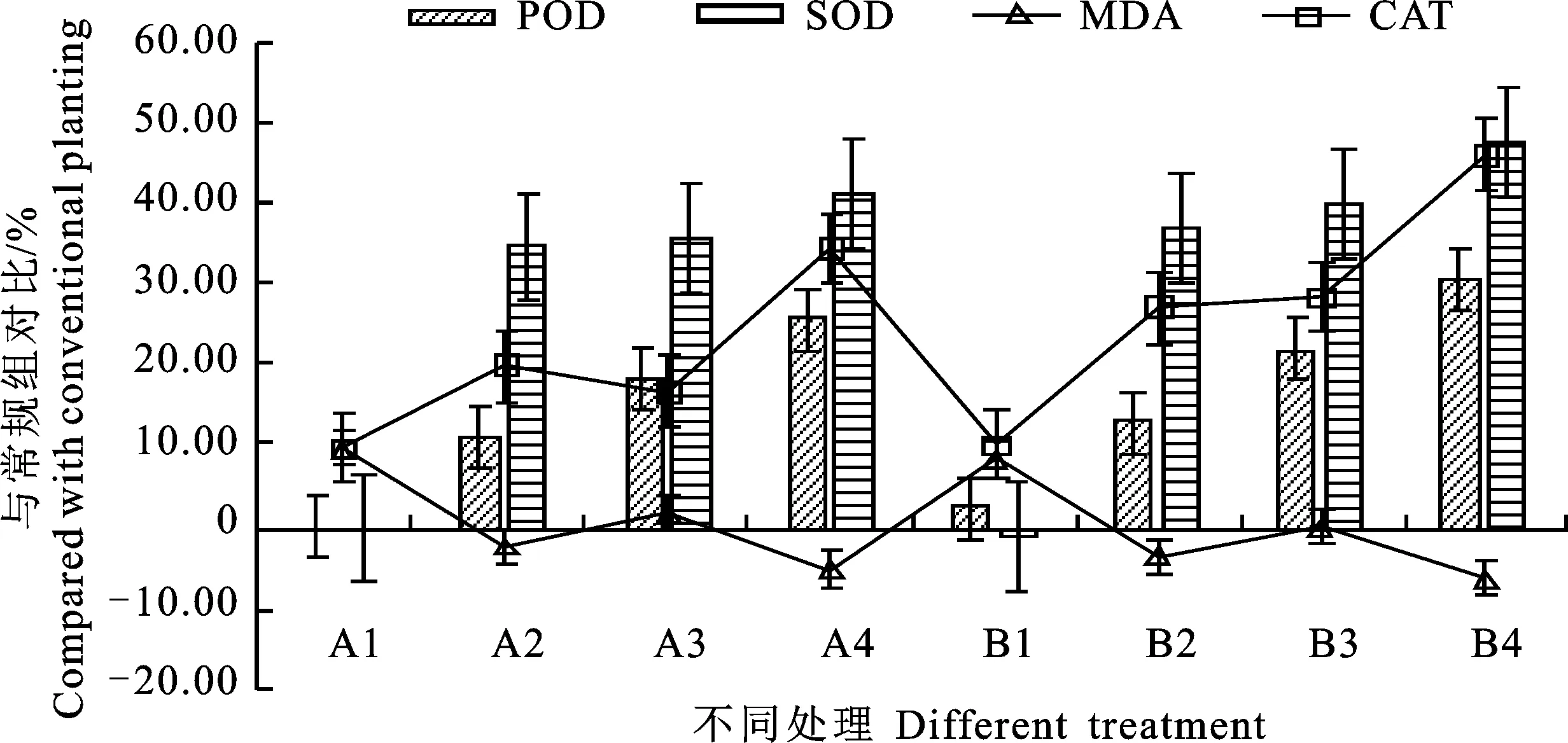
图4 不同处理太白贝母保护酶系统及MDA含量比较Fig.4 Comparison of the protective enzyme system and MDA content under different treatments of Fritillaria taipaiensis P.Y.Li
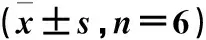
表6 不同处理组太白贝母保护酶系统及MDA含量Table 6 Protective enzyme system and content of Fritillaria taipaiensis P. Y. Li under different
2.5 错株种植和增施菌肥对太白贝母产量的影响
测定不同时期太白贝母鳞茎质量,确定其产量,测定结果见表7,并对不同测定结果进行比较分析,结果见图5。
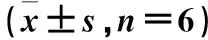
表7 不同处理下各时期太白贝母鳞茎产量Table 7 Bulb yield of Fritillaria taipaiensis P.Y.Li under different g
由图5和表7可以看出,不同处理组采收期产量均比采收前期产量有所提高,但差异没有显著性,不同处理组不同采收期产量差异较大(P<0.05);采收前期及采收期菌肥组较常规组有显著性差异(P<0.05)。错株种植尽管能提高产量,但不是主要因素;错株种植与菌肥合作,能显著提高产量(P<0.05),B4组产量最高,说明菌肥和错株种植通过增强光合作用,延缓植株衰老,可以有效提高太白贝母产量,在实际生产上具有指导意义。

图5 不同处理太白贝母鳞茎产量比较Fig.5 Comparison of bulb yield of Fritillaria taipaiensis P. Y. Li under different treatments
2.6 错株种植和增施菌肥对太白贝母品质的影响
太白贝母鳞茎含量测定结果见表8,同时将各成分含量与对照组进行比较,结果见图6。
由图6和表8可以看出,太白贝母不同处理组较常规种植组(A1组)有效成分的含量有所提高,各组提高幅度有所不同,最高为错株种植和增施菌肥联合处理组。其中错株种植+增施菌肥组(B4组)总生物碱、贝母辛、西贝母碱苷、贝母碱甲和贝母碱乙的含量较常规种植组(A1组)分别提高41.73%、43.27%、26.32%、19.57%、30.58%,差异均具有显著性(P<0.05)。数据显示,错株种植模式和增施菌肥通过提高植株生长指标和光合参数等能力,可以影响植株新陈代谢,有利于植株各成分含量的积累。
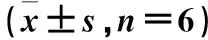
表8 不同处理组太白贝母主要成分含量Table 8 Content of main components of Fritillaria taipaiensis P. Y. Li under different treatments mg/g

图6 不同处理太白贝母品质比较Fig.6 Comparison of quality of Fritillaria taipaiensis P. Y. Li under different treatments
3 讨 论
3.1 错株种植和增施菌肥对太白贝母生长的影响
错株种植有利于植物的生长发育,表现出高效的冠层潜势[12]。张春雨等[6]研究发现错株种植对提高产量有一定的作用。本试验探讨错株种植对太白贝母叶片数量、叶片厚度、茎粗等农艺性状的影响,结果显示种植密度相同时,错株种植的太白贝母叶片分化、株高、茎粗、叶厚等各项生长指标均高于常规种植。说明种植模式与植物的冠层潜势有着密切关系,进而可以推测错株种植从某种意义上来说是增加了株距,改善了株间密度,与植物的冠层潜势有着密切关系,同时也与植物根的分布有关。已有研究发现,AM真菌能显著提高植物的地上生物量、株高、茎粗等农艺性状[13-14]。本试验结果表明不同AM真菌能显著提高太白贝母植物的叶片数、株高、茎粗、叶厚,可能的原因是AM真菌改善植物根系对营养物质的吸收,调节植物激素的合成与分配,全方面地改善植物的生长状况,促进植物的生长和发育,同时错株种植和增施菌肥组对植株农艺性状有协同作用。
3.2 错株种植和增施菌肥对太白贝母光合参数、光合色素含量和叶片荧光特性的影响
光合色素(photosynthetic pigment)在光合作用中参与吸收、传递光能并引起原初光化学反应。张春雨等[6]研究发现,错株种植能提高植物的光合参数,邹慧等[15]研究发现AM真菌显著提高植物的光合参数,促进植物的生长。本试验结果发现,错株种植和增施菌肥均较常规种植净光合速率、蒸腾速率、气孔导度和胞间CO2浓度有所提高,其中错株种植和增施菌肥联合效果最佳,表明菌肥促进了植物对营养元素的吸收,增强了光合作用,促进了植株对养分和光照的利用;而错株种植使得在相同密度下等行距错株的太白贝母间竞争削弱,从而优化植株叶片的平展,使叶片光合面积增大,充分利用光能,增强植株的光合作用,研究结果与文献一致[16-18]。
叶绿素是植物光合作用的重要物质,是捕获光能、同化CO2的主要色素,在一定范围内,叶绿素含量越高,光合作用越强[18-19],姚万山等[20]研究也显示,延长绿叶的持续期是高产的保证,本试验结果表明,错株种植太白贝母可以提高光合色素的含量,增强太白贝母光合作用,与文献报道一致;接种AM真菌能显著提高光合色素含量,这与李文彬等[21]的研究结果一致;试验表明接种AM真菌能显著提高太白贝母光能转化效率Fv/Fm,不同处理效果有所不同,错株种植和增施菌肥混合处理效果最佳,这与欧静等[22]的结果相符,错株种植对太白贝母光能转化效率Fv/Fm的改善,可能与叶片吸收的光能增加有关。由此可见,错株种植可增强植株的光合性能,净光合速率有所提高,延缓了植株的衰老,有利于光合性能的保持,同时联合增施菌肥促进作用更显著。
3.3 错株种植和增施菌肥对太白贝母保护酶系统及MDA含量的影响
POD、SOD和CAT是植物抗氧化系统中的主要酶,其活性水平反应植物受外界逆境影响的进程,其中SOD是植物细胞中重要的活性氧清除酶之一,CAT和POD能分解H2O2,减轻细胞损伤,保证植物的正常生长。研究发现接种AM真菌对猕猴桃光合作用和三大保护酶的效应均显著高于对照组[22-23]。张建海等[8]前期研究发现AM真菌能有效提高太白贝母SOD、POD和CAT活性,延缓太白贝母衰老进程。本试验结果表明,单施AM真菌组、错株种植和AM真菌组合组能显著改善三大保护酶的效应,提高三大保护酶的活性。可能是由于错株种植改变了植株通风性能,提高了植株的抗逆性和光合作用。在植物生理过程中MDA是一个常量指标,其含量可以反映植物受逆境伤害的程度。本试验研究发现,AM真菌能减少MDA含量,错株种植尽管没有显著性,但是错株种植与AM真菌合施能显著减少MDA含量,减少对植物细胞的伤害。这与文献报道基本一致[18-20]。
3.4 错株种植和增施菌肥对太白贝母鳞茎产量和品质的影响
程俐陶等[24]研究发现AM真菌可通过促进药用植物矿质营养元素的吸收与利用,从而增加产量,改善品质。韦莉莉等[25]研究发现AM真菌能促进植物生长,提高产量。刘璐等[26]研究发现AM真菌接种使得广藿香叶片内的IAA含量提高,ABA含量降低,促进广藿香生长和干物质量的积累。张春雨等[6]研究发现错株种植对提高产量有一定的作用。郭巧生等[27]研究发现接种AM真菌能提高生物碱的含量。张建海等[8]研究发现AM真菌的侵染可明显影响太白贝母中总生物碱、贝母辛、西贝母碱苷、贝母碱甲、贝母碱乙的代谢,接种不同AM真菌均高于对照。本研究发现,影响品质的主要因素是增施菌肥,但是错株与增施菌肥组合对太白贝母品质的影响最佳,可能的原因,一是菌肥促使植物从土壤吸收更多的营养元素,二是错株种植可以相对降低种植密度,使光能利用率显著提高,尤其在产量形成的关键期,充足的光照条件有助于品质的提高,表明错株种植模式的光能利用率的维持能力更强,为植株的产量和品质提供有利的条件。
综上认为,错株种植和AM真菌对太白贝母的光合特性、产量及品质都会产生影响。本研究为后续太白贝母菌肥的开发奠定了基础。

