青花菜高温和盐胁迫相关LncRNAs的鉴定与表达特征分析
裴徐梨,荆赞革,唐 征,罗天宽
(1.昆明学院 农学与生命科学学院,昆明 650214;2.温州科技职业学院 农业与生物技术学院,浙江温州 325006)
长链非编码RNA(Long non-coding RNA,LncRNA)是一类长度大于200 nt且没有长开放阅读框的RNA[1]。LncRNAs在真核生物中普遍存在,其含有较少的内含子及较低的表达水平。LncRNAs根据其与相邻基因的相对位置可分为基因间LncRNAs、基因内LncRNAs及与编码序列反义LncRNAs。研究发现LncRNAs能在转录水平、转录后水平和表观遗传等层面调控生命进程[2-4]。目前,植物LncRNAs的研究相对较少,研究材料多集中在拟南芥、玉米、水稻、番茄等模式植物中。Enod40是第一个在植物中发现的LncRNA,其在蒺藜苜蓿体内发挥着重要生物功能[5]。前人通过ESTs、RNA-Seq等技术在拟南芥中鉴定得到13 000多条LncRNAs[6],研究发现这些LncRNAs参与了拟南芥的开花、逆境胁迫等多种生命进程。过表达LncRNA T5120可促进拟南芥对硝酸盐的同化,提高其生物量和根系的发育[7]。TaS1和TaS2的大量表达可以提高小麦对白粉病的抗性[8]。此外,过表达lncRNA LAIR可提高水稻产量及其邻近基因簇的表达[9]。在玉米中鉴定到3 488条LncRNAs,其中1 535条可响应干旱胁迫[10]。
高温和高盐对于青花菜的生长极为不利。青花菜花球的最佳形成温度为22 ℃,温度过高使花球形成受阻从而降低产量[11]。高盐胁迫使青花菜根系活力受到抑制,根系吸收能力下降,叶片光合作用受到严重影响[12]。因此,探讨青花菜在高温和盐胁迫下的响应机制对于青花菜生产具有重要的现实意义。
LncRNAs是转录组的重要组成部分,在植物器官发育[13]、生物[14]和非生物胁迫[15]等过程中起着重要的调控作用。本研究成功构建青花菜高温和盐胁迫的LncRNAs文库,并进行差异 LncRNAs的鉴定、靶基因注释以及表达特征等分析,研究结果为进一步分析LncRNAs在青花菜高温和盐胁迫下的调控机制提供一定的基础。
1 材料与方法
1.1 试验材料
以青花菜(Brassicaoleraceavar.italica)高代自交系‘WN12-95B’为试验材料,种植于光照培养箱内(白天:16 h光照,25 ℃;夜晚:8 h黑暗处理,18 ℃;相对湿度:85%),5叶期时进行高温(38 ℃)和盐(200 nm/L NaCl)胁迫处理,处理时间为3 h和12 h,以0 h为对照。胁迫处理设3次生物学重复。处理结束后,取第3片叶用于高通量测序和qRT-PCR分析。
1.2 青花菜总RNA提取及RNA文库构建
提取叶片总RNA,经检测合格后,进行文库构建,于北京组学生物科技有限公司进行高通量测序。
1.3 高通量测序数据分析
测序所得的原始数据(raw data)经处理后,对产出数据进行分析和统计。利用TopHat2 软件[16]将clean reads与甘蓝基因组进行序列比对,获取序列特征信息。
1.4 青花菜LncRNAs鉴定
使用Cufflinks和Scripture软件对转录本进行拼接[17]。根据LncRNAs的结构以及非编码功能特点,筛选候选lincRNA、intronic LncRNA、anti-sense LncRNA类型的转录本。具体筛选步骤参照Zhang等[18]的进行。
1.5 青花菜LncRNAs差异表达分析
采用FPKM法计算LncRNAs的表达水平。差异表达LncRNAs的检测标准为:|Fold Change|≥ 2且FDR<0.01。对筛选出的差异表达LncRNAs使用Cluster 3.0软件进行层次聚类分析[19]。
1.6 青花菜LncRNAs靶基因预测
采用LncTar软件对鉴定得到的LncRNAs进行cis靶基因预测[20]。trans作用靶基因根据Pearson相关系数法进行预测。
1.7 青花菜差异表达LncRNAs靶基因功能注释和富集分析
对cis、trans作用模式下的差异表达LncRNAs靶基因进行GO和KEGG注释,并进行富集分析。
1.8 青花菜差异LncRNAs表达特征分析
从表达量变化较大的LncRNAs中随机挑选10个LncRNAs进行qRT-PCR验证(表1),以actin为内参(F:GACAACTTACAACTCCATCAT;R:CTCATACGGTCAGCGATA)。反应过程依据SYBR Premix Ex Taq试剂盒(TaKaRa公司)说明书在ABI 7500(Applied Biosystems公司)上进行。反应总体系及反应程序参照Xu等[21]进行。每个反应设3次技术重复。定量数据处理采用2-ΔΔCT法[22]。

表1 LncRNAs的qRT-PCR特异性引物Table 1 LncRNAs-specific primers for qRT-PCR
2 结果与分析
2.1 测序结果的初步分析
在高温和盐胁迫文库中分别获得38 738 918(CK)、35 895 588(HEAT-3H)、38 622 915(HEAT-12H)、35 772 779 (SALT-3H)和35 764 013(SALT-12H)条clean pair-end reads。文库的平均GC含量为42.53%,Q30比例均大于91%(表2)。将clean reads比对到甘蓝基因组,结果分别得到47 111 785(CK)、45 815 806(HEAT-3H)、52 658 043(HEAT-12H)、49 140 771(SALT-3H)和49 700 942(SALT-12H)条单一比对序列,文库平均比对率约为75%。
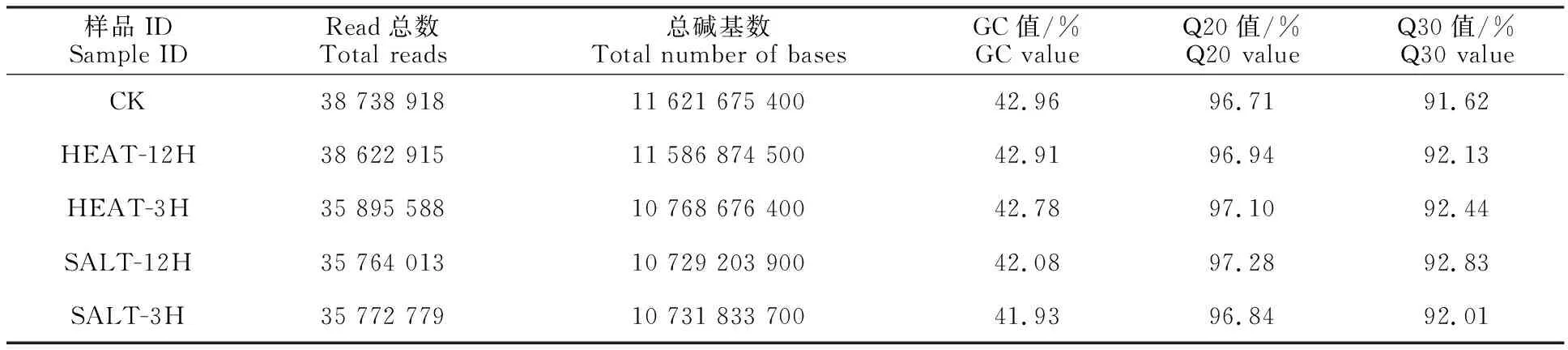
表2 青花菜转录组测序结果及数据质量汇总Table 2 Summary of transcriptome sequencing result and data quality in broccoli
2.2 青花菜LncRNAs鉴定结果分析
5个文库中共鉴定得到2 432条LncRNAs,其中31条为intronic RNA,79条为anti-sense RNA,2 322条为lincRNA。结构分析显示LncRNAs的长度较mRNA短,主要集中于200~ 2 600之间;外显子个数多为2~13个不等,也比mRNA少。
2.3 青花菜差异LncRNAs的鉴定
通过比较不同处理间的LncRNAs表达量,鉴定出差异LncRNAs分别为41(CK vs HEAT-3H)、43(CK vs HEAT-12H)、12(HEAT-3H vs HEAT-12H)和17(CK vs SALT-3H)、24(CK vs SALT-12H)和21(SALT-3H vs SALT-12H)条。其中96条LncRNAs上调表达,62条LncRNAs下调表达。
对差异LncRNAs进行聚类分析发现,高温胁迫下上调表达的LncRNAs数量较盐胁迫多,且变化幅度更大,两种胁迫处理后的差异LncRNAs表达模式差异较大(图1)。XLOC_002584在高温胁迫12 h的表达量为CK的18倍,但在盐胁迫中的表达量差异较小;XLOC_003847在高温胁迫过程中表达量变化趋势平缓,但在盐胁迫12 h表达量达到峰值,为CK的2倍;XLOC_005515在高温和盐胁迫处理后,表达量急剧 下降。
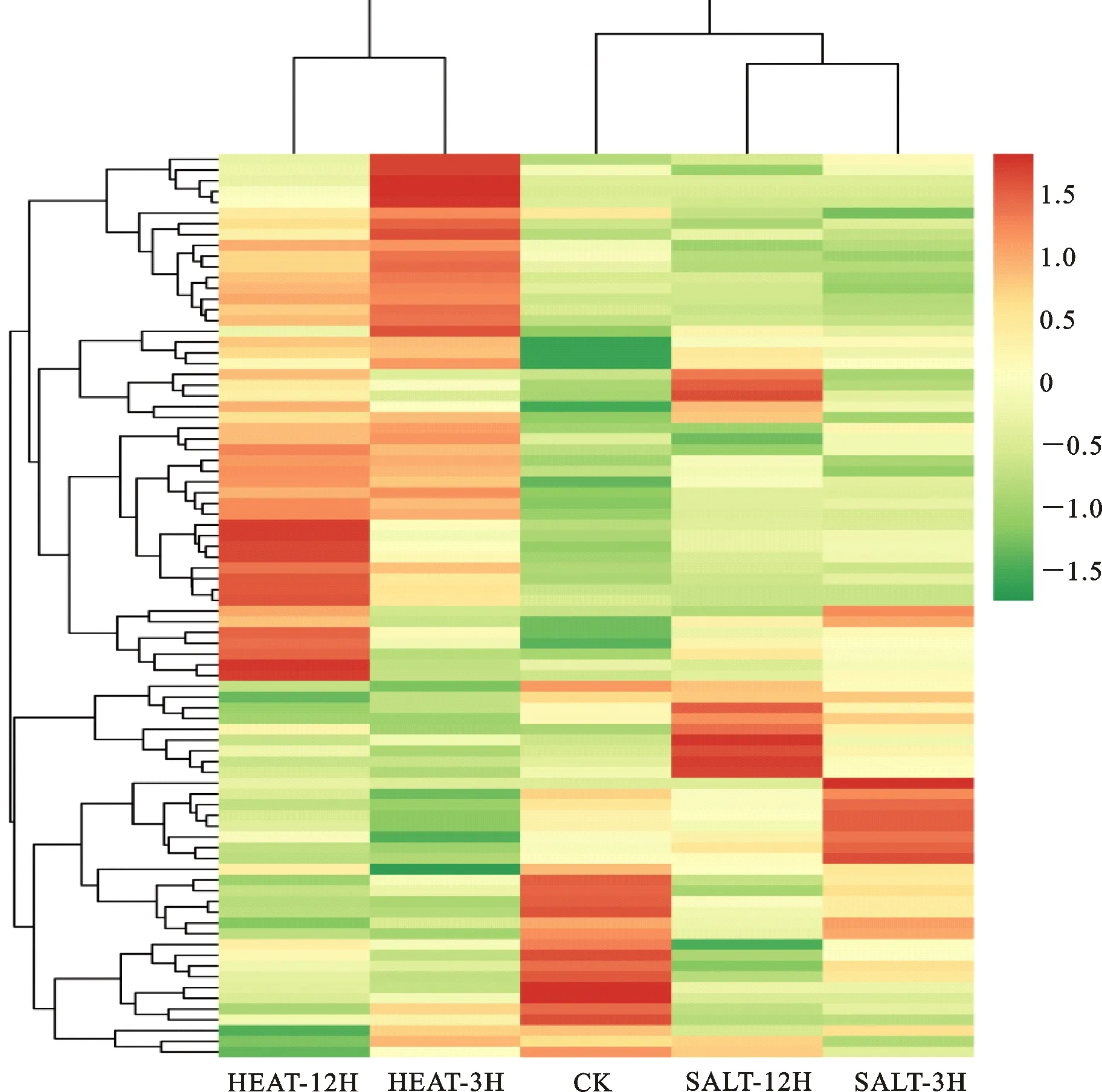
图1 青花菜差异表达LncRNAs的层次聚类分析Fig.1 Hierarchical clustering analysis of differentially expressed LncRNAs in broccoli
2.4 LncRNAs靶基因预测
为了探讨LncRNAs的调控网络,对筛选得到的LncRNAs进行靶基因预测。分别获得 8 891条cis作用靶基因和177 364条trans作用靶基因。部分靶基因罗列在表3。

表3 部分青花菜LncRNAs靶基因的代谢通路分析Table 3 Pathway analysis of partial target genes of LncRNAs in broccoli
对差异表达LncRNAs的cis作用靶基因进行分析,发现高温处理组中CK vs HEAT-3H与HEAT-3H vs HEAT-12H在3个类别中的富集数目相差不大,而在CK vs HEAT-12H中没有富集到生物过程条目;盐胁迫处理组中较多靶基因映射到分子功能条目。KEGG富集分析发现“核糖体相关”是高温处理中差异LncRNAs参与最多的pathway,而盐胁迫中“氧化磷酸化”和“植物激素信号转导”分别是CK vs SALT-3H和SALT-3H vs SALT-12H富集最多的途径。
对差异表达LncRNAs的trans作用靶基因进行分析,发现在GO分析的 3大域中生物过程是富集最多的条目,包括“DNA甲基化(DNA methylation)”“水杨酸胁迫反应(response to salicylic acid)”“胚胎发育(embryo development)”“H3-K9组蛋白甲基化(histone H3-K9 methylation)”等。KEGG结果显示富集量较多的靶基因参与了谷胱甘肽代谢、氨基酸合成、淀粉及糖代谢、半乳糖代谢以及脂肪酸延伸和代谢。
2.5 青花菜差异LncRNAs表达特征分析
使用qRT-PCR技术检测了10个差异LncRNAs在高温和盐胁迫下的表达模式,结果发现其表达模式与测序结果基本一致。XLOC_033957和XLOC_034964在盐胁迫的表达下调,在高温胁迫的表达量先下降再上升。XLOC_005515、XLOC_027154、XLOC_023592和XLOC_035830的表达量在高温胁迫下先下降再上升。但在盐胁迫中表达模式存在差异,XLOC_005515和XLOC_027154先下降后上升,而XLOC_023592和XLOC_035830的表达量逐渐下降。此外,XLOC_033671、XLOC_003826、XLOC_06988和XLOC_024730也具有相同的表达模式,在盐胁迫中持续上调表达,在高温胁迫中先上升后下降,高温胁迫3 h的表达量最高(图2)。
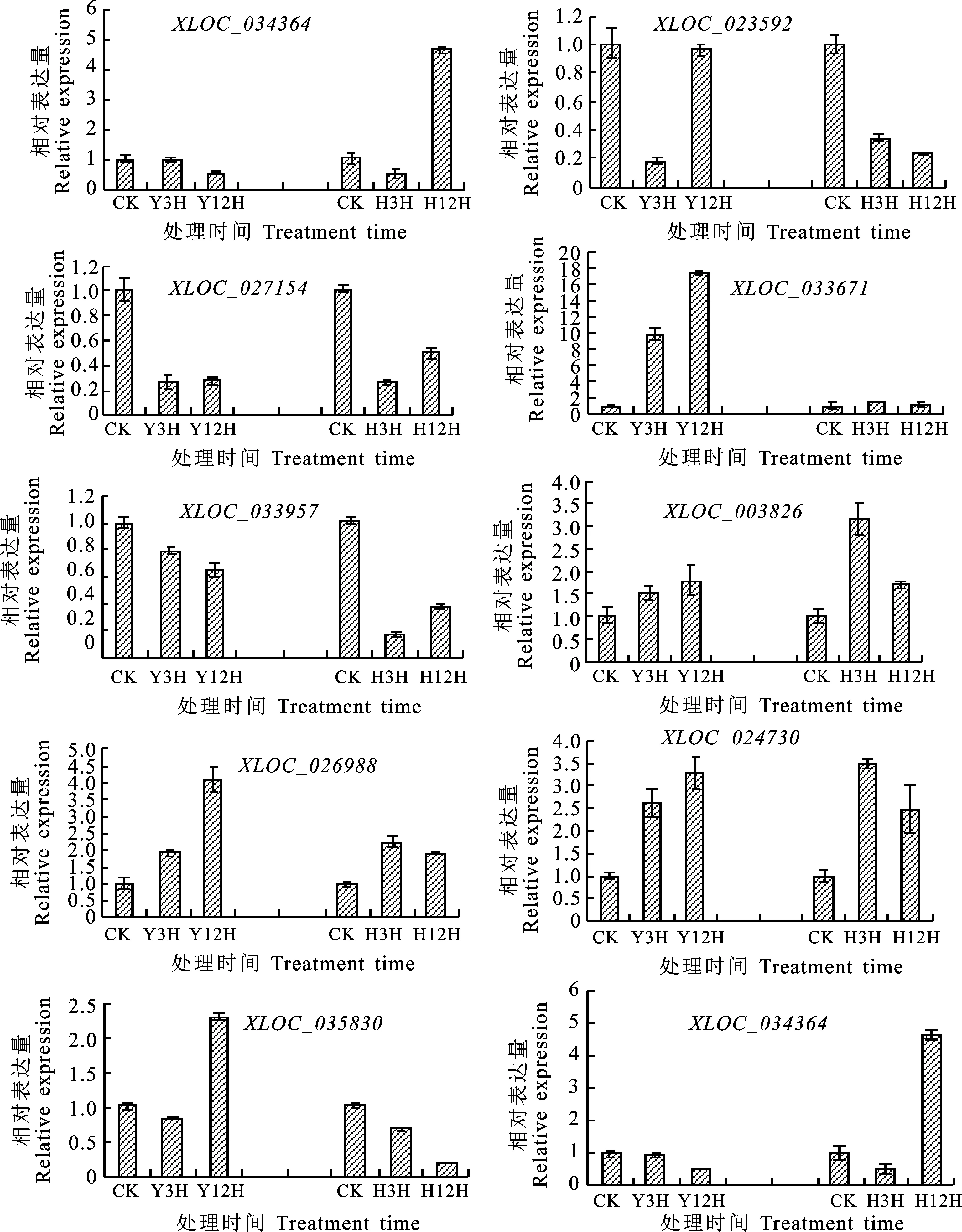
Y3H和Y12H分别代表盐胁迫3 h和盐胁迫12 h;H3H和H12H分别代表高温胁迫3 h和高温胁迫12 hY3H and Y12H represent 3 h and 12 h under salt stress treatment, respectively;H3H and H12H represent 3 h and 12 h under heat stress treatment, respectively图2 10个差异LncRNAs在青花菜高温和盐胁迫下的表达特征Fig.2 Expression characteristics of 10 differentially expressed LncRNAs under high temperature and salt stress in broccoli
3 讨 论
本研究构建了青花菜高温和盐胁迫的LncRNAs文库,获得184.77 M clean reads,平均每个文库36.95 M,此结果大于前人在青花菜种子及幼苗中测序得到的read数目[23]。更多的测序数量有利于表达量相对较低的LncRNAs的鉴定[24]。因此,本文的测序数据对于鉴定青花菜高温和盐胁迫LncRNAs具有较好的可靠度。筛选出的青花菜LncRNAs也符合LncRNAs的一般特征:长度、外显子数以及表达量均比mRNA小。
在盐胁迫条件下,氨基酸、蛋白质及其他激素类物质含量会发生变化,最终造成植物生理代谢紊乱[25]。氧化磷酸化相关的转录因子可调节胁迫响应基因的表达[26],而氧化磷酸化过程是青花菜差异LncRNAs的靶基因在盐胁迫中富集较多的途径之一。青花菜XLOC_035830的靶基因为氧化磷酸化酶,该LncRNAs的表达量先下降后上升,其靶基因Bol018386(coproporphyrinogen oxidase)的表达量下调,推测XLOC_035830通过调控氧化磷酸化酶基因的表达进行盐胁迫响应。乙烯和生长素是植物生长发育的重要激素,同时还是调控植物对非生物胁迫的重要因子[27]。本试验中XLOC_003579及其靶向的生长素基因(Bol019000)在青花菜盐胁迫过程中表达受到抑制,表明某些青花菜生长素相关基因的表达可受到盐胁迫的调控。此外,XLOC_021367的靶基因Bol019606(ethylene-responsive transcription factor)可参与乙烯代谢途径,其表达量在青花菜盐胁迫过程中先上升后下降,表明XLOC_021367可通过靶基因调控乙烯介导的信号通路来对盐胁迫进行响应。
高温胁迫使植物质膜流动性增加,从而促使类受体蛋白激酶向细胞传递高温信号,同时激活相关转录因子[28]。本研究发现差异LncRNAsXLOC_023592的靶基因为凝集素类受体蛋白激酶(Bol039139),该激酶是类受体蛋白激酶家族中的一个亚族,在植物生物/非生物胁迫和发育调控中发挥非常重要的作用[29]。qRT-PCR分析发现XLOC_023592及其靶基因的表达量随着高温胁迫时间的延长逐渐下降,表明抑制该LncRNAs的表达,可能会导致其靶基因表达受限从而影响青花菜高温胁迫的响应。热激蛋白合成可以提高植物的耐热性,异位表达拟南芥的谷氧还原蛋白可提高HSP基因的表达来增加耐热性[12]。XLOC_003826靶向热激蛋白基因(Bol005002),高温胁迫12 h的表达量为CK的8倍,靶基因的表达量也随着高温胁迫时间的延长而快速增加,由此推测该LncRNAs是高温胁迫响应过程中的重要调控因子。此外,对青花菜在高温胁迫下的差异LncRNAs进行注释,发现高温胁迫相关的差异LncRNAs参与了青花菜的谷胱甘肽代谢、信号转导以及脂肪酸延伸和代谢等过程。谷胱甘肽转移酶蛋白基因(Bol033291)是XLOC_025914的靶基因,该LncRNA和其靶基因的表达模式相反,推测该LncRNAs可通过负调控其靶基因的表达来参与青花菜的热胁迫过程。
4 结 论
本研究鉴定到青花菜高温和盐胁迫相关LncRNAs 2 432条,其中31条为intronic RNA,79条为anti-sense RNA,2 322条为lincRNA。LncRNAs的表达水平整体较mRNA低,且长度和外显子个数比mRNA少。筛选得到96条上调和62条下调的差异LncRNAs。通过GO和KEGG注释发现这些差异LncRNAs可参与青花菜高温和盐胁迫中的植物激素信号转导、谷胱甘肽代谢以及氧化磷酸化等过程。实时荧光定量分析表明10个差异LncRNAs在高温和盐胁迫下的表达模式存在差异。研究结果为进一步分析LncRNA在青花菜逆境胁迫中的调控机理提供理论基础。

