甘加藏羊发情周期和乏情期血浆T3和T4浓度动态变化及HPOA轴 DIO2和 DIO3的表达
刘莉莉,何玉英,杨亚文,包莹莹,何玉琴 ,陈卫刚,葛闻博,张 霞,华道才让
(1. 甘肃农业大学 生命科学技术学院,兰州 730070;2. 中国人民银行兰州支行,兰州 730070;3.甘肃省甘南藏族自治州夏河县甘加乡畜牧兽医工作站,甘肃夏河 747199)
甘加藏羊生长在海拔2 800~3 500 m的甘南高寒牧区,是典型的季节性发情(7-9 月)哺乳动物,2.5岁开始配种,发情周期平均为(16±2)d,每年产羔1次,每胎1羔[1],繁殖率低,极大地影响了藏区农牧业的快速发展,因此探索影响藏羊生殖生理的调控因素,对提高藏羊繁殖率具有重要的意义。动物的季节性繁殖活动受下丘脑-垂体-性腺轴[2-3](Hypothalamus-pituitary-gonadal axis,HPG)、外界光周期等环境因素共同调控[4]。甲状腺激素(TH)包括三碘甲腺原氨酸 (Triiodothyronine, T3)、四碘甲腺原氨酸 (Thyroxine, T4) ,甲状腺激素合成酶:Ⅱ型脱碘酶(type Ⅱ iodothyronine deiodinase,DIO2)和Ⅲ型脱碘酶 (type Ⅲ iodothyronine deiodinase,DIO3)是催化不同活性甲状腺激素相互转化的关键酶,两者的表达变化受到光周期内在信号褪黑激素的控制[5-6],并在光周期调控下丘脑 TH 浓度过程中起介导作用[7]。动物繁殖状态的周期性变换与两种脱碘酶的表达变化密切相关[8]。DIO2和DIO3这两种酶的活性变化为T3、T4血液浓度相对稳定提供了一种可能的调节机制[9]。甲状腺激素及其合成酶DIO2、DIO3的生理功能备受国内外学者关注。目前已有报道显示叙利亚仓鼠和绵羊等动物在长日照(休情)条件下,下丘脑DIO2的表达显著增加,从而上调T3局部浓度,而短日照条件下DIO2表达明显减少,T3 下丘脑局部浓度降低[10-11]。迄今为止,有关甘加藏羊繁殖周期血浆中TH的分泌变化及催化TH合成的关键酶DIO2、DIO3表达规律的研究较少。故本研究以繁殖季节和非繁殖季节甘加藏羊为研究对象,应用酶联免疫吸附法(ELISA)、实时荧光PCR技术(RT-qPCR)、蛋白免疫印迹技术(Western Blot)检测其发情周期和乏情期血浆中T3、T4的动态变化,HPOA及甲状腺组织中DIO2和DIO3mRNA及其蛋白的表达规律,以期探讨甲状腺激素及其合成酶对甘加藏羊生殖活动的调控及影响,为进一步阐明甘加藏羊生殖生理活动规律提供研究依据。
1 材料与方法
1.1 样品采集保存
在甘加藏羊繁殖季节(7-9月)和非繁殖季节(3-4月),于甘肃省甘南藏族自治州夏河县甘加乡藏绵羊养殖合作社随机选择2.5~3.5岁雌性健康且未孕的甘加型藏羊30只,分为间情期、发情前期、发情期、发情后期和乏情期,每组6只,跟踪观察2个生殖周期,以公羊爬跨、结合阴道脱落细胞图片法鉴定其发情状况后开始采血。试验羊开始发情时记为0 h,0~36 h为发情期,每2 h采血1次;36~72 h为发情后期,每3 h采血1次;4~13 d为间情期,14~16 d为发情前期,间情期和发情前期每天早晚7:00各采1次血,每次采血5 mL,连续采血2个发情周期(32~38 d);在藏羊非繁殖季节,连续采血3 d,每天采血2次;血样经肝素钠抗凝后,以2 400 r/min离心10 min,吸取血浆移入标记好的血清管中,置于 -20 ℃冰箱冷冻保存,备用。采用颈部局部麻醉颈动脉放血法无痛处死试验羊,迅速取出下丘脑、垂体、卵巢、甲状腺等组织,置于液氮中保存,后移至-80 ℃冰箱保存,备用。
1.2 甘加藏羊血浆甲状腺激素的测定
按照ELISA试剂盒(北京,奇松生物)说明测定血浆的T3、T4 的OD值,牛血清白蛋白为阴性对照。根据各自标准品的OD值以及相对应的浓度绘制标准曲线,得到T3回归方程y= 0.227 5x+0.037 9,T4回归方程y= 0.007 2x+0.035 1。其中y表示OD值,x表示浓度。根据回归方程计算不同时期T3、T4的浓度,并进行分析。所有数据以“平均数±标准差”表示,用 SPSS 22.0 软件处理,统计血浆中不同发情周期T3、T4的浓度,并用t检验分析。
1.3 甘加藏羊HPOA及甲状腺组织 DIO2、 DIO3 mRNA相对表达量的测定
严格按照RNA提取试剂盒(北京, TransGen)说明书进行操作,分别提取甘加藏羊发情周期和乏情期下丘脑、垂体、卵巢和甲状腺组织中的总RNA,并按照反转录试剂盒(北京, TransGen),反转录合成cDNA链。根据NCBI中绵羊DIO2、DIO3和β-actinmRNA序列进行引物设计(Primer Premier 5.0),引物由上海生工生物科技有限公司合成(表1)。以反转录的cDNA为模板,RT-qPCR反应总体系为 20 μL,每个样品设3个重复。扩增条件: 95 ℃预变性30 s;94 ℃变性5 s,60 ℃退火延伸30 s,循环45次。所得相关数据用2-ΔΔCT方法进行计算,每个基因相对表达量均以内参基因为基准进行校正。所有数据用SPSS 22.0软件进行显著性分析。
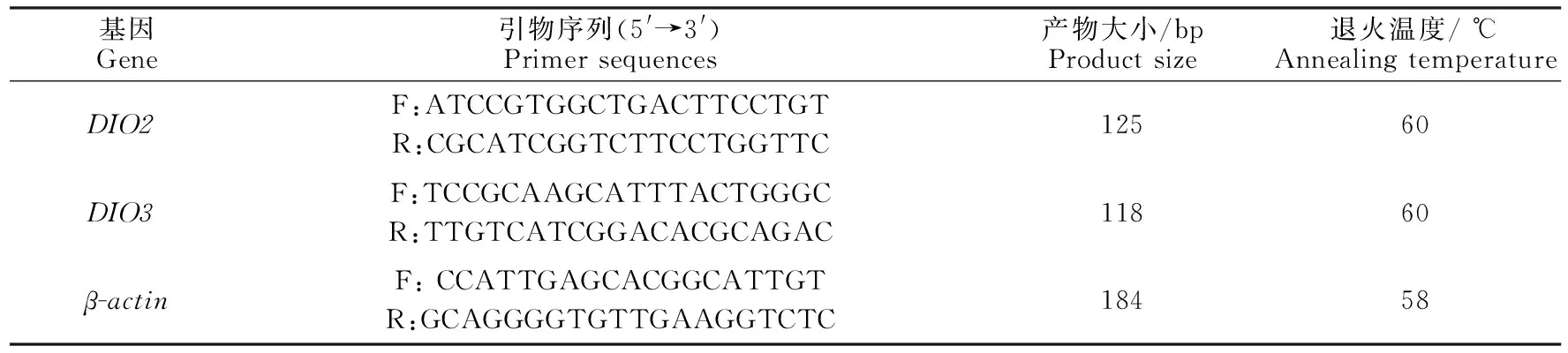
表1 DIO2、 DIO3和β-actin基因引物序列Table 1 Primers sequences of DIO2,DIO3 and β-actin gene
1.4 甘加藏羊HPOA及甲状腺组织DIO2、 DIO3蛋白相对表达量的测定
用蛋白裂解液(1 mL裂解液+10 μL蛋白酶抑制剂)(Bioss, 北京)提取各组织总蛋白,以BCA试剂盒(Bioss, 北京)测定浓度,于十二烷基硫酸钠(sodium dodecy sulfate, SDS)上样缓冲液中100 ℃水浴 10min而变性蛋白,冰上静置5 min备用。制备12%封底胶、12%分离胶和5%浓缩胶后以6 μL上样量进行SDS-PAGE电泳,电泳完毕对照Marker预染条带切取DIO2(31 ku)、DIO3(30 ku)、β-actin(42 ku)对应条带,湿转法将分离胶上的蛋白转移至PVDF膜(Solarbio, 北京)上,PBST(PBS + tween 20)(Bioss, 北京)洗膜20 min,5%脱脂奶粉室温封闭1 h。孵育一抗(1∶500),4 ℃过夜。PBST洗膜 4 h,37 ℃孵育二抗(1∶4 500)1 h,PBST洗膜4 h,暗室曝光成影拍照。利用Image Pro-Pius 6.0图像分析系统进行灰度值分析,并利用SPSS 22.0软件进行差异性分析。
2 结果与分析
2.1 甘加藏羊血浆中T3和T4浓度变化规律
检测结果显示,甘加藏羊在整个发情周期和乏情期血浆中T3和T4的浓度呈现动态变化,以脉冲式和波动式交替变化。如图1所示,血浆中T4的浓度显著高于T3(P<0.05),T4的浓度超过T3浓度的30倍。如表2所示,T3的平均浓度在发情前期最高,在乏情期最低,各时期差异显著(P<0.05);T4的平均浓度在发情期最高,在乏情期最低,各时期差异显著(P<0.05)。

h.小时;d.天;w.晚;z.早;f.乏情期h.hour; d.day; w.night; z.morning; f.anestrus图1 甘加藏羊发情周期和乏情期血浆中T3和T4浓度变化Fig.1 Concentration changes of T3 and T4 in plasma of Ganjia Tibetan sheep during estrus cycle and anestrus

表2 甘加藏羊发情周期和乏情期血浆中T3和T4平均浓度Table 2 Average concentrations of T3 and T4 in plasma during estrus cycle and anestrus of Ganjia Tibetan sheep
2.2 甘加藏羊HPOA及甲状腺组织中 DIO2 和 DIO3 mRNA和蛋白的表达分析
甘加藏羊发情周期和乏情期下丘脑、垂体、卵巢、甲状腺中均有DIO2和DIO3mRNA和蛋白表达,且差异显著(P<0.05)(图2)。垂体、卵巢、甲状腺中DIO2mRNA和蛋白相对表达量均大于DIO3。下丘脑(图2-A1、A2)中DIO2mRNA和蛋白相对表达量在间情期最高,DIO3mRNA和蛋白相对表达量在发情期最高,各时期差异均显著(P<0.05)。垂体(图2-B1、B2)中DIO2mRNA相对表达量在发情前期最高,显著高于其他各时期(P<0.05),蛋白相对表达量在发情后期最高,与发情前期差异不显著(P>0.05),与其他3个时期差异显著(P<0.05);DIO3mRNA和蛋白的表达量在发情后期最高,各时期差异均显著(P<0.05)。卵巢(图2-C1、C2)中DIO2mRNA的表达量在发情期最高,蛋白的表达量在发情后期最高;DIO3mRNA表达量在发情后期最高,蛋白的表达量在发情期最高(P< 0.05),各时期差异均显著(P<0.05)。甲状腺(图2-D1、D2)中DIO2mRNA和蛋白的表达量在发情前期最高,DIO3mRNA和蛋白的表达量在间情期最高,各时期差异均显著(P<0.05)。甘加藏羊HPOA轴及甲状腺组织中DIO2和DIO3Western blot结果见图3。

A1、A2.下丘脑;B1、B2.垂体;C1、C2. 卵巢;D1、D2. 甲状腺。相同形状列不同小写字母表示差异显著(P<0.05)A1, A2.Hypothalamus;B1, B2. Pituitary;C1, C2. Ovary;D1, D2. Thyroid. Different lowercase letters within the same shape columns indicate significant difference between groups(P<0.05)图2 甘加藏羊发情周期和乏情期HPOA轴及甲状腺组织中 DIO2、 DIO3 mRNA和蛋白相对表达量Fig.2 Relative expression of DIO2, DIO3 mRNA and protein in HPOA axis and thyroid tissue inestrus cycle and anestrus of Ganjia Tibetan sheep
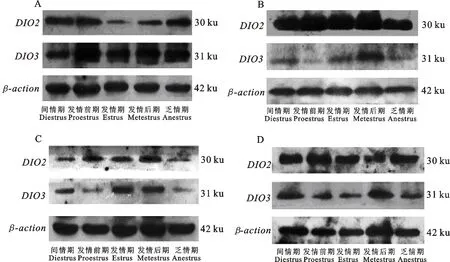
A.下丘脑;B.垂体;C.甲状腺;D.卵巢A. Hypothalamus; B. Pituitary;C.Thyroid;D.Ovary图3 甘加藏羊发情周期和乏情期HPOA轴及甲状腺组织中 DIO2、 DIO3 Western blot结果Fig.3 Result of Western blot of DIO2 and DIO3 in HPOA axis and thyroid tissue inestrus cycle and anestrus of Ganjia Tibetan sheep
3 讨 论
3.1 甘加藏羊血浆中T3和T4浓度的动态变化
研究结果显示甘加藏羊发情周期内和乏情期血浆甲状腺激素T3和T4的浓度呈现明显的变化,均以波动式和脉冲式交替变化,出现多个波峰和波谷,提示甲状腺激素对季节性繁殖动物的生殖活动具有调控作用。这与赵芹等[12]的研究结果类似,通过对绵羊进行的甲状腺切除和注射外源T4,证实T3和T4能够启动和终止绵羊发情。研究发现藏羊发情周期和乏情期血浆T4的浓度均显著高于T3,T4的浓度为T3浓度的30倍以上,主要原因可能与甲状腺激素合成机制有关,文献[13]显示血液中 75%以上的 T3来自T4,其余由甲状腺分泌。T4 脱碘变成 T3,是T3生成的主要途径,并且T4在血浆中的半衰期为 7 d,T3半衰期为 1.5 d。
本研究发现T3的平均浓度在发情前期最高,T4的平均浓度在发情期最高,并且从第5天早上开始T3和T4的浓度均呈现上升趋势,两者均在15 d早上达到波峰,可能是为卵泡的发育和排卵做准备。有报道指出大鼠[14]甲状腺激素可刺激窦前卵泡的生长和排卵,T3和卵泡刺激素PI3K/Akt 通路共同作用,促进颗粒细胞增殖,抑制颗粒细胞衰老,并且甲状腺激素在体外卵泡发育、成熟和排卵过程中都发挥着重要作用。而T3、T4的浓度均在乏情期最低,在整个乏情期,T3和T4均以波动式分布,其浓度变化趋势比较平缓,说明乏情期甲状腺激素的生物学活性较低,也可能是卵巢分泌的雌二醇反馈抑制下丘脑GnRH和垂体FSH和LH的分泌,进而使甲状腺激素分泌减少,有学者[15]指出TH 可能通过参与 GnRH 脉冲释放的神经内分泌过程而实现对性腺系统的季节性调控,再次证实甲状腺激素对季节性发情动物生殖的调控作用。
3.2 甘加藏羊生殖轴 DIO2、 DIO3表达变化及对藏羊繁殖的影响
有研究表明,DIO2基因在大鼠的大脑、小脑、甲状腺和睾丸中有一定表达[16-18],在布氏田鼠的下丘脑、大脑和小脑中也有表达[19]。DIO3基因在幼龄的西伯利亚仓鼠和成年大鼠下丘脑中均有表达[20],在人和小鼠的肝脏、皮肤、脑、子宫、胎盘中也均检测到DIO3的表达[21-22]。本研究结果显示下丘脑、垂体、卵巢和甲状腺组织中均有DIO2、DIO3的表达,且各个时期不同组织DIO2、DIO3的表达有显著差异,下丘脑中DIO2的表达量在间情期最高,在发情前期、发情期依次呈现下降趋势,在发情后期、乏情期呈现上升趋势,而DIO3的表达量在发情期最高,由此推测DIO2可能对甘加藏羊的繁殖活动具有抑制作用,DIO3可能对甘加藏羊的繁殖活动具有促进作用,DIO2、DIO3参与调控季节性发情哺乳动物甘加藏羊的生殖活动。
已有报道显示鹌鹑、叙利亚仓鼠和绵羊等在长日照(休情)条件下,下丘脑DIO2表达显著增加,而短日照(发情)条件下DIO2表达明显减少[23],下丘脑中DIO3的表达在春、秋季(发情)显著高于夏季(休情),而且在短光照卵巢中的表达量显著高于长光照[24],这与本研究结果基本一致,提示DIO2、DIO3表达变化受光周期的影响,光周期通过影响褪黑素的分泌来调控下丘脑中GnRH的分泌,而下丘脑室管膜细胞中存在着催化TH转化的关键酶DIO2和DIO3[22],证实 TH可能通过参与 GnRH 脉冲释放的神经内分泌过程而实现对性腺系统的季节性调控。对长日照动物黑线仓鼠季节性繁殖研究发现,DIO2在春秋季(发情)表达量较高[24],与黑线仓鼠春秋季出现繁殖高峰的事实一致,也与GnRH 的季节表达模式一致,表明DIO2可能有促进调控黑线仓鼠生殖的作用。这一结果与本研究结果不一致,原因可能是物种间的特异性,光照周期对短日照和长日照繁殖动物作用机制可能不同[25]。更有研究表明[24]西伯利亚仓鼠的季节性繁殖活动与DIO2的表达无关,而与DIO3的表达有关,并且在不同年龄阶段、不同性别个体中DIO2和DIO3的表达量均有所不同,再次解释了DIO2和DIO3在不同物种间表达的差异性,但具体作用机制有待进一步研究证实。
垂体、卵巢、甲状腺组织中,发情周期和乏情期DIO3的表达量均显著低于各时期DIO2的表达量,主要原因可能是甲状腺主要分泌的是甲状腺激素T4,机体所需的T3主要来源于其他组织中T4的脱碘,而只有少量的T3直接来源于甲状腺。DIO2能催化T4转换为活性更高的T3,这可能需要DIO2表达量的上调和DIO3表达量的下调来完成[24]。光周期影响季节性繁殖动物垂体分泌 TSH,通过 与 TSHR 相结合并将信息传递到下丘脑,TSHR 的表达量增加会引起下丘脑DIO2表达的上调以及DIO3表达的下调[26]。
甲状腺中DIO2的表达量在发情前期最高,DIO3表达量在间情期最高,各时期差异均显著,提示DIO2和DIO3在甲状腺中发挥调控藏羊生殖活动的功能。DIO2和DIO3的活性和浓度在控制甲状腺合成的甲状腺激素T3和T4的水平上至关重要,DIO3能根据机体内甲状腺激素T4的浓度调控甲状腺激素T3的活性,使T4的浓度正好满足机体的局部需要,且甲状腺激素是由甲状腺合成并分泌,有报道指出[27]甲状腺中存在褪黑素合成的酶AANAT和HIOMT,证明甲状腺能自主合成褪黑素,而褪黑素的合成受光照周期的影响,但甲状腺中没有接受外界光照的神经肽,由此推测甲状腺中褪黑素的合成受自身内源性光照等因素的影响,而甲状腺自主合成的褪黑素作用于下丘脑内侧基底部MEH可能对DIO2、DIO3的表达产生一定的影响,进而影响下丘脑GnRH的释放,调控甘加藏羊的繁殖活动,具体的作用机制还有待进一步研究。
4 结 论
本研究结果表明甘加藏羊发情周期和乏情期血浆中T3、T4浓度,DIO2、DIO3mRNA及其蛋白在 HPOA和甲状腺组织中的相对表达量呈动态变化规律,且存在一定的差异,这种表达的差异从激素和分子水平证明了 T3、T4和DIO2、DIO3参与甘加藏羊的生殖调控,为进一步研究甲状腺激素及其合成酶对动物生殖生理活动的调控机制提供科学的参考依据。

