江苏省2021年高考化学卷评析暨高三教学建议
徐光静 经志俊




摘要: 聚焦必备知识和关键能力等考查内容和基础性、综合性、应用性、创新性等考查要求,评析江苏省2021年高考化学卷“考什么”“怎么考”。对照学业质量水平的质量描述,评析学业质量水平的考查层次;基于高考引导教学的功能,结合典型问题分析,提出强化知识理解、提升信息素养、学会证据推理、建构思维模型等高三化学教学策略。
关键词: 江苏高考化学卷; 知识理解; 信息素养; 证据推理; 思维模型
文章编号: 1005-6629(2022)05-0083-06
中图分类号: G633.8
文献标识码: B
2021年江苏省开启“3+1+2”高考模式,自主命题的化学卷遵循中国高考评价体系和普通高中化学课程标准的命题原则和要求,在传承“进一步体现高中化学课程基础性、应用性、时代性的特征”和“进一步体现高考化学科宽基础、厚实践、重能力的特色”的基础上,充分体现中国高考评价体系倡导的“价值引领、素养导向、能力为重、知识为基”的命题理念。
1 江苏省2021年高考化学卷评析
从“化学语言与概念、反应变化与规律、物质转化与应用、物质结构与性质、实验原理与方法”等必备知识,“理解与辨识、分析与推测、归纳与论证、探究与创新”等关键能力,“化学观念、思维方法、实践探索、态度责任”等学科素养[1],从“基础性、综合性、应用性、创新性”等考查要求,评析江苏省2021年高考化学卷“考什么”“怎么考”。对照学业质量水平的质量描述[2],从完成测试任务相匹配的学业成就的关键特征,评析江苏省2021年高考化学卷对学业质量水平的考查层次。
1.1 江苏省2021高考化学卷单项选择题评析
江苏省2021高考化学卷单项选择题(每小题3分,共42分)精选“日常生活、生产环境、学术探索、实验探究”等方向的真实情境,重点考查必备知识和关键能力,侧重基础性、综合性,兼顾应用性,覆盖学业质量水平1~4。
非选择题(4小题,共58分)精选“实验探究、生产环境、学术探索”等领域的真实情境,重点考查关键能力与学科素养,侧重综合性和应用性,体现创新性。
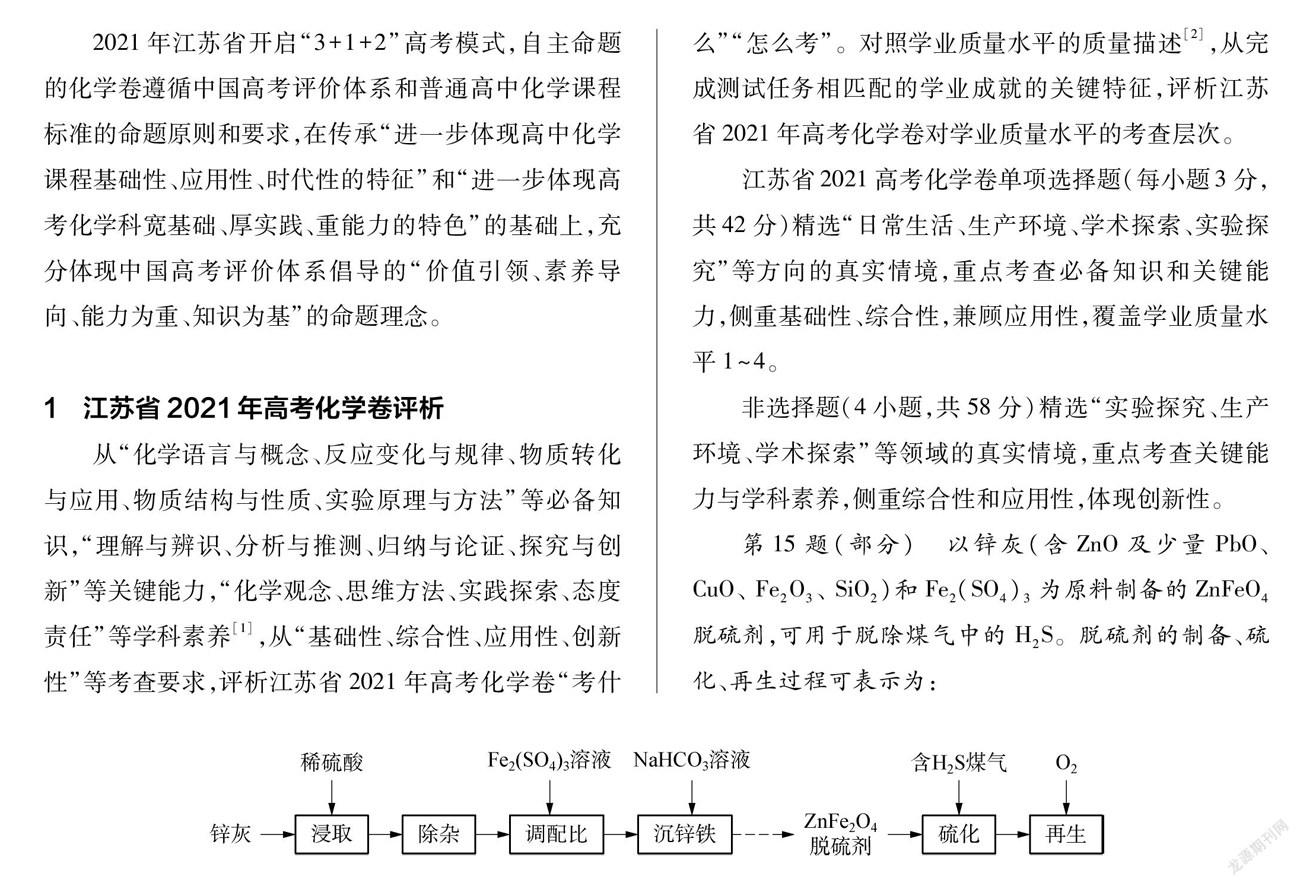
第15题(部分) 以锌灰(含ZnO及少量PbO、 CuO、 Fe2O3、 SiO2)和Fe2(SO4)3为原料制备的ZnFeO4脱硫剂,可用于脱除煤气中的H2S。脱硫剂的制备、硫化、再生过程可表示为:
(1) “除杂”包括加足量锌粉、过滤、加H2O2氧化等步骤。除Pb2+和Cu2+外,与锌粉反应的离子还有 ▲ (填化学式)。
(2) “调配比”前,需测定ZnSO4溶液的浓度。准确量取2.50mL除去Fe3+的ZnSO4溶液于
100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液于锥形瓶中,滴加氨
水调节溶液pH=10,用0.0150mol·L-1 EDTA(Na2H2Y)溶液滴定至终点(滴定反应为Zn2++Y4-ZnY2-),平行滴定3次,平均消耗EDTA溶液25.00mL。计算ZnSO4溶液的物质的量浓度 ▲ (写出计算过程)。
(3) 400℃时,将一定比例H2、 CO、 CO2和H2S的混合气体以一定流速通过装有
ZnFe2O4脱硫剂的硫化反应器。
① 硫化过程中,ZnFe2O4与H2、 H2S反应生成ZnS和FeS,其化学方程式为________。
② 硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,反应前后ZnS的质量不变,该反应过程可描述为________。
(4) 将硫化后的固体在N2∶O2=95∶5(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如题15图所示。在280~400℃范围内,固体质量增加的主要原因是________。
该题以“脱硫剂ZnFe2O4的制备、硫化、再生的过程”“固体质量随温度变化的曲线”等真实情境为测试载体,形成“反应微粒判断、溶液浓度测定、陌生化學方程式书写、化学事实究因分析”等测试任务;考查学生 “化学语言与概念、反应变化与规律、实验原理与方法”等方面必备知识的掌握程度,“分析与推测、归纳与论证”等方面关键能力的发展状况,“化学观念、思维方法”等层面学科素养的表现水平。侧重综合性、应用性,兼顾创新性。匹配学业质量水平(1)3-1, (2)2-3, (3)4-3, (4)4-3。
第16题(部分) F是一种天然产物,具有抗肿瘤等活性,其人工合成路线如下:
(1) A分子中采取sp2杂化的碳原子数目是 ▲ 。
(2) B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: ▲ 。
① 分子中不同化学环境的氢原子个数比是2∶2∶2∶1。
② 苯环上有4个取代基,且有两种含氧官能团。
(3) A+BC的反应需经历A+BXC的过程,中间体X的分子式为C17H17NO6,XC的反应类型为 ▲ 。
(4) EF中有一种分子式为C15H14O4的副产物生成,该副产物的结构简式为 ▲ 。
(5) 写出以CH3
和FCH2OH
为原料制备CH3OCHO
的合成路线流程图(无机试剂和有机溶剂任用、合成路线流程图示例见本题题干)。
该题以“天然存在的具有抗肿瘤等活性的有机物的人工合成路线”等真实情境为测试载体,形成“碳原子轨道杂化方式识别、限定条件的同分异构体及反应副产物的结构推断、陌生反应类型判断、有机合成路线设计”等测试任务,考查学生“化学语言与概念、物质转化与应用、物质结构与性质”等方面必备知识的掌握程度,“理解与辨识、分析与推测、探究与创新”等方面关键能力的发展状况,“思维方法、实践探索”等层面学科素养的表现水平。体现基础性,侧重综合性,应用性,匹配学业质量水平(1)3-1, (2)2-3, (3)4-3, (4)4-3, (5)4-2。
第17题(部分) 以软锰矿粉(含MnO2少量Fe、 Al、 Si、 Ca、 Mg等的氧化物)为原料制备电池级MnO2。
题17图-1
(1) 浸取。将一定量软锰矿粉与Na2SO3、 H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(装置见题17图-1),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是 ▲ ,转化为Mn2+的离子方程式为 ▲ 。
(2) 除杂。向已经除去Fe、 Al、 Si的MnSO4溶液(pH约为5)中加入NH4F溶液,溶液中的Ca2+、 Mg2+形成氟化物沉淀。若沉淀后上层清液中c(F-)=0.05mol·L-1,则c(Ca2+)/c(Mg2+) ▲ 。[Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
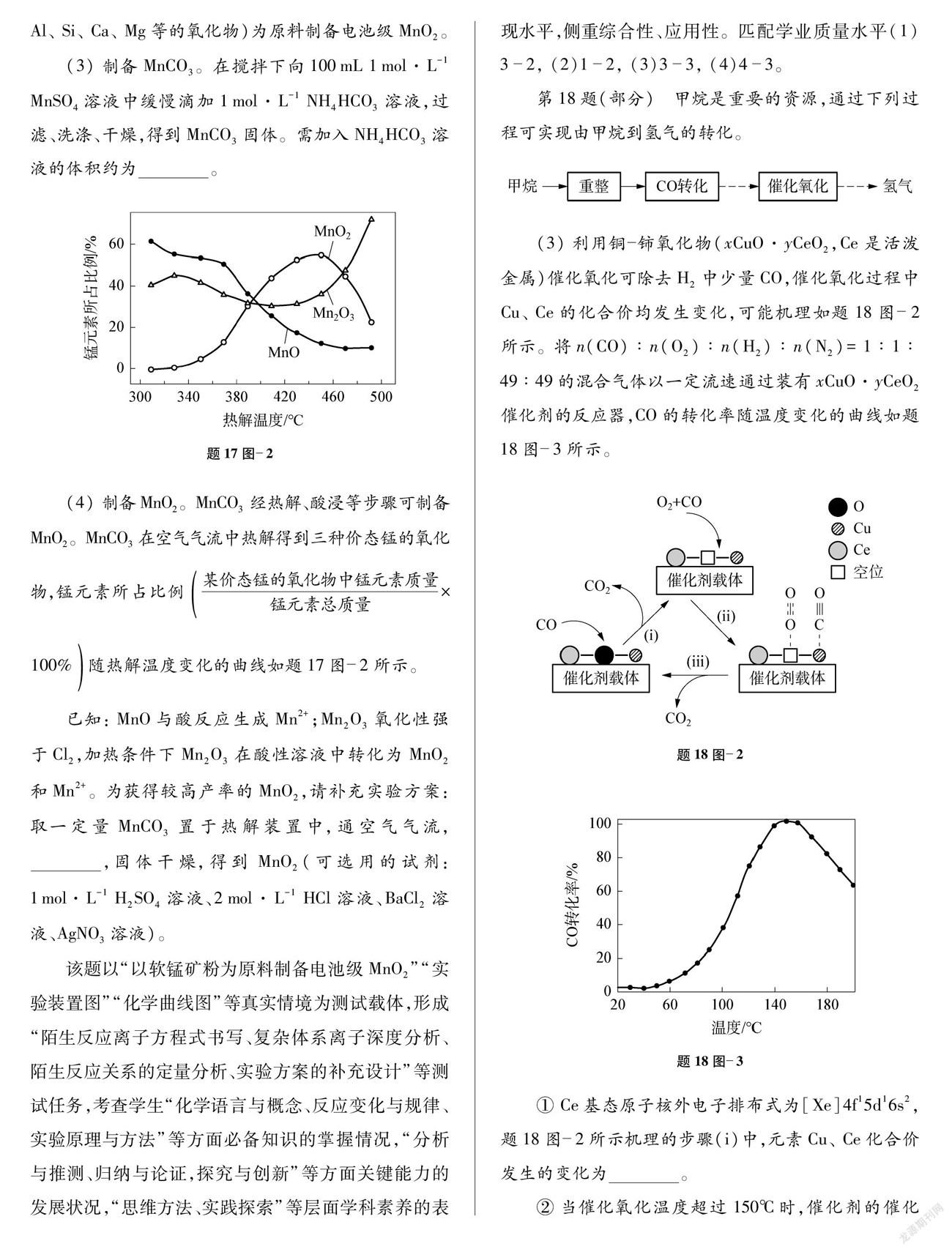
(3) 制备MnCO3。在搅拌下向100mL 1mol·L-1 MnSO4溶液中缓慢滴加1mol·L-1 NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为 。
题17图-2
(4) 制备MnO2。MnCO3经热解、酸浸等步骤可制备MnO2。MnCO3在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例某价态锰的氧化物中锰元素质量锰元素总质量×100%随热解温度变化的曲线如题17图-2所示。
已知: MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+。为获得较高产率的MnO2,请补充实验方案: 取一定量MnCO3置于热解装置中,通空气气流, ,固体干燥,得到MnO2(可选用的试劑: 1mol·L-1 H2SO4溶液、
2mol·L-1 HCl溶液、BaCl2溶液、AgNO3溶液)。
该题以“以软锰矿粉为原料制备电池级MnO2”“实验装置图”“化学曲线图”等真实情境为测试载体,形成“陌生反应离子方程式书写、复杂体系离子深度分析、陌生反应关系的定量分析、实验方案的补充设计”等测试任务,考查学生“化学语言与概念、反应变化与规律、实验原理与方法”等方面必备知识的掌握情况,“分析与推测、归纳与论证,探究与创新”等方面关键能力的发展状况,“思维方法、实践探索”等层面学科素养的表现水平,侧重综合性、应用性。匹配学业质量水平(1)3-2, (2)1-2, (3)3-3, (4)4-3。
第18题(部分) 甲烷是重要的资源,通过下列过程可实现由甲烷到氢气的转化。
(1) 500℃时,CH4与H2O重整主要发生下列反应: CH4(g)+H2O(g)CO(g)+3H2(g) CO(g)+H2O(g)H2(g)+CO2(g)
已知CaO(s)+CO2(g)CaCO3(s)△H=-178.8kJ·mol-1。向重整反应体系中加入适量多孔CaO,其优点是 ▲ 。
(2) CH4与CO2重整的主要反应的热化学方程式为
反应Ⅰ: CH4(g)+CO2(g)2CO(g)+2H2(g) △H=246.5kJ·mol-1
反应Ⅱ: H2(g)+CO2(g)CO(g)+H2O(g) △H=41.2kJ·mol-1
反应Ⅲ: 2CO(g)CO2(g)+C(s) △H=-172.5kJ·mol-1
① 在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4+CO2(g)+2H2O(g)4CO(g)+8H2(g)的△H= ▲ 。
② 1.01×105Pa下,将n起始(CO2)∶n起始(CH4)=1∶1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如题18图-1所示。800℃下CO2平衡转化率远大于600℃下CO2平衡转化率,其原因是 ▲ 。
(3) 利用铜-铈氧化物(xCuO·yCeO2,Ce是活泼金属)催化氧化可除去H2中少量CO,催化氧化过程中Cu、 Ce的化合价均发生变化,可能机理如题18图-2所示。将n(CO)∶n(O2)∶n(H2)∶n(N2)=1∶1∶49∶49的混合气体以一定流速通过装有xCuO·yCeO2催化剂的反应器,CO的转化率随温度变化的曲线如题18图-3所示。
题18图-2
题18图-3
① Ce基态原子核外电子排布式为[Xe]4f15d16s2,题18图-2所示机理的步骤(i)中,元素Cu、 Ce化合价发生的变化为 。
② 当催化氧化温度超过150℃时,催化剂的催化活性下降,其可能原因是 。
该题以“甲烷重整制备氢气的系列转化”“反应机理示意图”“化学曲线图”等真实情境为测试载体,形成“反应焓变计算、反应机理分析、工艺方案评价、化学事实溯因”等测试任务,考查学生“反应变化与规律、物质结构与性质”等方面必备知识的掌握程度,“理解与辨识、归纳与论证、分析与推测、探究与创新”等方面关键能力的发展水平,“化学观念、思维方法、实践探索”等层面学科素养的表现水平。侧重综合性、应用性,兼顾创新性。匹配学业质量水平(1)4-2, (2)①3-3、 ②4-3, (3)①4-3、 ②4-3。
2 江苏省2022届高三化学教学建议
引导教学是高考的核心功能之一。作为江苏省新高考模式的开局之年,2021年高考化学卷对2022届高三教学的导向作用显得尤为重要。基于2021年高考化学卷的命题风格,笔者认为“强化学科理解、提升信息素养、引导证据推理、建构思维模型”应成为2022届高三化学教学研究的重点和实施的关键。
2.1 强化知识理解
学科知识是学科素养的发展载体,强化知识理解是实现学科知识向学科素养转化的重要前提,也是灵活运用学科知识解决真实问题的关键。
理解反应本质是17(3)问题解决的关键。理解“在搅拌下向100mL 1mol·L-1MnSO4溶液中缓慢滴加1mol·L-1 NH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体”的反应本质是Mn2+与HCO-3电离出的CO2-3结合为MnCO3、 HCO-3电离出的H+与另一HCO-3反应生成CO2和H2O,总反应为MnSO4+2NH4HCO3MnCO3↓+CO2↑+(NH4)2SO4+H2O,才能得到参加反应的n(MnSO4)∶n(NH4HCO3)=1∶2,从而得出需加入的NH4HCO3溶液的体积为200mL。
2.2 提升信息素养
信息素养是学科素养的重要组成,提升信息素养是实现知识中心向能力中心转化的重要保障,也是有效利用情境信息完成测试任务的关键。
合理加工信息是15(3)题问题解决的关键。依据该题“400℃时,将一定比例H2、 CO、
CO2和H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器。ZnFe2O4与H2、
H2S反应生成ZnS和FeS”,可知硫化时的反应物为ZnFe2O4、 H2、 H2S,主要产物为ZnS、
FeS,结合铁元素化合价由+3价变为+2价,判断ZnFe2O4为氧化剂,硫元素化合价不变,
判断H2为还原剂且被氧化生成H2O,反应条件为400℃,ZnFe2O4+H2+H2S——ZnS+FeS+H2O,再基于电子守恒、质量守恒配平方程式,并标明必要的反应条件即可得出
反應的化学方程式为ZnFe2O4+H2+3H2S400℃ZnS+2FeS+4H2O;研究表明ZnS参与了H2S与
CO2生成COS的反应,反应前后ZnS的质量不变”,依据“研究表明ZnS参与了H2S与CO2
生成COS的反应,反应前后ZnS的质量不变”,可知H2S与CO2生成COS的反应中ZnS
发挥了催化剂的作用,且参与了化学反应,依据质量守恒定律得出ZnS与CO2反应生成COS和ZnO,ZnO再与H2S反应转化为ZnS和H2O的结论。
2.3 规范证据推理
证据推理是学科方法的重要形式,规范证据推理是引领低阶思维向高阶思维发展的重要抓手,也是基于化学事实探究事实成因的有效手段。
分析与论证是15(4)题问题解决的关键。基于“将硫化后的固体在N2∶O2=95∶5(体积比)的混合气体中加热再生,在280~400℃范围内固体质量增加”的事实,首先从再生的角度分析固体质量增加的可能性,依据M(ZnFe2O4)/[M(ZnS+2M(FeS))]=0.88,判断固体再生时发生的主反应ZnS+2FeS+5O2ZnFe2O4+3SO2,不可能导致固体质量增加;进而分析在280~400℃范围内有副反应发生,兼顾N2的稳定性和质量守恒定律提出可能有硫的含氧酸盐生成的猜想,再结合氧化性氛围和亚硫酸盐、亚铁盐的强还原性,聚焦有金属硫酸盐生成,最后依据该温度范围内固体增加的幅度在2%之内,得出部分ZnS、 FeS氧化为硫酸盐的结论。
寻找证据链是18(3)题问题解决的关键。基于铜-铈催化剂的化学式(xCuO·yCeO2)(证据1)得出催化剂中Cu呈+2价、Ce呈+4价(结论1);依据“步骤(i)中CO与催化剂作用转化为CO2,C元素化合价升高2价”(证据2)得出该步骤Cu、 Ce元素化合价相应降低2价(结论2);结合“催化氧化过程中Cu、 Ce的化合价均发生变化”及步骤(i)前后Cu、 Ce、 O键合方式的改变(证据3)得出Cu、 Ce化合价分别降低1价(结论3)。整合3条证据形成的证据链推理得出步骤(i)“Cu由+2价变为+1价,Ce由+4价变为+3价”的结论。
基于催化机理“步骤(i)Cu由+2价变为+1价、Ce由+4价变为+3价,步骤(ii)O2、CO吸附在催化剂表面,步骤(iii)Cu由+1价恢复为+2价、Ce由+3价恢复为+4价”(证据1)得出Cu2+与Cu+、 Ce4+与Ce3+循环转化是保持催化活性的关键(结论1);依据“当催化氧化温度超过150℃时,催化剂的催化活性下降”的事实(证据2)得出部分Cu或Ce元素化合价超出了上述变化范围(结论2);结合“Ce基态原子核外电子排布式为[Xe]4f15d16s2”和+2价是铜的最高价的知识储备(证据3)得出Cu2+、 Ce4+不能再被氧化(结论3);现结“n(CO)∶n(O2)∶n(H2)∶n(N2)=1∶1∶49∶49的混合气体以一定流速通过装有xCuO·yCeO2催化剂的反应器”反应体系处于还原性氛围之中兼顾到“铈是活泼金属”(证据4)得出Cu元素被深度还原为0价(结论4)。整合4条证据形成的证据链推理得出“温度升高,Cu2+(或Cu+)被H2(或CO)还原为Cu”导致催化活性降低的结论。
2.4 建构思维模型
模型认知是科学方法的重要构成。建构思维模型是引导无序思维向有序思维进化的有力推手,也是突破测试难点、优化问题解决的有效策略。
中学生缺乏完备的知识储备给有机合成路线设计带来巨大的挑战。建构并运用有机合成思维模型(见图1)是解决16(5)题问题的有效策略。
对比原料CH3、 FCH2OH
与产品CH3OCHO
的结构差异,发现需在CH3
的—CH3邻位引入OCHO
,F合成路线中A+BC的转化提供了—O—的引入途径,CDE的转化提供了将—NO2转化为—OH的途径,而知识储备可提供在CH3
的邻位引入—NO2的方法和—CH2OH氧化获得—CHO的方法,再结合A→B的转化中A分子结构中—F邻位的—CHO不干扰—O—形成,而—CH2OH是否会干扰—O—生成在中学阶段无从考证,从确保方案严谨的角度选择先将—CH2OH氧化为—CHO再由FCHO
与CH3OH
反应的转化顺序。
中学生缺乏充分的专业训练给补充实验方案设计带来较大的困难。建构并运用实验方案设计的思维模型(见图2)是解决17(4)题问题的有效策略。
该题要求由MnCO3制备MnO2,明确“热解、酸浸”等制备原理,题17图-2呈现热解步骤的干扰因素并为温度选择提供依据,“MnO与酸反应生成Mn2+;Mn2O3氧化性强于Cl2,加热条件下Mn2O3在酸性溶液中转化为MnO2和Mn2+”明示除去MnO2中MnO和Mn2O3的方法,并提供了酸浸时选择酸的依据。为获得较高产率的MnO2,热解温度选择450℃左右(此时热解产物中MnO2所占比例最大),酸浸选择1mol·L-1 H2SO4(防止盐酸被Mn2O3氧化为Cl2)并加热搅拌,选择BaCl2检验固体洗涤是否完全(该环节检验SO2-4没有其他干扰,检验时无须使用盐酸)
在补充实验方案时,按实验流程顺序清楚表述每个操作步骤的条件控制、操作细节(试
剂添加方式、促进转化措施、该步骤完成的表征)、检验的现象与结论等。
在参考答案中,因為该题“热解”环节加热至恒重难以达成、“酸浸”环节至固体不再溶解难以观察,所以分别采用“分解一段时间”“加热搅拌一段时间”的表述。
此外,江苏省2021年高考化学卷通过精心遴选中国古代科技文明(第1题)、现代科技成就(第12题)、体现化学对人类发展和社会进步的贡献(第2、 4、 10、 16、 17题)、立足实践探索(第3、 9、 11、 13题)、秉承可持续发展意识和绿色化学理念(第6、 7、 8、 14、 15、 18题)等源于生产生活和学习探索的真实情境,引导学生在问题解决的过程中弘扬爱国情怀、培植科学精神、强化责任担当、启迪创新意识等,充分体现出高考“立德树人”的核心功能;通过问题解决中学生表现出来的“理解与辨析、分析与推理、归纳与论证、探究与创新”等关键能力发展以及对应的“化学观念、思维方法、实践探索、态度责任”等学科素养水平的评价,为高校选才提供了信度、区分度较高的依据,很好体现了高考“服务选才”的核心功能。
参考文献:
[1]中国高考报告学术委员会. 高考评价体系解读[M]. 北京: 现代教育出版社, 2021: 1~4.
[2]中华人民共和国教育部. 普通高中化学课程标准(2017年版)[S]. 北京: 人民教育出版社, 2018: 65~67.
[3]经志俊, 徐光静. 基于素养导向的高中化学教学主张[J]. 化学教学,2021, (9): 35~40.
[4]经志俊. 基于教学内容结构化的教学主张[J]. 化学教学, 2019, (10): 28~32.

