邻苯二甲酸二乙基己酯与双酚A联合染毒对小鼠学习记忆障碍及淀粉样前体蛋白酶解通路的影响
刘佳欣,付朝旭,代霖,金慧玲,许妍姬
延边大学医学院预防医学教研室,延吉 133002
增塑剂具有延展性、能够增加塑料的强度及稳定性,因此在现代生产生活中被大量应用到塑料制品中[1-2],邻苯二甲酸二乙基己酯(diethylhexyl phthalate, DEHP)是产量最大且被使用最为广泛的一种增塑剂,也是人类经常暴露的环境污染物[3];由于DEHP与塑料之间仅依靠键能较弱氢键或范德华力连接,其结合不紧密,导致了环境污染和对机体的毒性损伤[4],本文将探讨其对神经毒性的影响。另一种增塑剂双酚A(bisphenol A, BPA),是一种烷基酚类的环境内分泌干扰物,其在生殖毒性、肝脏毒性和免疫毒性方面的研究已得到证实[5-8];随着发展与进步,BPA的神经毒性逐渐受到关注。
DEHP和BPA这类的环境污染物对机体神经系统具有负面影响,现有研究表明,孕期母体摄入的DEHP会影响子代小鼠的神经发育[9];人体主要通过经口、呼吸吸入、医疗和皮肤接触等途径暴露于DEHP中[10],BPA主要经过环境和食物等途径进入人体,在机体中能够通过胎盘屏障和血脑屏障,从而损害中枢神经[11]。阿尔兹海默病(Alzheimer disease, AD)作为一种典型的中枢神经系统退行性疾病,起病隐袭且病程较为缓慢,容易受环境污染物的影响,淀粉样前体蛋白(APP)酶解通路异常是AD致病机制中的重要过程。相关塑料制品的磨损老化以及高温、强酸、强碱等条件下的使用使得人体经常同时暴露于2种毒物中。以往的研究中DEHP和BPA二者的单独毒性作用均已得到证实[10-12],实际生产生活中,由于人体经常会同时暴露在DEHP与BPA的环境中,其联合毒性引发的安全问题需要重新进行探讨;为探究二者的联合毒性作用,为职业场所和生活场所DEHP和BPA联合暴露导致的健康问题提供实验参考和科学依据,本次实验对小鼠进行联合染毒并采用动物行为学测试和生化指标的检测,探讨BPA与DEHP联合染毒的毒性作用与机制以及对小鼠学习记忆能力的影响。
1 材料与方法(Materials and methods)
1.1 实验动物
选择80只SPF级昆明(Kun Ming, KM)种雄性小鼠,体质量为(20.0±2.0) g,由延边大学动物科学实验中心提供;在延边大学医学院动物饲养房集中饲养5 d,光、暗周期交替,温度控制在22~25 ℃,相对湿度保持在40%~70%。
1.2 实验仪器与试剂1.2.1 实验仪器
酶标仪(美国伯腾仪器有限公司,型号BioTek)、超声波细胞破碎机(上海乔跃电子有限公司,型号JY96-Ⅱ)、电泳仪(上海碧云天生物科技有限公司,型号165-8033)、小动物避暗穿梭测试仪(北京众实迪创,型号YLS3TB)和小动物跳台记录仪(北京众实迪创,型号YLS-17B)、Morri水迷宫(上海欣软,型号XR-XM101)、高速冷冻离心机(Thermo Electron,型号CR3i)。
1.2.2 实验试剂
双酚A(纯度99.0%,上海化成工业发展有限公司)、邻苯二甲酸双(2-乙基己基)酯(纯度99.0%,梯希爱(上海)化成工业发展有限公司)、吐温80(纯度99.0%,天津市科密欧化学试剂有限公司);丙二醛(MDA)、乙酰胆碱酯酶(AchE)、单胺氧化酶(MAO)、过氧化氢酶(CAT)试剂盒均购于南京建成生物工程有限公司;APP、PS1、tau、BACE1、tubulin抗体(赛默飞世尔科技(中国)有限公司);Aβ1-42酶联免疫试剂盒、β-分泌酶和γ-分泌酶联免疫分析试剂盒(上海酶联生物科技有限公司)。
1.3 试剂配制
将DEHP与吐温80(Tween-80)按照体积为1∶1助溶,并使用双蒸水配制成浓度分别为100、250和500 mg·kg-1的染毒液。将1 mg BPA溶解于10 mL的无水乙醇,加入1 L水配制成1 mg·L-1的染毒液;2种毒物均采用灌胃染毒的方式对小鼠进行染毒处理。
1.4 实验分组与模型建立
白金等[13]通过对小鼠进行染毒,研究DEHP对雄性小鼠大脑皮质氧化损伤及Bcl-2、Bax蛋白表达影响,结果表明,DEHP各染毒组的大脑皮质Bcl-2蛋白表达减少,500 mg·kg-1和1 000 mg·kg-1剂量组Bax蛋白表达增高,提示DEHP可致小鼠大脑皮质氧化损伤及凋亡相关蛋白改变;冯强伟[14]进行了DEHP联合甲醛暴露实验,生化指标测试结果表明,1.0 mg·m-3和3.0 mg·m-3甲醛与500 mg·kg-1DEHP以及联合暴露组1.0 mg·m-3甲醛+50 mg·kg-1DEHP和3.0 mg·m-3甲醛+500 mg·kg-1DEHP可以导致小鼠氧化损伤、炎症反应。本次实验以此为依据确定了染毒暴露组浓度[14]。选择80只昆明种小鼠,随机分为8组,每组各10只,具体分组如表1所示。
BPA和DEHP处理组每天按照0.01 mL·g-1的剂量对小鼠进行灌胃染毒,对照组按照相同比例的剂量给予双蒸水(double distilled water, DDW)灌胃处理,各组均自由摄食、饮水,连续染毒42 d。实验期间,每天观察小鼠的毛色、呼吸和状态,并记录各组小鼠的体质量、摄食量以及饮水量。

表1 实验分组与染毒剂量(n=10)Table 1 Experimental grouping and exposure dose (n=10)
1.5 动物行为学实验1.5.1 小鼠Morris水迷宫测试
实验周期的第42天进行小鼠Morris水迷宫训练,训练期间照常定时给药。水迷宫由直径为1.2 m的圆形水池构成,水池分为4个象限,平台位于第4象限,水池水位位于平台上2 cm处,由顶部摄像头进行录像拍摄。实验过程中,水温保持在(23±1) ℃。实验前5 d为定位航行实验:每次将小鼠的头朝向池壁,分别从1、2、3、4象限的固定位置投入水池中,时长为60 s,记录小鼠从不同象限游上平台的时间,在平台停留5 s为成功上台;若未能成功找到平台,则通过引导棒将其引导上台,并让小鼠在平台停留10 s,增强学习记忆能力。每间隔24 h训练一次,训练5 d;第6天、第7天、第9天进行空间探索实验,将小鼠从平台对角线的象限固定点投入水中,记录路线、穿台次数和目标象限停留时间,以此来测试小鼠的空间学习记忆能力。
1.5.2 小鼠避暗实验
第6周时训练,分为模拟训练和正式测试。将小鼠放进避暗仪的明箱中,使其消除恐惧,适应环境;3 min后打开明暗室的隔板,开启避暗仪进行测定,电压设定为36 V,持续记录5 min,24 h后进行相同的测试为正式测试,记录小鼠第1次从明箱到暗箱受到电击所用的时间和小鼠从明箱穿梭到暗箱受到电击的次数,即其潜伏期和错误次数。
1.5.3 小鼠跳台实验
第6周时进行训练,分为模拟训练和正式测试2部分。实验开始之前将动物放入跳台箱内适应3 min,底部通电,动物受到电刺激,正常反应时跳上平台躲避伤害性刺激,染毒作用的小鼠会削弱这种反应记忆能力;第2天将小鼠再次重复该操作,进行正式测试,时间设置为5 min,观察并记录小鼠从绝缘平台跳下所花费的时间和小鼠从平台跳下的次数,即逃避潜伏期和跳台错误次数。
1.6 生化指标的测定1.6.1 小鼠脑组织MDA含量以及MAO、AchE、CAT活性的检测
小鼠处死后置于冰上取脑,用天平称其1/4的质量,按照9(mL)∶1(g)的比例加入生理盐水,置于冰上用粉碎机进行粉碎,2 500 r·min-1离心10 min,取其上清液,严格按照试剂盒说明书对样本进行检测。
1.6.2 ELISA法检测脑组织中β、γ-分泌酶活性和Aβ1-42含量
小鼠处死后置于冰上取脑,用天平进行准确称量,按照9(mL)∶1(g)的比例加入PBS,置于冰上用粉碎机粉碎,离心后取上清液,采用ELISA法进行检测。严格按照说明书进行操作。
1.6.3 脑组织中APP、PS1、BACE1和Tau蛋白表达水平的检测
采用蛋白印迹法,杀鼠后将脑组织加入RIPA缓冲液和PMSF,充分研磨,超声粉碎,再次加入PMSF,冰上孵育30 min,离心后取上清液,严格根据说明书测得蛋白浓度。在SDS-PAGE凝胶中进行电泳,取样量为20 μL,电泳后转移印记至PVDF膜,洗涤液洗涤,封闭液封闭2 h,加入一抗后在摇床中震荡1.5 h后,4 ℃冰箱孵育过夜,次日回收一抗,洗涤后在摇床中孵育二抗1 h,回收二抗,再次洗涤,曝光取影,观察各组蛋白表达水平。
1.7 免疫组化染色
将固定在10%福尔马林固定液中的脑组织依次进行脱水、石蜡包埋、切片、HE染色、封片和显微镜观察等操作,观察脑组织海马区的形态及结构差异。
1.8 联合毒性评价分析
目前联合染毒作用评价方式主要有浓度加和模型(CA)、效应相加模型(ES)、独立作用模型(IA)和联合指数法(CI)[15-16]。为更具有统计学意义,本实验采用效应相加模型进行评价。该模型假设各物质之间不存在相互作用,将这2种毒物联合处理时的毒性效应作为“实测值”,单独处理时的毒效应作为“预测值”,2个值进行显著性差异分析判断其联合作用;若该项指标实测值大于预测值,联合染毒作用表现为协同作用。
1.9 统计学方法
采用SPSS26.0软件进行单因素方差分析,组间差异使用LSD-t的检验方法,P<0.05为具有统计学差异。
2 结果(Results)
2.1 小鼠Morris水迷宫实验
空间探索结果表明,对照组小鼠穿台次数明显高于其他组,目标象限停留时间较长,空间探索具有较强的目的性;DEHP和BPA单独作用组小鼠轨迹杂乱,对于平台的记忆能力较弱;联合染毒组几乎不穿过目标象限,轨迹极其不规律,空间探索能力很差;与对照组相比,差异性具有统计学意义(P<0.05)(表2和图1)。

表2 定位航行实验逃避潜伏期Table 2 Evasion incubation period of positioning navigation experiment n=10)

图1 各组空间探索实验活动轨迹Fig. 1 The trajectory of each group of space exploration experiments
2.2 避暗和跳台实验
与对照组相比,BPA或DEHP单独染毒组以及联合染毒组的潜伏期缩短,错误次数明显增加(P<0.05),联合染毒组与其对应的单独染毒组比较,其逃避潜伏期与错误次数均具有统计学意义(P<0.05)(图2)。
2.3 小鼠脑组织MDA含量以及MAO、AchE和CAT活性的检测结果
与对照组相比,染毒组MDA含量、MAO和AchE活性逐渐增加,脑组织中CAT活性逐渐降低,具有显著差异性(P<0.05);联合染毒组与对应的单独染毒组相比,MDA含量、MAO和AchE活性明显增加,CAT活性明显降低(P<0.05),实测值超过其理论值,表现为协同作用(表3)。
2.4 小鼠脑组织β、γ-分泌酶活性和Aβ1-42的含量
与对照组相比,单独染毒组与联合染毒组的β、γ-分泌酶活性和Aβ1-42的含量增多(P<0.05),联合染毒组与其对应的单独染毒组比较,β、γ-分泌酶活性和Aβ1-42的含量增加更明显(P<0.05)(图3)。
2.5 蛋白表达水平
与正常组对比,单独染毒组APP、PS1、BACE1和Tau蛋白表达水平明显增强(P<0.05),其中,联合染毒组APP、PS1、BACE1和Tau的蛋白表达水平明显高于单独染毒组(P<0.05)(图4)。
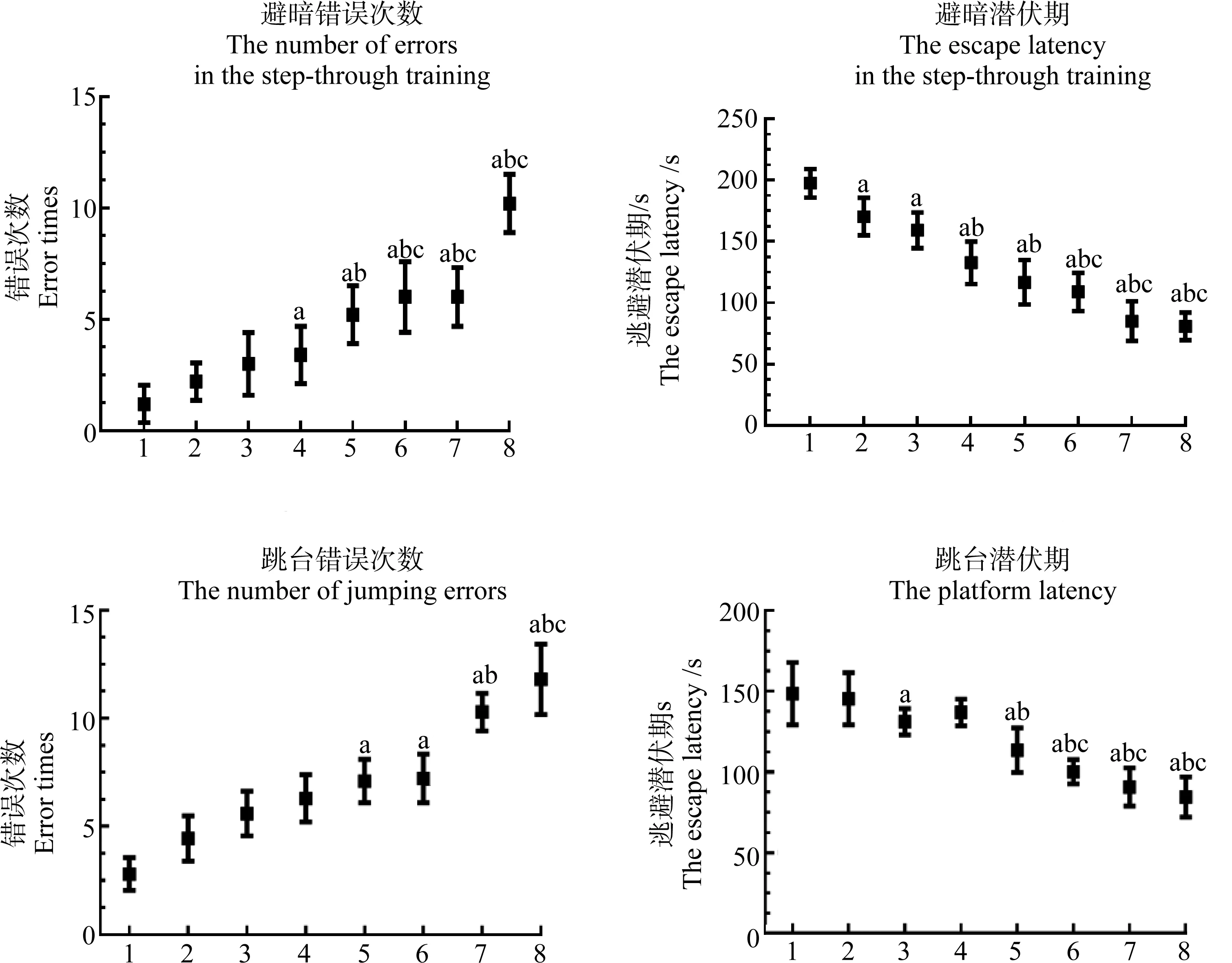
图2 各组避暗、跳台实验潜伏期和错误次数的比较注:a表示与CT组比较,P<0.05;b表示与BPA组比较,P<0.05;c表示与相同剂量DEHP染毒组比较,P<0.05;1表示CT组,2表示BPA组,3表示低DEHP组,4表示中DEHP组,5表示高DEHP组,6表示低DEHP+BPA组,7表示中DEHP+BPA组,8表示高DEHP+BPA组。Fig. 2 Comparison of the latency and the number of errors in the dark avoidance and platform jump experiments in each groupNote: a means compared with CT group, P<0.05; b means compared with BPA group, P<0.05; c means compared with the same dose of DEHP group, P<0.05; 1 indicates CT group; 2 indicates BPA group; 3 indicates low dose DEHP group; 4 indicates medium dose DEHP group; 5 indicates high dose DEHP group; 6 indicates low dose DEHP+BPA group; 7 indicates medium dose DEHP+BPA group; 8 indicates high dose DEHP+BPA group.
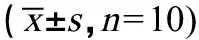
表3 小鼠脑组织中丙二醛(MDA)含量、单胺氧化酶(MAO)、乙酰胆碱酯酶(AchE)和过氧化氢酶(CAT)活性的比较Table 3 Comparison of malondialdehyde (MDA) content and the activities of monoamine oxidase (MAO), acetylcholinesterase (AchE) and catalase (CAT) in mouse brain tissue n=10)
图3 小鼠脑组织中β-分泌酶、γ-分泌酶活性和Aβ1-42含量注:a表示与CT组比较,P<0.05;b表示与BPA组比较,P<0.05;c表示与相同剂量DEHP染毒组比较,P<0.05;1表示CT组,2表示BPA组,3表示低DEHP组,4表示中DEHP组,5表示高DEHP组,6表示低DEHP+BPA组,7表示中DEHP+BPA组,8表示高DEHP+BPA组。Fig. 3 The activities of β-secretase, γ-secretase and Aβ1-42 content in mouse brain tissueNote: a means compared with CT group, P<0.05; b means compared with BPA group, P<0.05; c means compared with the same dose of DEHP group, P<0.05; 1 indicates CT group; 2 indicates BPA group; 3 indicates low dose DEHP group; 4 indicates medium dose DEHP group; 5 indicates high dose DEHP group; 6 indicates low dose DEHP+BPA group; 7 indicates medium dose DEHP+BPA group; 8 indicates high dose DEHP+BPA group.
2.6 脑组织海马区HE染色结果
采用HE染色方法对小鼠进行脑组织石蜡切片并染色,观察其海马区形态变化及病理性特征。对照组形态正常,海马神经元细胞排列整齐,颜色较浅,形态正常;单独染毒组排列不规则且杂乱,染色颜色较深。联合染毒组与其对照组相比:其细胞核较多,颜色较深,呈现出更深的颜色,排列极其不规则(图5)。
3 讨论(Discussion)
DEHP与BPA经常联合暴露于职业环境和室内空气环境中,例如,化工行业用作原料生产的各类塑料制品、医疗器械和餐饮食品外包装等[17-18],二者联合毒性作用值得探讨。
环境污染物是近年来影响健康的不可忽视因素,日常暴露的环境污染物除了损伤呼吸系统、循环系统和肝脏系统外,大脑亦是其攻击的靶点之一[19],AD作为最常见的一种神经退行性疾病,与环境污染物的暴露存在密切关系。Feng等[20]的研究表明,DEHP的潜在神经毒性机制可能与cAMP-PKA-ERK1/2-CREB信号传导和Ca2+信号传导途径协同介导相关,这与本实验发现的APP酶解通路异常存在潜在的关联性。DEHP由于可以通过血脑屏障,接触后会在大脑中积累,通过调节突触前膜Ca2+通道的活力对中枢神经系统产生影响;现有研究表明,DEHP是一种过氧化物酶体增殖剂,通过激活生物体内过氧化物酶体增殖物从而激活受体(PAPR),使活性氧为主的各种自由基增加,从而导致氧化应激[21-22],加速细胞凋亡,与本实验MDA、CAT、MAO和AchE等生化指标的检测结果相符。研究表明,BPA通过影响神经元细胞的迁移,造成神经递质和突触可塑性的形成障碍,降低海马体中椎体神经元的树突棘密度,影响突触可塑性持续重塑,因此难以建立复杂的大脑神经元网络[23],从而引起认知功能障碍和学习记忆能力的衰退。
行为学实验结果表明,BPA与DEHP均会对小鼠学习记忆能力产生消极影响,使其空间定位能力出现障碍,联合染毒组神经毒性作用明显高于单独染毒组,使用效应相加模型进行评价,表现为协同作用。

图4 各组APP、PS1、BACE1和Tau蛋白表达注:a表示与CT组比较,P<0.05;b表示与BPA组比较,P<0.05;c表示与相同剂量DEHP染毒组比较,P<0.05;1表示CT组,2表示BPA组,3表示低DEHP组,4表示中DEHP组,5表示高DEHP组,6表示低DEHP+BPA组,7表示中DEHP+BPA组,8表示高DEHP+BPA组。Fig. 4 APP, PS1, BACE1 and Tau protein expression in each groupNote: a means compared with CT group, P<0.05; b means compared with BPA group, P<0.05; c means compared with the same dose of DEHP group, P<0.05; 1 indicates CT group; 2 indicates BPA group; 3 indicates low dose DEHP group; 4 indicates medium dose DEHP group; 5 indicates high dose DEHP group; 6 indicates low dose DEHP+BPA group; 7 indicates medium dose DEHP+BPA group; 8 indicates high dose DEHP+BPA group.
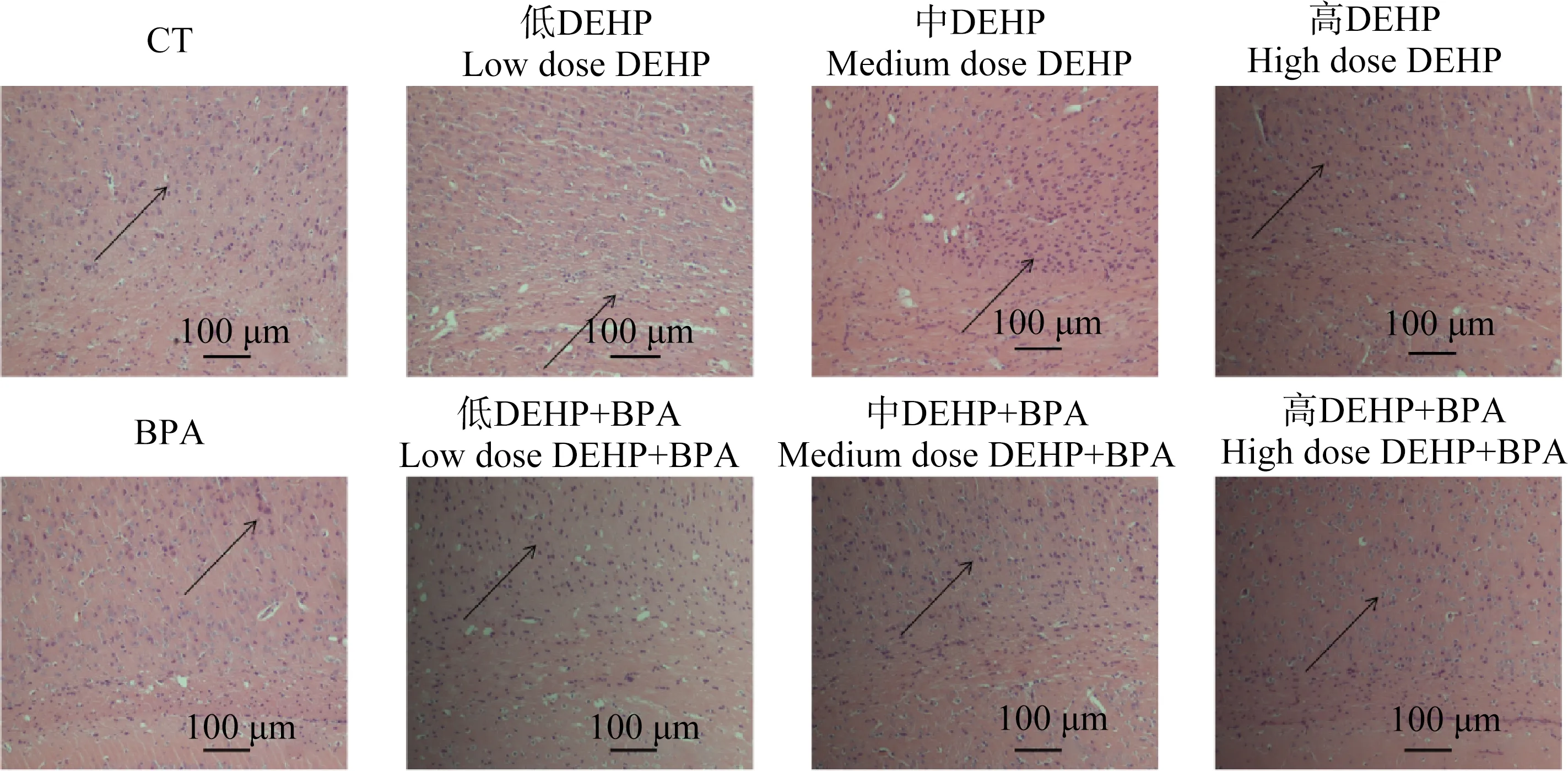
图5 苏木精-伊红(HE)染色小鼠海马组织神经元形态Fig. 5 Hematoxylin-Eosin (HE) staining neuron morphology of mouse hippocampus
为进一步探讨其毒性作用及机制,对MDA、CAT、MAO和AchE等生化指标进行检测。结果提示,随着DEHP浓度增加,MDA含量、MAO和AchE活性逐渐增加,联合染毒组MDA含量、MAO和AchE活性增加明显,实测值超过其理论值,表现为协同作用。联合染毒组与对照组及单独染毒组相比,脑组织中CAT活性逐渐降低,通过观察其活性可以判断经联合染毒处理的小鼠脑组织氧化应激损伤程度更高;提示联合染毒处理组的小鼠体内活性氧作用增加,抗氧化能力降低,抵抗衰老和认知功能障碍的能力减退[24]。神经递质释放量的正常与稳定,是保证学习记忆能力的重要环节[25-26];本实验中生化指标结果显示染毒处理组小鼠脑组织中单胺类神经递质与乙酰胆碱类神经递质含量减少,提示其发生学习记忆功能障碍。
秦晋等[27]研究发现,DEHP可引起INS-1细胞氧化应激,使线粒体膜电位降低,诱导细胞凋亡。异常的细胞代谢反过来会影响β-淀粉样蛋白(amyloid, Aβ)和过度磷酸化Tau蛋白的产生与积累,这会加剧线粒体功能障碍和活性氧(ROS)的产生,从而导致恶性循环[28-29]。Aβ由APP经过β、γ-分泌酶水解产生,正常情况下APP经α-分泌酶水解产生可溶性的SAPP-α和CTFα,此途径可阻止Aβ的形成和沉积[30],而经过γ-分泌酶水解会产生异常的Aβ,目前认为Aβ1-42是细胞外淀粉样变性的主要成分,神经元内的病变也与Aβ1-42相关。实验结果显示,各染毒处理组β、γ-分泌酶活性增加,Aβ1-42含量增加,联合染毒组相比单独染毒组酶活性增加更为明显。
APP酶解通路是造成学习记忆障碍和AD发病的关键机制,相关中枢神经系统过度磷酸化的Tau神经原纤维缠结(NFTs)和细胞外淀粉样老年斑(SP)是AD的主要病理变化特征[29](图6)。神经原纤维缠结的主要成分是异常沉积的tau蛋白,SP的核心成分是Aβ[31-32]。本实验通过测定相关生化指标及蛋白表达发现DEHP与BPA联合染毒对小鼠学习记忆损伤作用与APP酶解通路异常有关。

图6 淀粉样前体蛋白(APP)酶解通路示意图Fig. 6 Schematic diagram of amyloid precursor protein (APP) processing pathway
联合染毒毒性作用评价目前主要有浓度加和模型(CA)、效应相加模型(ES)、独立作用模型(IA)和联合指数法(CI)[15-16]。本次实验选择了效应相加模型判断,通过效应相加模型研究可知,DEHP与BPA二者联合染毒,毒性作用增强,表现为协同作用,这与化学毒物自身的结构及内部相关反应结合有关,有待于进一步探讨。未来降低环境污染物的重要途径可以是研发DEHP和BPA的替代品,从根源上降低环境污染物对机体神经系统、生殖系统等方面的损害作用,从而降低和避免环境污染物联合暴露对人类造成的损害。
综上所述,BPA与DEHP联合染毒对小鼠脑组织具有明显的神经毒性作用,其联合作用表现为协同作用,造成小鼠的认知功能障碍,损伤神经系统结构,机制可能与氧化应激及APP酶解通路异常相关,更深的分子生物学机制有待于进一步的研究。
通讯作者简介:许妍姬(1973—),女,博士,教授,主要研究方向为神经毒理学。

