传粉蜜蜂介导的细菌耐药性传播及其生态与健康风险
黄渝岚,史晶亮,刘芮芮,罗义2,,*
1. 南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津 300350 2. 南京大学环境学院,污染控制与资源化研究国家重点实验室,南京 210093
随着抗菌药物的问世,各类抗菌药物相继在医疗卫生、畜牧养殖等领域得到广泛使用,但由于抗菌药物的长期不合理使用或滥用,造成了临床和环境中普遍存在细菌耐药性问题。近几十年,抗菌药物耐药性(antimicrobial resistance, AMR)已对全球临床治疗病原菌感染构成严重挑战,增加了临床病原菌感染后的致死率,威胁了人类健康[1-2]。不仅如此,携带耐药基因(antibiotic resistance genes, ARGs)的病原菌可能通过污水处理系统进入受纳环境,影响生态环境健康[3-7]。同时,ARGs能借助可移动遗传元件(mobile genetic elements, MGEs)在环境中实现细菌间的水平基因转移(horizontal gene transfer, HGT),加速了细菌耐药性的广泛传播。以往关于环境中细菌耐药性的传播主要集中于大气迁移[8]、再生水灌溉[9-10]、有机肥施肥[11-12]以及各种进入人类食物链的农产品[13-14]。近些年有研究发现环境中的苍蝇(HelaeomyiapetroleiL.)、蟑螂(PeriplanetaamericanaL.和BlattellagermanicaL.)会将人畜共患的食源性病原体传播给其他动物和人类,这其中可能伴随着ARGs的传递[15]。至此,研究人员陆续关注起一些市场上可食用昆虫的耐药性,例如蝗虫(Locustamigratoria)、蟋蟀(Achetadomesticus)和蝎子(Heterometruslongimanus)等,以调查昆虫相关食品的食用安全性[16-17]。
地球上3/4的作物品种需要昆虫授粉,蜜蜂作为最主要的授粉昆虫承担了80%左右的授粉工作量,是地球上食物网的重要参与者,极大地提高了农作物的产量和品质。因此,蜜蜂的健康直接关系着食品安全和生态环境安全[18-19]。然而,人类对于蜜蜂介导的细菌耐药性传递仍然知之甚少。蜂群在传粉过程中与周围环境之间发生频繁的交流,尤其是觅食工蜂在采集各种花卉植物的花蜜和花粉以及附近的水源过程中,很容易造成蜜蜂与作物以及周围环境的交叉污染。目前,动植物、土壤和水环境普遍受到抗生素、农药等化学品的污染[20-24],而蜂群本身在饲养过程中也经常因为预防或治疗蜜蜂疾病而暴露于抗生素、杀螨剂等药物[25]。因此,蜜蜂有可能成为生态系统中细菌耐药性传播的参与者和驱动者。本文以蜜蜂肠道耐药基因组为核心,归纳总结了蜜蜂的药物暴露途径及其对蜜蜂肠道耐药基因组的潜在影响,系统分析了蜜蜂介导下的细菌耐药性潜在传播途径,并在此基础上对未来蜜蜂肠道耐药基因组相关研究作出展望,希望从传粉蜜蜂的角度对缓解细菌耐药性的传播,改善生态环境并保障人类健康提供理论指导。
1 细菌耐药性(Bacterial resistance)
1.1 细菌耐药性的形成和传播机制
目前,细菌耐药是全球公共卫生领域的重要议题,而赋予细菌耐药的ARGs被定义为一种新型环境污染物[26]。虽然ARGs在细菌中的检出时间早于青霉素发现时间(1928年),但不可否认的是,抗生素的滥用和误用明显加速了ARGs的进化,促进了ARGs的增殖和传播[27]。细菌产生耐药性的生物学机制主要包含[28]:(1) 对抗生素分子进行酶抑制,导致抗生素分子被破坏或发生化学改变;(2) 改变细菌的膜通透性;(3) 细菌的外排泵表达增加,加速对抗生素的排出;(4) 改变抗生素药物作用靶点。耐药基因既可通过垂直传递的方式即亲本菌株赋予子代细菌耐药性,也可借助由质粒、整合子、转座子和噬菌体等MGEs以水平基因转移的方式在细菌之间传播,后者甚至被发现可以跨细菌种属传递ARGs,是ARGs传播的主要形式[27]。水平基因转移主要包括3种机制,分别是:游离DNA转化、噬菌体转导和接合转移。总之,通过多样的耐药性机制以及多种耐药基因转移机制使细菌耐药性不断增强,对人类和动物健康构成威胁。
1.2 蜜蜂肠道菌群的抗生素耐药性
动物肠道是ARGs的重要储库,而肠道微生物是ARGs的主要宿主。肠道微生物面临抗生素的选择性压力时,会对耐药细菌(antibiotic resistance bacteria, ARB)产生富集作用,并促进ARGs在肠道细菌之间的水平转移[29]。自20世纪50年代以来,欧美养蜂人就开始以土霉素(OTC)作为治疗和预防蜜蜂患美洲幼虫腐臭病或欧洲幼虫腐臭病的主要措施[30]。约半个世纪后,美国和阿根廷相继报道了幼虫芽孢杆菌对OTC的耐药性[31-32],并发现蜂群里对OTC耐药的幼虫芽孢杆菌中含有携带tetL耐药基因的可移动质粒pMA67[33-34]。随后,研究人员陆续在蜜蜂肠道内分离到多重耐药的革兰氏阴性菌(肠杆菌科等)和部分革兰氏阳性菌(金黄色葡萄球菌等)[35-37],Ludvigsen等[38]在蜜蜂肠道共生菌中检测到了介导链霉素抗性的可移动遗传元件转座子。以上结果表明蜜蜂肠道可能是一个潜在的ARGs“储存库”。
1.3 蜜蜂肠道菌群的农药抗性
农药抗性是指细菌在农药的长期作用下发生适应性进化,形成各种保护机制来躲避农药的危害,逐步形成对农药的抗性[39]。此前,已有大量研究表明,昆虫肠道共生菌可能通过调节宿主的内源性解毒途径来改变宿主的农药抗性[40-41],并进一步证实了昆虫肠道共生菌与农药抗性之间的关系[42]。最近一项研究发现蜜蜂的肠道菌群可以通过促进P450解毒酶基因的表达来提高蜜蜂对农药的抗性[43],说明蜜蜂消化道里的肠道菌也具备形成农药抗性的潜力。蜜蜂肠道共生菌对宿主免疫调节、营养吸收和有害物质代谢具有重要的作用[44]。今后或许可以通过提高蜜蜂肠道共生菌群对农药的降解能力(农药抗性)来降低农药对蜜蜂的毒害作用。
1.4 蜜蜂肠道菌群的抗生素-农药交叉耐药性
大量研究表明,抗生素以外的化学物质也可以通过交叉抗性机制来选择和刺激抗生素耐药性,包含杀菌剂、杀虫剂和重金属等[45-47]。细菌在受到抗生素以外的药物暴露后会进一步表现出对抗生素的耐药性。因此,杀虫剂、杀菌剂和除草剂暴露会改变细菌的抗生素耐受性[48]。例如,细菌在抗生素和农药的多重选择压力下可以获得抗生素-农药交叉耐药性。当ARGs和农药抗性基因都位于同一可移动的遗传元件上时,获得该遗传元件的细菌也会表现出抗生素-农药交叉耐药性。Rangasamy等[49]的研究也证明质粒会参与农药和抗生素的耐药性传播,并提出细菌的酶可能是抗生素-农药交叉耐药性形成的重要原因。因此,获得农药耐药性的细菌通常也能表达抗生素耐药性。研究发现农药能够显著富集环境中的农药降解微生物AMR和抗生素耐药细菌[50-51],农药抗性菌株大都对一种或多种抗生素产生耐药性,且接合质粒在农药抗性和抗生素抗性传播中起着重要作用[52]。蜜蜂在养殖过程中会频繁暴露于各种药物条件下,而不少研究均报道了抗生素、杀螨剂、除草剂及新烟碱类化合物会扰乱蜜蜂肠道微生态[53-57]。目前关于蜜蜂体内是否富集有抗生素-农药交叉耐药的肠道菌群还未见报道,根据蜜蜂养殖过程的药物暴露场景,推测蜜蜂体内可能会富集具有抗生素-农药交叉耐药性的肠道共生菌。此外,蜜蜂是一种生存在高度密集环境的社会性昆虫,主要依赖交哺行为来获得组成稳定而简单的肠道菌群,这将增加多重耐药菌和耐药基因在环境中传播扩散的风险,对生态安全构成威胁。
2 蜜蜂肠道耐药基因组的潜在影响因素(Potential factors affecting the gut resistome of honeybees)
微生物包括微生物所在的宿主的暴露环境通常是复杂的,环境中存在的任何对细菌产生选择性压力的物质或条件变化都可能对细菌耐药基因组产生影响,越来越多的研究表明抗生素、农药、重金属、消毒剂和离子液体等对ARGs具有富集作用[39, 58-62]。一直以来抗生素的使用被普遍认为是导致细菌耐药及其传播扩散的“罪魁祸首”。抗生素不但会促进ARB和ARGs的进化和增殖,还可能会加速ARB向人类和动物传播的风险,如抗生素促进环境耐药致病菌在动物体内定殖[63]。蜜蜂肠道内稳定定植着8种核心菌群,分别为LactobacillusFirm-4、LactobacillusFirm-5、Gilliamellaapicola、Snodgrassellaalvi、Bifidobacteriumspp.、Frischellaperrara、Bartonellaapis和Parasaccharibacterapium,总丰度超过99%[64]。研究发现蜜蜂肠道中的核心细菌具有明显的多重耐药性[38,65],一旦入侵蜜蜂的致病菌获得多重耐药性,将对蜂群健康产生很大影响。影响蜜蜂肠道耐药基因组的潜在因素主要包括2个方面:(1) 抑菌药物及重金属、微塑料等环境污染物的作用;(2) 环境因素,主要包括地理因素和气候因素。同时,各个影响因素之间还存在一定交互作用。
2.1 环境污染物的影响
抗生素、农药等抑菌药物的长期和大量使用是造成细菌耐药性日益增强的主要原因。通常,在面对高浓度抑菌药物暴露时,细菌可通过自发突变产生AMR[66],也能通过细菌间水平基因转移的方式获取耐药质粒,从而产生抗性,但携带耐药质粒的细菌在无长期药物暴露条件下会产生适合度代价,主动降低细菌群体的耐药性水平[67]。然而,当各类抗菌药物在环境中长期持留时,细菌会产生相对稳定的适应性进化,这种进化机制造成ARB的增殖和传播。以往研究表明,蜜蜂长期暴露于抗生素可以导致肠道细菌耐药性的积累[68-69],而且随着抗生素暴露浓度的增加,ARGs的总丰度显著增加[70]。
不仅抗生素与其他环境污染物会造成蜜蜂肠道细菌的交叉耐药,各类抗菌药物的不同组合联用也会对肠道耐药组造成显著影响,从而造成细菌的多重耐药。例如,美国过去长期使用土霉素、四环素以及氨苄青霉素治疗蜜蜂,在美国蜜蜂肠道细菌中能够鉴定出几种不同的四环素抗性基因(TCr),具有TCr的蜜蜂肠道细菌也对土霉素、四环素和氨苄青霉素表现出明显的抗性;而挪威不使用抗生素治疗蜜蜂,因此该地区的蜜蜂肠道中较少检测到TCr,蜜蜂肠道细菌也不对抗生素产生明显耐药性[68]。此外,AMR通常由MGEs介导在环境细菌中发生水平转移。大量研究表明,抗菌药物会促进AMR在环境中的传播。同一个MGEs上可能存在多个AMR位点,MGEs具有从环境中捕获AMR的能力[38, 71-72]。最近的研究发现昆虫肠道细菌能通过MGEs以水平基因转移的方式获得外部环境ARGs[73],导致昆虫肠道细菌产生多重耐药性。Tian等[68]的研究证明,给蜜蜂长期饲喂土霉素,会导致蜜蜂肠道菌群对四环素与土霉素产生多重耐药性。除了抗生素外,消毒剂也会造成ARGs在细菌间的水平转移,例如,Zhang等[46]的研究表明,亚抑菌浓度的消毒剂会促进ARGs在属内和属间的水平转移。
此外,重金属、纳米材料和微塑料等其他环境污染物通过影响环境细菌间MGEs的传播,促进细菌产生多重耐药性[74-76]。以微塑料为例,水产养殖环境中抗生素污染导致的耐药细菌会依附在水体环境中的微塑料上,各种水体微生物及耐药细菌借助微塑料实现富集和广泛传播[76]。值得一提的是,有研究发现蜜蜂暴露于抗生素后会显著增加其暴露于微塑料的健康风险,这是由于蜜蜂肠道菌群对微塑料有一定的降解作用,而抗生素对蜜蜂肠道菌群造成破坏,最终加强了微塑料对蜜蜂的亚致死作用。这表明环境污染物对生物体的影响存在着协同效应,相关生物学机制还有待于进一步阐明[77-78]。
综上所述,以抗生素、农药为主的各类农用化学品暴露可能会对蜜蜂肠道细菌产生长期的选择性压力,促进其进化,从而产生药物抗性;而以重金属、微塑料为主的其他环境污染物暴露不仅会增加抗菌药物对环境细菌的选择性压力,同时还会影响细菌间ARGs的传播,从而对蜜蜂肠道耐药组造成潜在的影响。
2.2 环境因素的影响
许多研究表明,光照、温度、pH和溶解氧等环境因素的变化会对ARGs的传播造成一定程度的影响。极端环境条件(高温、强酸/强碱、长期厌氧和长期光照等)能够通过加速ARGs的降解、富集16S rDNA以及抑制ARGs的分布来降低环境中的ARGs的相对丰度[79-84],从而抑制环境细菌之间ARGs的传递、减少携带ARGs的环境细菌数。研究发现,当环境条件剧烈变化时,环境中ARGs数量会消减[83-84],可能是因为环境细菌在剧烈变化的环境中难以生存导致的。同时,钱燕云等[84]发现磷与Ⅰ类整合子(intI1)具有显著相关性,表明营养元素也可能是促进细菌间ARGs传播的环境因素之一。上述研究也表明环境条件一定程度上将影响细菌耐药性。
全球气候变化也与细菌耐药性密切相关。MacFadden等[85]发现细菌耐药性与平均最低温度有关,由于全球气温不断升高,导致细菌耐药性一直处于增长状态。并且随着全球变暖,洪涝、干旱等极端天气事件发生频率逐渐增加。有文献报道,洪水会引起污水管道中的污水溢出或牲畜污染,从而促进水环境中耐药细菌和ARGs的传播[86-87]。尤其氮肥造成的洪水污染会导致水体富营养化,促进细菌耐药性增强[86-87]。Garner等[88]研究发现,尽管洪水后河水及沉积物中ARGs的总丰度下降,但一段时间后,严重污染地点的ARGs的总丰度恢复至接近洪水前,同时水体中多重耐药细菌数量增加。这是由于水体中含有亚致死浓度的抗生素,从而通过刺激水平基因转移来促进ARGs的传播,造成水体中细菌的多重耐药[89]。洪涝、干旱等灾害还会导致卫生基础设施减少,人口密度增加,促进致病菌感染率增加[86]。随着细菌耐药性的日益增加,抗生素的使用剂量逐渐增加,抗生素滥用频发,从而形成促进细菌耐药性及其传播的致命循环。
细菌群落结构的变化是细菌耐药性改变的主要因素之一[90],而环境因素能够对环境细菌和肠道细菌群落结构造成一定影响。蜜蜂肠道菌群结构随季节发生变化,寒冷季节蜜蜂肠道菌群主要由厌氧菌组成,在温暖季节则普遍存在需氧菌[91],Clark[92]认为这可能与蜜蜂活动周围特定植物的开花周期有关。同时,Kešnerová等[93]的研究指出冬、夏两季蜜蜂肠道菌群结构存在差异,冬季蜜蜂具有较夏季蜜蜂更高的肠道细菌丰富度和更低的群落α多样性。有文献报道,环境因素的变化可能影响昆虫体内ARGs的发生率[94]。因此,气温、降水、海拔等环境因素可能通过影响ARB在蜜蜂肠道定殖的适宜度,从而影响蜜蜂肠道耐药组组成。
3 环境污染物对蜜蜂的暴露途径(Exposure pathways of environmental contaminants to honeybees)
随着农药和抗生素类药物的大量使用,农药和抗生素的环境污染日趋严重。而蜜蜂在传粉过程受到农药和抗生素残留的影响,蜜蜂传粉特性让其有望成为周边环境农药污染监测的生物指示器(通过检测蜜蜂身体及其携带的花粉、花蜜中的污染指标)[95]。研究人员调查世界各地蜂蜜中新烟碱类杀虫剂残留情况,发现48%的蜂蜜样品有超过0.10 ngg-1浓度残留[96]。最新研究对中国各地蜂蜜残留新烟碱类杀虫剂的调查结果显示,来源于经济作物的蜂蜜比非经济作物的蜂蜜更容易受到新烟碱类杀虫剂的污染[97],说明种植作物时使用杀虫剂会造成蜂蜜体内杀虫剂的残留,即使是采用环保高效的种子包衣形式也会使蜜蜂受到杀虫剂的污染[98]。值得注意的是,研究人员系统调查了除草剂草甘膦对蜜蜂个体和种群健康的影响,虽然接触该农药不会对蜜蜂个体产生急性致死效应,但会干扰蜜蜂肠道的核心菌群,进而影响蜜蜂个体和种群健康以及蜜蜂的授粉活动[99]。作者在野外采样时也从许多蜂农那里了解到他们在蜜蜂养殖过程中对于除草剂使用的担忧,甚至养殖过程中能明显感受到除草剂使用对蜜蜂的毒害作用[99]。另外,蜂蜜体内也经常被检测出抗生素以及杀螨剂残留。除了蜂蜜,蜂花粉、甚至在蜂蜡内都能频繁检出各种药物残留[100-102]。同时,在养殖蜜蜂环境周围,也可能存在抗生素暴露,例如人类活动区和动物养殖区排放的生活污水进入河渠和土壤环境后污染养蜂场附近水源和蜜粉源植物,这些环境中的抗生素残留会通过蜜蜂的传粉活动增加上述污染物对蜜蜂的暴露。此外,蜜蜂在其觅食活动中与环境相互作用,使其暴露于环境污染物中,例如工业生产区的排放废水、废气和农业生产使用的肥料、农药中的重金属、微塑料及金属纳米材料等都成为污染物对蜜蜂的“暴露源”,蜜蜂成为这些环境污染物的“主动取样器”[103-107]。最终,这些环境污染物在蜜蜂体内积累,影响蜜蜂肠道菌群健康[77]。
总体来说,蜜蜂的污染物暴露主要包括以下来源(图1):(1) 蜂群用药(野生蜂除外)——养蜂人员经常使用各种药物来控制或预防蜜蜂疾病,如使用抗生素来治疗蜜蜂幼虫病等,使用杀螨剂来控制蜜蜂寄生螨害,相当于对蜜蜂进行直接暴露;(2) 植物源药物污染——蜜蜂在野外觅食过程中可能接触到施药后的植物花蜜、花粉和叶片上的残留药物,喷洒的农药、杀虫剂和杀螨剂等可能以粉尘的形式传播进入种植作物附近的蜂群[108];(3)环境水、土壤污染——蜜蜂可能通过饮用人类活动区、畜禽养殖及工业区排放的废水,使得蜂群受到废水中的药物残留污染。同时,土壤污染也可能通过授粉植物间接对蜜蜂肠道菌群产生暴露。因此,当蜜蜂暴露于环境中残留的抗生素、农药等多种污染物时,这些环境污染物可能通过其授粉、采集花蜜等行为活动对蜜蜂个体和种群肠道菌群构成选择性压力,进而产生药物抗性和蜜蜂肠道菌群的进化。与此同时,蜜蜂在传粉过程中与植物和环境之间发生细菌和基因间的交流与传播,介导细菌耐药性在一定范围传播。
4 蜜蜂介导的细菌耐药性传播(Honeybee-mediated transmission of bacterial resistance)
4.1 蜜蜂与蜜蜂之间的细菌耐药性传播
以往研究发现在蜜蜂肠道内定居的几种核心肠道细菌具有明显的多重耐药性[38, 65]。而蜜蜂肠道中也被频繁检出MGEs,如耐药质粒[33-34]、转座子[38],可能作为蜜蜂肠道中共生菌与致病菌间耐药性传递的重要基因元件[109]。因此,无论是致病细菌还是共生细菌体内MGEs上的ARGs,都可能对蜜蜂健康构成潜在风险。蜜蜂肠道耐药基因组可由微生物介导,通过蜜蜂的社会性接触行为进行水平传播,也可通过蜂王遗传给后代的方式进行垂直传递。此外,人工养殖蜂群经常需要在全国各地进行跨区域转场,以便蜜蜂可以采集各个花期的花蜜,这种饲养模式可能会造成蜂群耐药性的长距离传播,与输送地蜂群和野生蜂群进行ARGs交流;蜂王引种是蜂农在养蜂生产实践中的必要操作,可以强壮蜂群,为了避免近亲繁殖,引进的蜂种通常来自距离很远的地区,这也是造成蜂群耐药性传播的潜在方式。换言之,蜂群转场和蜂王引种2种养殖情况都是细菌耐药性广泛传播的途径。
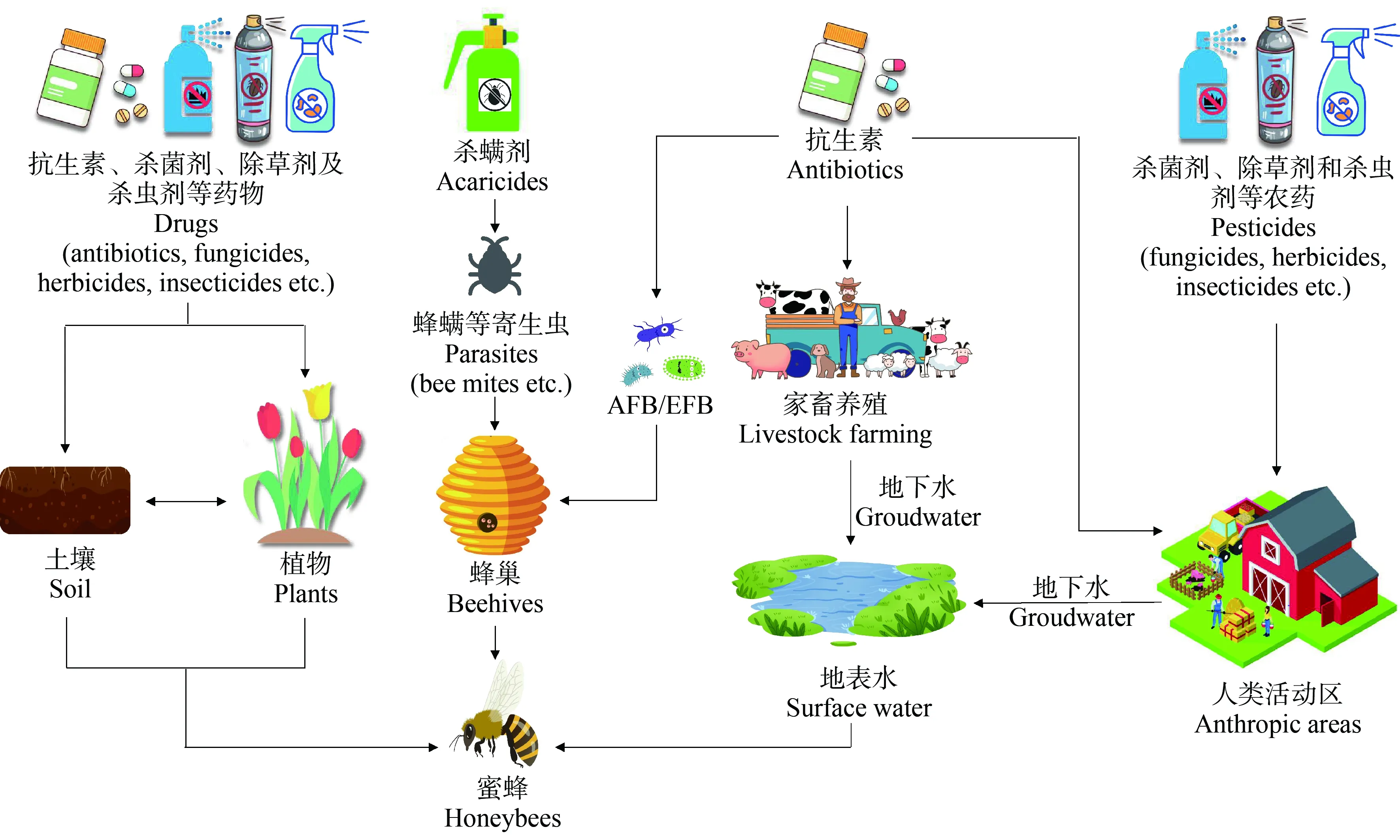
图1 环境污染物对蜜蜂的主要暴露途径注:AFB表示美洲幼虫腐臭病,EFB表示欧洲幼虫腐臭病。Fig. 1 Major environmental pollutants exposure pathways in honeybeesNote: AFB indicates American foulbrood and EFB indicates European foulbrood.
此外,当其他传粉者(例如蝴蝶、熊蜂等)与蜜蜂处于交叉觅食区域时,因收集某一范围内的共享花卉资源,蜜蜂可以将ARB传播给其他传粉者[110](图2 O),促进AMR的传播。Alger等[111]发现RNA病毒可以将传粉植物的花朵作为中间载体,从管理蜜蜂(Apismellifera)体内传递到野生熊蜂(Bombusspp.)体内。此外,蜜蜂之间的耐药性传递会间接引发蜂产品的大面积污染,从而给人类健康带来安全隐患(图2 I、图2 J、图2 K和图2 L)。构建人类命运共同体符合同一健康(One-Health)理念,昆虫种群健康最终关系到人类健康,对于传粉昆虫保护和维持生态系统稳定性具有重大战略意义。
4.2 蜜蜂与植物之间的细菌耐药性传播
有研究证明携带病原体的传粉蜜蜂会向造访花朵输送病原体[112],并且传粉活动成为植物传播病原体的重要媒介[111]。蜜蜂传粉者可以在植物之间以及植物和蜜蜂之间进行有益微生物的传递,例如传播植物花粉中的链霉菌不仅可以增强植物抗病能力,也有助于蜜蜂免受病原体的侵害[113]。但目前关于传粉蜜蜂与植物之间的细菌耐药性传播还鲜有研究,至今还没有研究数据。如果植物中的微生物能够借助昆虫活动或食物网实现耐药性传播[114],传粉蜜蜂也可能通过这些途径加速耐药基因的潜在传播与扩散。蜜蜂在采集植物花粉、花蜜时会频繁地跟植物进行微生物的交流,这一行为给蜜蜂与植物之间的细菌耐药性传播提供了机会(图2 D和图2 E)。尽管野生蜂没有受到蜂群管理过程中的药物暴露影响,但仍有研究人员在野生熊蜂的肠道内分离到了携带多重ARGs的菌株[115],这可能与蜜蜂通过植物或植物本身向野生熊蜂间接传递耐药细菌有关(图2 O)。驯养蜜蜂主要包括西方蜜蜂(Apismellifera)和我国本土中华蜜蜂(Apiscerana),它们是造访大宗蜜源的主力军,其在养殖过程中频繁的药物暴露可潜在促进食物网中细菌耐药性传播,尤其是生产的蜂产品(蜂蜜、蜂花粉和蜂胶等)直接进入食物链,关系到人类的食品安全与健康(图2 K和图2 L)。Li等[116]研究发现,中国蜂蜜中富集了多种ARGs,其中喹诺酮类、氯霉素类和氨基糖苷类是最主要的ARGs类型,蜂蜜中富集的ARGs可能对公众健康构成潜在威胁。因此,饲养蜜蜂包括西方蜜蜂和中华蜜蜂及其生产的蜂产品的细菌耐药性问题需要引起关注。
4.3 蜜蜂与周围环境之间的细菌耐药性传播
蜂群采集蜂向花卉植物进行蜜蜂与植物共生菌之间的细菌耐药性传播的同时(图2 D、图2 E和图2 N),蜜蜂也会促进与周围环境之间细菌耐药性的传播。如果从整个生态系统的角度去研究细菌耐药性的传播还涉及到土壤,因为土壤是植物赖以生存的基础,土壤中大量的微生物与植物内生菌之间存在频繁的交流与传播[117-119]。大量研究表明,向土壤施加有机肥会促进细菌耐药性向植物体各个组织器官的传播[114-115,120-121],植物花朵是土壤和传粉蜜蜂进行微生物交流的桥梁,可作为传粉蜜蜂肠道菌群与土壤环境细菌之间间接交流的媒介,这也意味着传粉蜜蜂的肠道耐药组也会受到农业生产实践活动的间接影响(图2 F)。最近的一项研究更是证实了土壤微生物对毛虫肠道微生物的直接影响[122],这使我们更加意识到生态系统的循环对于微生物及其细菌耐药性传播的重要性。
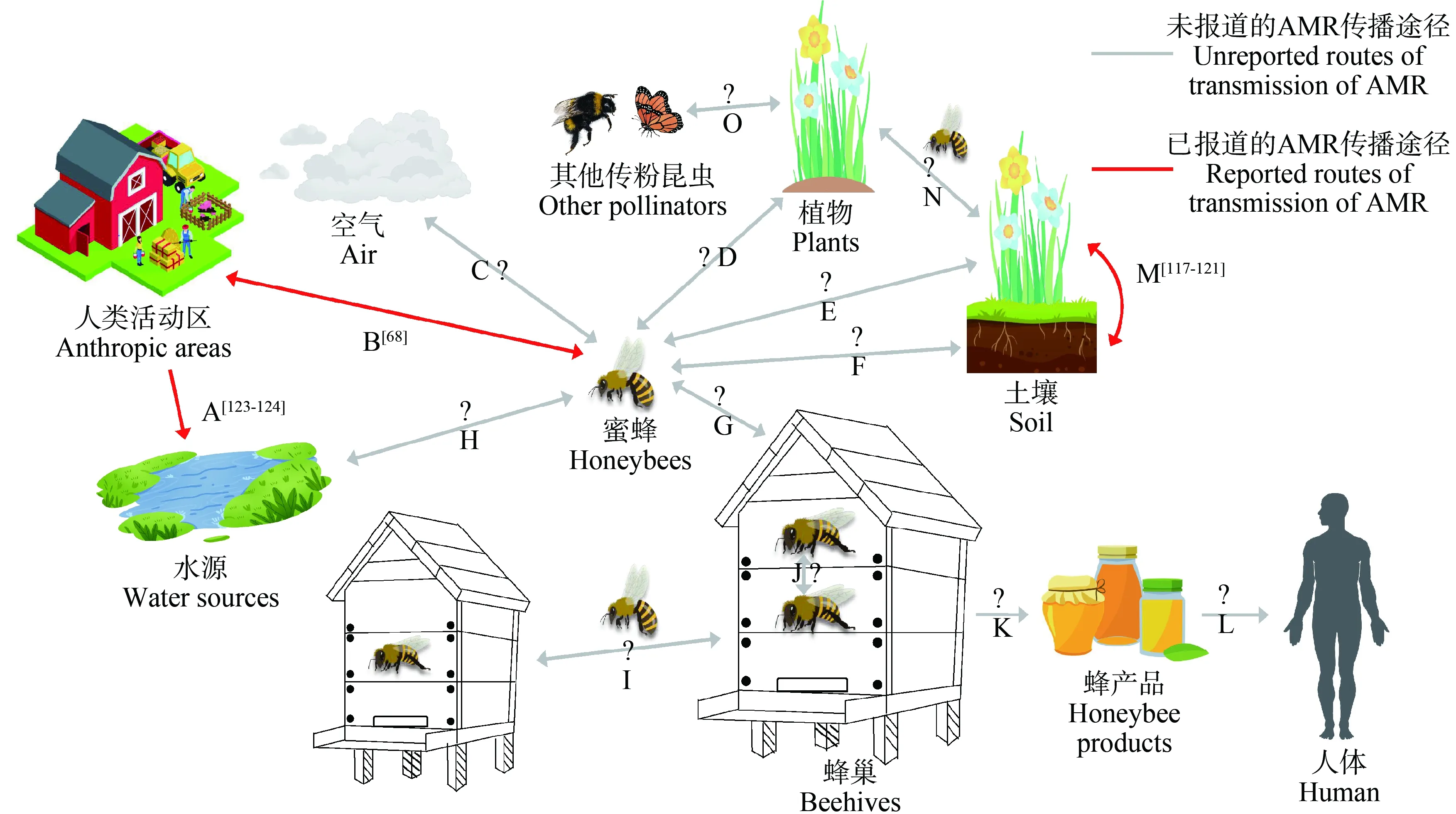
图2 传粉蜜蜂介导下的潜在耐药性传播途径注:A. 人类活动区中的抗菌药物耐药性(AMR)可以通过畜牧场、农场废水以及人类排泄物排放转移到水源中;B. 人类活动区与蜜蜂之间的AMR交流传递;C. 空气与蜜蜂之间的AMR交流传递;D和E. 植物与蜜蜂之间的AMR交流传递;F. 借助植物实现土壤与蜜蜂之间的AMR交流传递;G. 蜜蜂与蜂巢之间的AMR交流传递;H. 蜜蜂与水源之间的AMR交流传递;I. 借助蜜蜂活动实现蜂巢与蜂巢之间的AMR交流传递;J. 蜜蜂与蜜蜂之间的AMR交流传递;K. 植物、蜜蜂以及蜂巢中的AMR通过蜜蜂的酿造活动转移至蜂产品中;L. 人类通过食用蜂产品获取蜂产品中的AMR;M. 植物与土壤之间的AMR交流传递;N. 借助传粉昆虫实现植物之间的AMR交流传递;O. 植物与其他传粉昆虫之间的AMR交流传递。Fig. 2 Potential transmission routes of drug resistance mediated by pollinating beesNote: A. Antimicrobial resistance (AMR) from human activity areas can be transferred to water sources through livestock farms, farm effluent, and human fecal discharges; B. AMR communication and transmission between human activity areas and honeybees; C. AMR communication and transmission between the air and the bees; D and E. AMR communication and transmission between plants and honeybees; F. Using plants to realize AMR communication and transmission between soil and honeybees; G. AMR communication and transmission between honeybees and beehives; H. AMR communication and transmission between honeybees and water sources; I. AMR communication and transmission between beehives through honeybee activities; J. Communication and transmission of AMR between honeybees; K. AMR from plants, honeybees, and beehives is transferred to honeybee products through honeybee brewing activities; L. Human access to AMR in honeybee products through consumption; M. AMR communication and transmission between plants and soil; N. Plant to plant AMR communication and transmission by pollinators; O. AMR communication and transmission between plants and other pollinators.
蜜蜂除了采蜜、采粉以外,采水也是一项非常重要的工作,对保证蜂群日常饮用水和蜂群的筑巢、控温控湿都不可或缺。因此,水源对于养蜂场是非常重要的。近年来在河流里面检测到的超级ARB和ARGs不在少数[123-124]。受污染严重的水源,尤其是医疗废水、制药厂废水和养殖场废水往往具有很严重的抗生素耐药现象,蜜蜂一旦获得水源里携带的ARB,可能会造成整个蜂群甚至更大范围的细菌耐药性传播。同时,蜂群的细菌耐药性也会通过采水蜜蜂传播至水源,进而造成水源的污染(图2 H)。Tian等[68]的研究证明,蜜蜂肠道菌群中的大多数ARGs都是从环境中获得的,与来自人类或畜禽养殖的病原体特征基因的序列同源性高达99%,说明人类活动与饲养蜂群之间存在ARGs的交流。另外值得注意的是,空气污染对蜂群耐药性的影响。研究发现灰霾天气的空气中会悬浮着更丰富的ARB,而空气污染也可能会通过降雪等方式进行ARGs的广泛传播[8]。目前已有研究揭示空气污染对蜜蜂健康的亚致死效应[125],空气污染是否对蜜蜂肠道细菌耐药产生影响还不得而知(图2 C),这也是未来研究需要关注的。因此,开展蜜蜂与蜜蜂、蜜蜂与植物、蜜蜂与其周围环境耐药性的传播研究对于同一健康(One health)战略具有重要的意义。
5 研究蜜蜂肠道耐药基因组的意义(Implications of studying the gut resistome of honeybees)
5.1 对蜂群健康的意义
蜜蜂作为一种具有高度社会性行为的昆虫,蜂群内部蜜蜂个体之间和蜂群与蜂群之间都会进行频繁的社会性接触,这为蜜蜂之间的病原体传播提供了便利。长达半个多世纪,蜜蜂深受蜂群病原体和寄生虫的困扰,如细菌感染引发的幼虫病,寄生螨及伴随的的残翅病毒影响蜜蜂发育,真菌感染引起的孢子虫病、白垩病等。此外,还有大量抗生素、杀螨剂等的使用。这些原因导致了蜂群耐药性越来越严重,药物治疗蜜蜂疾病效果越来越差的窘况。随着世界各地蜜蜂种群数量的不断减少,蜂群疾病的暴发引起了研究人员的高度重视。在2006年发现蜂群崩溃综合症(colony collapse disorder, CCD)现象后,科学家几乎在同一时间发表了完整的蜜蜂基因组序列,为未来研究蜜蜂疾病提供了重要基础。本文从蜜蜂肠道耐药基因组的角度阐述了蜂群耐药性及其影响因素,不仅可以评估蜂群的健康状况,也为蜂群抗菌药物的合理使用提供参考。最后,调查蜜蜂肠道耐药基因组与污染物之间的联系有助于改善蜂群健康,指导养蜂生产实践,并且可能对破译蜂群CCD现象提供理论依据。
5.2 对人体健康的意义
蜜蜂给人类提供了营养和药用价值俱佳的蜂产品,如蜂蜜、蜂花粉、蜂王浆和蜂胶等,所以蜂群细菌耐药性的暴发会对蜂产品质量和食用安全性带来不利影响。已有研究发现,蜂蜜有可能携带ARB和ARGs[116,126-127],而蜂蜜中细菌耐药性的出现与蜂蜜的来源、质量以及卫生状况有关[128]。除此之外,人类食用的大量农产品都离不开蜜蜂的授粉服务,蜜蜂向农作物传播AMR会严重影响全球农产品安全,威胁人体健康,并有可能通过人类活动进行食物网传播。研究蜜蜂肠道耐药基因组可以从养蜂实践和田间农业生产实践2个方面制定准确的预防措施以防止细菌耐药性的传播扩散,尽量避免蜜蜂“好心办了坏事”的情况发生。
5.3 对环境健康的意义
随着全球健康一体化“One World, One Health”的倡导,越来越多与食物网中细菌耐药性传播相关的生物和环境因子被考虑进来,包括动植物、土壤、水和空气等[114,129]。理论上,受环境污染物暴露严重且具有较大迁移性或者活动范围广的生物或环境介质是关注的重点。但是,也有可能受到学科发展的限制,有些重要的传播AMR的生物被研究人员忽视了,或者说关于这类生物传播AMR的研究工作还远远不够。本文主要介绍的是蜜蜂这类传粉昆虫对于生态系统中细菌耐药性传播的潜在影响。蜜蜂作为全球分布最广、数量最为庞大的一种传粉昆虫[130],对生态系统稳定性和生物多样性保护具有不可替代的作用。蜜蜂是少数可以介导不同环境介质和部分生物体之间AMR频繁交流的生物,同时人工饲养的蜂群也长期频繁暴露于各种环境污染物中。受蜂群病原体和寄生虫的影响,蜂群内所有蜜蜂被迫暴露于抗生素、杀螨剂等药物;受野外植物大量喷洒农药的影响,蜂群经常暴露于农药环境下,蜜蜂农药中毒事件层出不穷。所以,蜜蜂在授粉的同时会不自主地向农作物传播环境污染物,促进蜂群与植物之间细菌耐药性的传播。同时,植物花及植物体周围也会向造访的蜜蜂传递ARB和ARGs,这也是为什么把蜜蜂作为周边环境污染的指示生物的主要原因[103,131-132]。此外,蜜蜂每天飞行10~15次,平均一天可以采集1 000朵花,能够在距离蜂房半径<1.5 km的范围内频繁活动[131,133],在蜜蜂介导下可能会极大地促进植物体间细菌耐药性的传播。事先了解蜂群耐药性情况可以有效预防蜜蜂与环境之间的细菌耐药性传播,也可以减少蜜蜂通过共享的植物蜜粉源向其他野生授粉昆虫传播AMR。所以,研究蜜蜂肠道耐药基因组对于评估周围环境污染状况,量化环境健康风险以及规避细菌耐药性的扩大化传播具有重要意义。
6 展望(Prospect)
目前,蜜蜂肠道耐药基因组的相关研究还处于起步阶段,有关蜜蜂肠道耐药基因组的组成分布和影响因素研究很少开展,蜜蜂对ARGs传播的贡献还知之甚少。我国作为世界第一养蜂大国,通过对蜜蜂尤其是我国本土蜂种——中华蜜蜂的肠道微生物组和耐药组的调查,对正确认识蜜蜂介导的细菌耐药性在生态系统中传播的贡献具有重要意义,同时对于我国蜂产业健康发展与蜂种保护奠定理论基础。未来对蜜蜂肠道耐药基因组的研究重点可集中在以下3个方面。
(1)完善蜂群的污染物暴露来源,揭示蜜蜂的真实暴露场景,同时建立药物残留溯源方法。在此基础上综合评估蜜蜂的药物暴露风险,提高蜂产品食用安全性。
(2)探究驱动蜜蜂肠道细菌耐药性产生的主要影响因素以及药物交叉抗性的形成机制,如抗生素的使用、农药的污染等,以减少蜂群耐药性,提升蜂产品质量安全。
(3)深入开展蜜蜂介导下的细菌耐药性传播研究,充分认识蜜蜂介导的耐药基因在不同介质中的传播途径,尤其是蜜蜂-蜜蜂、蜜蜂-植物、蜜蜂-周围环境以及蜜蜂-蜂产品的传播途径,以便制定更加有效的控制对策,有效遏制ARGs的全球性传播。
通讯作者简介:罗义(1971—),女,博士,教授,博士生导师,主要研究方向为污染生态学和生态毒理学。

