肌肉生长抑制素基因敲除对2型糖尿病小鼠白色脂肪棕色化及相关基因表达的影响研究
程经纬,柳杨青,汪艳芳
肌肉生长抑制素(Mstn)是1997年发现的于骨骼肌中高表达的转化生长因子β超家族成员之一,又称为生长分化因子8,其从小鼠骨骼肌cDNA文库克隆,对肌肉量起负调节作用[1]。除影响肌肉生长分化外,Mstn还具有调节脂代谢的作用。文献报道,Mstn可在体外抑制前体脂肪细胞的分化;特异性敲除Mstn基因后,高脂或正常饮食喂养的小鼠均表现为脂肪量减少,肌肉量增加[2-3]。本研究观察Mstn基因敲除的2型糖尿病(T2DM)小鼠白色脂肪棕色化相关基因表达变化,探究Mstn对T2DM小鼠白色脂肪棕色化的影响。
1 材料与方法
1.1 实验动物 野生型(wild type,WT)小鼠12只,杂合型Mstn基因敲除〔Mstn(+/-)〕小鼠12只,纯合型Mstn基因敲除〔Mstn(-/-)〕小鼠12只,SPF级,品系C57BL/6N,6周龄,雄性,由赛业生物科技有限公司提供〔动物实验许可证号:SCXK(苏)2020-0006〕。小鼠适应性饲养1周,室内温度22~24 ℃,湿度40%~60%,保持昼夜12 h节律,自由进食、饮水。本研究实验过程遵循河南大学实验动物伦理相关规定,符合3R原则。本实验时间为2019年1月至2020年1月。
1.2 主要仪器与试剂 AU400全自动生化分析仪(美国Beckman公司);酶标仪(美国BioTeK公司);脱水机、包埋机、病理切片机(武汉俊杰电子有限公司);光学显微镜及成像系统(日本Nikon公司);脱色摇床、电泳仪(北京六一生物科技有限公司);链脲佐菌素(STZ,美国Sigma公司);游离脂肪酸(FFA)酶联免疫试剂盒、兔抗小鼠过氧化物酶体增殖物激活受体γ(PPAR-γ)、过氧化物酶体增殖物激活受体γ辅激活因子1α(PGC-1α)、解偶联蛋白1(UCP1)多克隆抗体(武汉云克隆科技股份有限公司);兔抗小鼠分化簇137(CD137)多克隆抗体(北京博奥森生物技术有限公司)。
本研究行业贡献:
目前的肥胖控制手段仍然有限,缺乏治疗肥胖和相关代谢性疾病的有效药物。白色脂肪主要用于储存热量,棕色脂肪主要负责产热。探究白色脂肪向棕色脂肪转化的调控机制以及对外部刺激的感应机制,有助于开发治疗肥胖的新药物。既往研究表明,肌肉生长抑制素(Mstn)可能调控脂肪代谢。本研究在Mstn基因敲除基础上构建2型糖尿病(T2DM)小鼠模型,探究Mstn对T2DM小鼠白色脂肪棕色化的影响,发现抑制Mstn基因表达可上调白色脂肪棕色化相关基因表达,促进T2DM白色脂肪棕色化,改善肥胖,为肥胖、T2DM等代谢性疾病的治疗提供了新策略及新靶点。
1.3 分组及动物模型构建 将12只WT小鼠、12只Mstn(+/-)小鼠、12只Mstn(-/-)小鼠随机各分为2组,每组6只,分别为WT组、WT+DM组,Mstn(+/-)组、Mstn(+/-)+DM组,Mstn(-/-)组、Mstn(-/-)+DM组,每组6只,其中WT组、Mstn(+/-)组、Mstn(-/-)组给予普通饮食6周,WT+DM组、Mstn(+/-)+DM组、Mstn(-/-)+DM组给予高脂饮食6周+STZ诱导构建T2DM模型。WT+DM组、Mstn(+/-)+DM组、Mstn(-/-)+DM组给予高脂饮食喂养6周后,在不禁食状态下以50 mg/kg腹腔注射2% STZ(柠檬酸钠缓冲液配制),72 h后禁食6 h,取尾静脉血,血糖仪检测空腹血糖≥16.7 mmol/L,并出现多饮、多食、多尿、消瘦症状,即可认为T2DM模型构建成功。WT组、Mstn(+/-)组、Mstn(-/-)组小鼠腹腔注射等剂量柠檬酸缓冲液。普通饮食:总热量为13.5 kJ/g,糖类、脂肪、蛋白质分别占66%、10%、24%;高脂饮食:总热量为18.7 kJ/g,糖类、脂肪、蛋白质分别占28%、56%、16%。
1.4 体质量、体长测定 建模前及建模成功后,用电子秤测定各组小鼠体质量,卷尺测定小鼠体长(鼻尖至肛门的距离),计算Lee's指数=体质量(g)1/3×1 000/体长(cm)。
1.5 血清三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、FFA水平检测 各组小鼠禁食6 h后取尾静脉血0.2 ml,以 3 000 r/min离心5 min,离心半径12 cm,留取上清液,应用全自动生化分析仪检测血清TG、TC、LDL-C、HDL-C水平;采用酶联免疫吸附试验(ELISA)检测血清FFA水平,严格按照试剂盒说明书进行操作。
1.6 白色及棕色脂肪质量测定 以上实验完成后将小鼠断椎处死,迅速解剖取出小鼠白色脂肪组织(腹股沟、附睾、肠系膜)、棕色脂肪组织(肩胛),吸取表面血液及体液,用电子秤称湿重。计算白棕比=白色脂肪质量(g)/棕色脂肪质量(g),脂肪指数=(白色脂肪质量+棕色脂肪质量)(g)/体质量(g)。将腹股沟白色脂肪组织及肩胛棕色脂肪组织一半保存于液氮中,一半保存于体积分数4%的中性甲醛溶液中,石蜡包埋固定。
1.7 白色及棕色脂肪组织形态分析 采用苏木精-伊红(HE)染色法观察脂肪组织形态。包埋好的白色及棕色脂肪组织标本切成4 μm厚薄片,二甲苯及酒精脱蜡,水洗;苏木精染液染色5 min,盐酸水溶液分化,氨水水溶液返蓝,水洗;伊红染液染色3 min,经梯度酒精及二甲苯脱水透明,中性树胶封固。脂肪组织切片均于光学显微镜下采集图像,采用Image J软件分析脂肪组织形态。
1.8 白色及棕色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量检测 采用Western-blotting法检测蛋白表达水平。取脂肪组织50 mg置于匀浆器,加入蛋白裂解液、蛋白酶抑制剂、磷酸酶抑制剂,反复多次匀浆及冰浴以确保完全裂解。将匀浆液转移至离心管中,以 12 000 r/min 离心 10 min(离心半径 12 cm)后留取上清液。BCA法配制标准蛋白和待测蛋白,37 ℃孵育30 min,用酶标仪测蛋白浓度,制作标准曲线。装好洁净干燥的玻璃板,根据蛋白大小配制分离胶和浓缩胶,分离胶灌至2/3处,40 min后灌入浓缩胶至顶,然后将梳子插入浓缩胶中,尽量避免气泡产生。静置10 min后加入电泳液,将样品缓慢加入电泳孔中,电压60 V,电泳至溴酚蓝到达底部时停止电泳。加入含有甲醇的转移缓冲液,电压60 V转膜2 h,将蛋白转移至聚偏氟乙烯(PVDF)膜。TBST缓冲液洗膜3次,10 min/次。质量分数5%脱脂奶粉封闭PVDF膜1 h。加入TBST缓冲液稀释一抗,4 ℃孵育过夜,TBST缓冲液洗膜3次,10 min/次。加入TBST缓冲液稀释二抗,室温下孵育1 h,TBST缓冲液洗膜3次,10 min/次。等体积ECLA液、ECLB液混匀,加至PVDF膜,1 min后除净残液并放入暗匣中曝光,然后依次放入显影液及定影液中至胶片透明,晾干,扫描胶片。以β-actin为内参蛋白,采用Image J软件分析目标条带的光密度值。
1.9 统计学方法 采用SPSS 22.0软件进行统计学分析,符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 六组小鼠体质量、体长、Lee's指数、白棕比、脂肪指数比较 本研究18只T2DM小鼠模型均构建成功。六组小鼠体质量、体长、Lee's指数、白棕比、脂肪指数比较,差异均有统计学意义(P<0.001)。其中Mstn(+/-)组白棕比低于WT组,差异有统计学意义(P<0.05);Mstn(-/-)组体质量高于WT组,体长低于WT组、Mstn(+/-)组,Lee's指数、白棕比均低于WT组、Mstn(+/-)组,差异有统计学意义(P<0.05);WT+DM组Lee's指数低于WT组,白棕比及脂肪指数高于WT组,差异有统计学意义(P<0.05);Mstn(+/-)+DM组白棕比及脂肪指数低于WT+DM组,差异有统计学意义(P<0.05);Mstn(-/-)+DM组体质量高于WT+DM组,体长长于WT+DM组,Lee's指数及白棕比均低于WT+DM组、Mstn(+/-)+DM组,脂肪指数低于WT+DM组,差异有统计学意义(P<0.05),见表1。
表1 六组小鼠体质量、体长、Lee's指数、白棕比、脂肪指数比较(±s)Table 1 Comparison of weight,body length,Lee index,white-brown fat ratio and fat mass index in six groups of mice
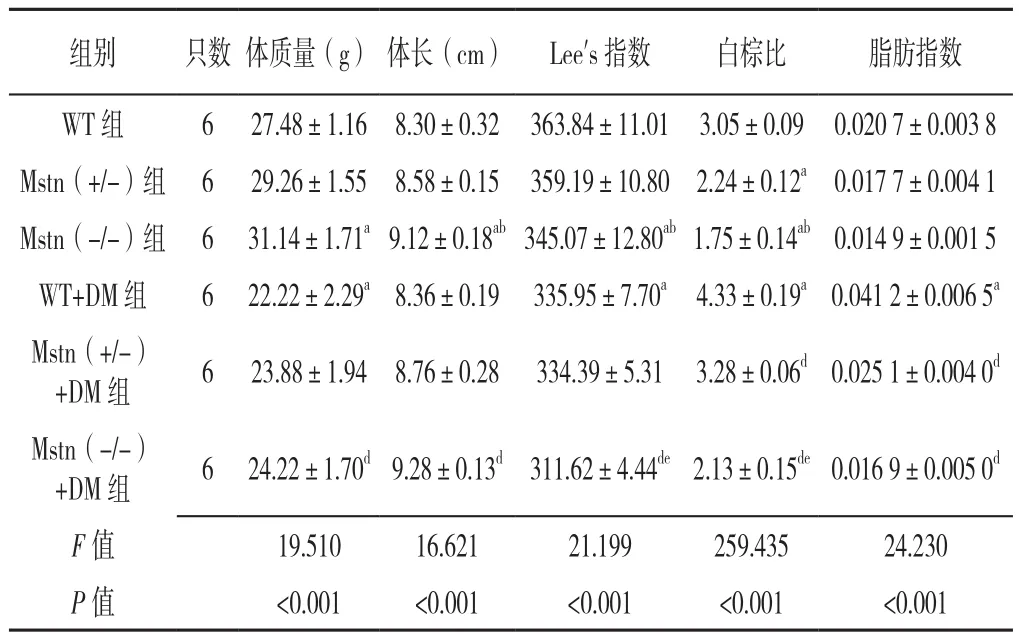
表1 六组小鼠体质量、体长、Lee's指数、白棕比、脂肪指数比较(±s)Table 1 Comparison of weight,body length,Lee index,white-brown fat ratio and fat mass index in six groups of mice
注:WT=野生型,Mstn=肌肉生长抑制素,Mstn(+/-)=杂合型Mstn基因敲除,Mstn(-/-)=纯合型Mstn基因敲除,DM=糖尿病;a表示与WT组相比P<0.05,b表示与Mstn(+/-)组相比P<0.05,c表示与Mstn(-/-)组相比P<0.05,d表示与WT+DM组相比P<0.05,e表示与Mstn(+/-)+DM组相比P<0.05
组别 只数 体质量(g) 体长(cm) Lee's指数 白棕比 脂肪指数WT 组 6 27.48±1.16 8.30±0.32 363.84±11.01 3.05±0.09 0.020 7±0.003 8 Mstn(+/-)组 6 29.26±1.55 8.58±0.15 359.19±10.80 2.24±0.12a0.017 7±0.004 1 Mstn(-/-)组 6 31.14±1.71a9.12±0.18ab345.07±12.80ab1.75±0.14ab0.014 9±0.001 5 WT+DM 组 6 22.22±2.29a8.36±0.19 335.95±7.70a 4.33±0.19a0.041 2±0.006 5a Mstn(+/-)+DM 组 6 23.88±1.94 8.76±0.28 334.39±5.31 3.28±0.06d0.025 1±0.004 0d Mstn(-/-)+DM 组 6 24.22±1.70d9.28±0.13d 311.62±4.44de2.13±0.15de0.016 9±0.005 0d F值 19.510 16.621 21.199 259.435 24.230 P 值 <0.001 <0.001 <0.001 <0.001 <0.001
2.2 六组小鼠血清TG、TC、LDL-C、HDL-C、FFA水平比较 六组小鼠血清TG、TC、LDL-C、HDL-C、FFA水平比较,差异均有统计学意义(P<0.001)。其中Mstn(+/-)组血清TC水平低于WT组,差异有统计学意义(P<0.05);Mstn(-/-)组血清TG水平低于WT组、Mstn(+/-)组,TC水平低于WT组,差异有统计学意义(P<0.05);WT+DM组血清TG、TC、LDL-C、FFA水平高于WT组,HDL-C水平低于WT组,差异有统计学意义(P<0.05);Mstn(+/-)+DM组血清TG、TC、FFA水平低于WT+DM组,HDL-C水平高于WT+DM组,差异有统计学意义(P<0.05);Mstn(-/-)+DM组血清TG、LDL-C、FFA水平低于WT+DM组,TC水平低于WT+DM组、Mstn(+/-)+DM组,HDL-C水平高于WT+DM组、Mstn(+/-)+DM组,差异有统计学意义(P<0.05),见表2。
表2 六组小鼠血清TG、TC、LDL-C、HDL-C、FFA水平比较(±s,mmol/L)Table 2 Comparison of levels of serum TG,TC,LDL-C,HDL-C and FFA of in six groups of mice

表2 六组小鼠血清TG、TC、LDL-C、HDL-C、FFA水平比较(±s,mmol/L)Table 2 Comparison of levels of serum TG,TC,LDL-C,HDL-C and FFA of in six groups of mice
注:TG=三酰甘油,TC=总胆固醇,LDL-C=低密度脂蛋白胆固醇,HDL-C=高密度脂蛋白胆固醇,FFA=游离脂肪酸;a表示与WT组相比P<0.05,b表示与Mstn(+/-)组相比P<0.05,c表示与Mstn(-/-)组相比P<0.05,d表示与WT+DM组相比P<0.05,e表示与Mstn(+/-)+DM组相比P<0.05
组别 只数 TG TC LDL-C HDL-C FFA WT组 6 1.17±0.06 2.84±0.23 0.36±0.02 0.66±0.04 0.62±0.01 Mstn(+/-)组 6 1.11±0.03 2.45±0.21a 0.37±0.02 0.67±0.03 0.62±0.01 Mstn(-/-)组 6 1.02±0.06ab 2.51±0.05a 0.43±0.13 0.67±0.01 0.61±0.01 WT+DM 组 6 1.62±0.06a 5.13±0.20a 0.50±0.03a 0.38±0.01a 0.78±0.02a Mstn(+/-)+DM 组 6 1.44±0.04d 4.27±0.18d 0.49±0.02 0.44±0.02d 0.72±0.01d Mstn(-/-)+DM 组 6 1.38±0.02d 3.81±0.18de 0.43±0.02d 0.50±0.01de 0.70±0.01d F值 112.663 174.600 31.258 458.253 110.621 P 值 <0.001 <0.001 <0.001 <0.001 <0.001
2.3 六组小鼠白色及棕色脂肪细胞形态比较
2.3.1 六组小鼠白色脂肪细胞形态比较 WT组白色脂肪细胞形态饱满、大小均匀;与WT组相比,Mstn(-/-)组白色脂肪细胞数量明显增多,体积明显缩小,形态不规则;Mstn(+/-)组表现介于WT组与Mstn(-/-)组之间。WT+DM组白色脂肪细胞体积较WT组明显增大,大小不均匀、细胞间有融合;与WT+DM组相比,Mstn(-/-)+DM组白色脂肪细胞数量明显增多,体积明显缩小;Mstn(+/-)+DM组表现介于WT+DM组与Mstn(-/-)+DM组之间,见图1。
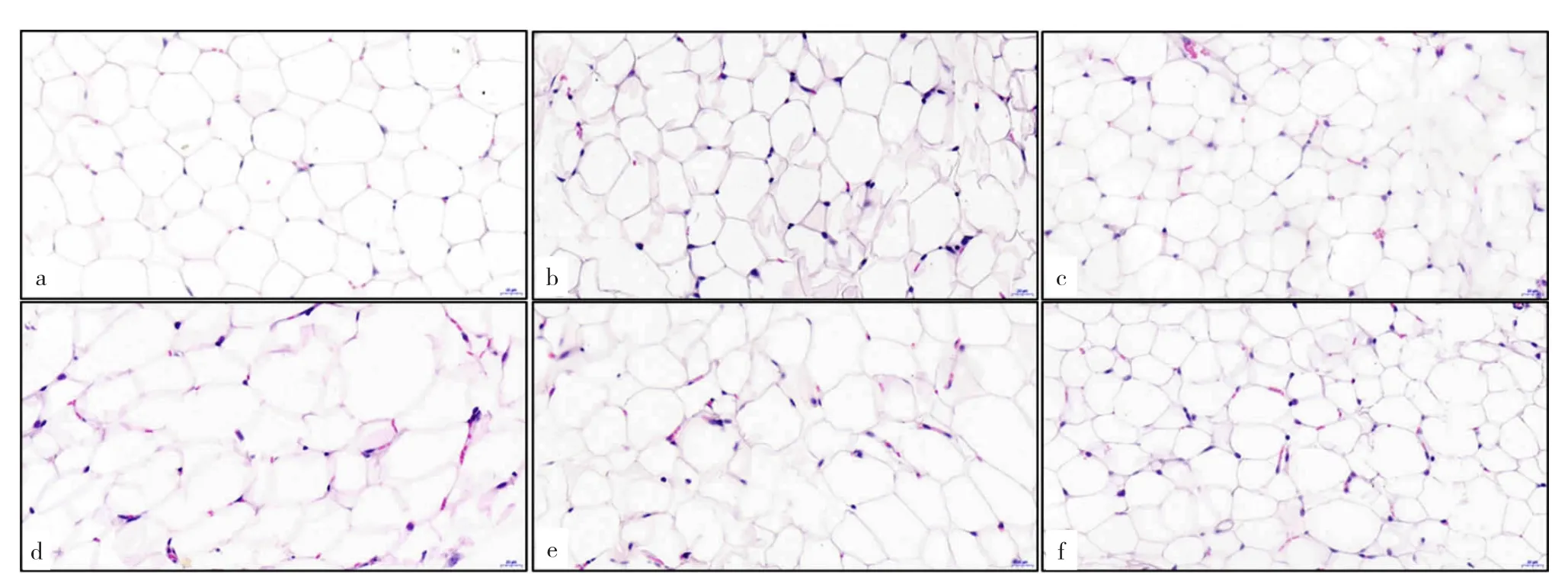
图1 六组小鼠白色脂肪细胞形态比较(HE染色,×400)Figure 1 Comparison of the morphology of white adipocytes in six groups of mice
2.3.2 六组小鼠棕色脂肪细胞形态比较 WT组、Mstn(+/-)组、Mstn(-/-)组棕色脂肪细胞形态均呈多房样,未见单泡脂肪细胞;Mstn(-/-)组较WT组、Mstn(+/-)组棕色脂肪细胞分布更密集。WT+DM组可见多房样棕色脂肪细胞中有大量单泡脂肪细胞分布,细胞中央有一圆形脂滴;Mstn(-/-)+DM组可见多房样棕色脂肪细胞中散在分布单泡脂肪细胞,与WT+DM组相比数量明显减少,脂滴体积明显减小;Mstn(+/-)+DM组表现介于WT+DM组与Mstn(-/-)+DM组之间,见图2。
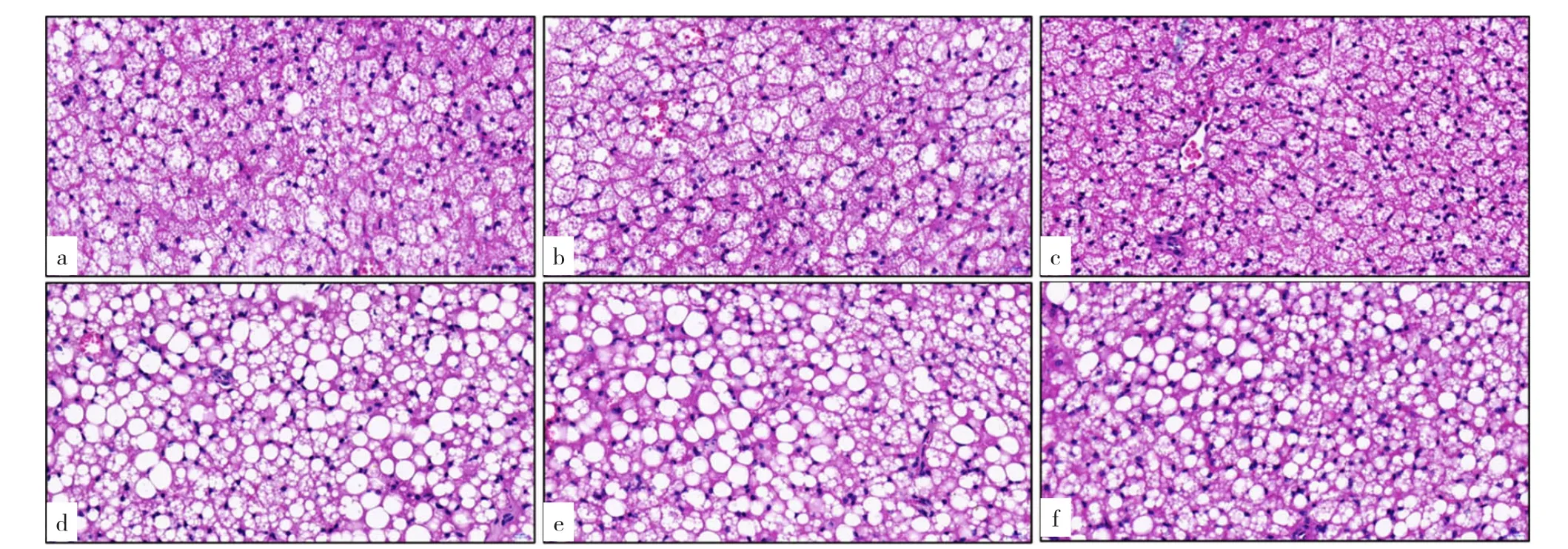
图2 六组小鼠棕色脂肪细胞形态比较(HE染色,×400)Figure 2 Comparison of the morphology of brown adipocytes in six groups of mice
2.4 六组小鼠白色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量比较 六组小鼠白色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量比较,差异均有统计学意义(P<0.05)。其中Mstn(+/-)组UCP1、CD137蛋白相对表达量高于WT组,差异有统计学意义(P<0.05);Mstn(-/-)组PPAR-γ、PGC-1α、CD137蛋白相对表达量均高于WT组、Mstn(+/-)组,UCP1高于WT组,差异有统计学意义(P<0.05);WT+DM 组 PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量均低于WT组,差异有统计学意义(P<0.05);Mstn(+/-)+DM组CD137蛋白相对表达量高于WT+DM组,差异有统计学意义(P<0.05);Mstn(-/-)组 PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量均高于WT+DM组、Mstn(+/-)+DM组,差异有统计学意义(P<0.05),见表3、图3。

图3 六组小鼠白色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白表达情况Figure 3 Expression levels of PPARγ,PGC-1α,UCP1 and CD137 proteins in white fat of six groups of mice
表3 六组小鼠白色脂肪PPARγ、PGC-1α、UCP1、CD137蛋白相对表达量比较(±s)Table 3 Comparison of relative expression levels of PPARγ,PGC-1α,UCP1 and CD137 protein in white fat of six groups of mice
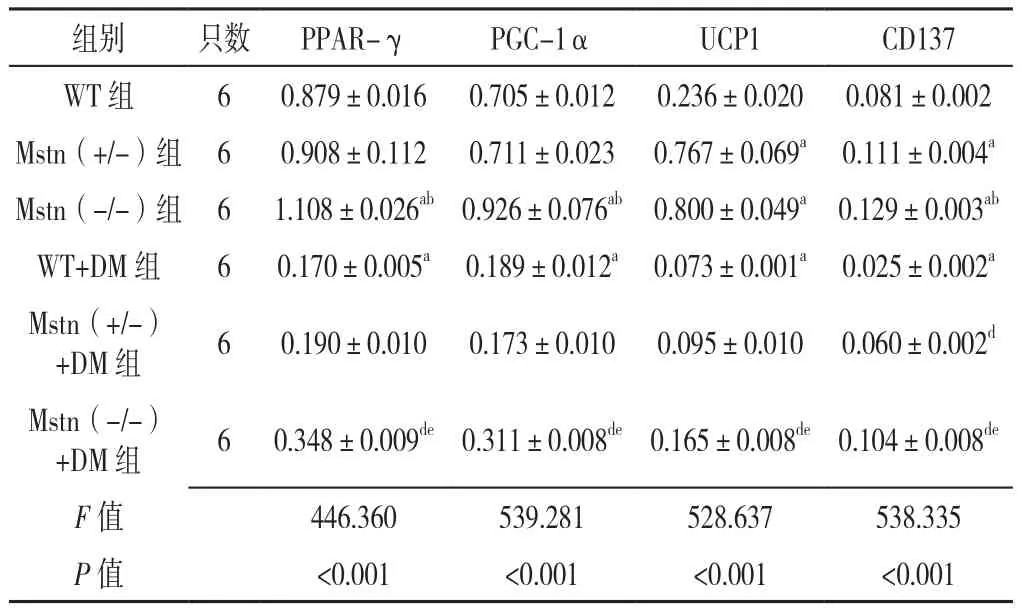
表3 六组小鼠白色脂肪PPARγ、PGC-1α、UCP1、CD137蛋白相对表达量比较(±s)Table 3 Comparison of relative expression levels of PPARγ,PGC-1α,UCP1 and CD137 protein in white fat of six groups of mice
注:PPAR-γ=过氧化物酶体增殖物激活受体γ,PGC-1α=过氧化物酶体增殖物激活受体γ辅激活因子1α,UCP1=解偶联蛋白1,CD137=分化簇 137;a表示与 WT组相比 P<0.05,b表示与 Mstn(+/-)组相比 P<0.05,c表示与 Mstn(-/-)组相比 P<0.05,d表示与WT+DM组相比P<0.05,e表示与Mstn(+/-)+DM组相比P<0.05
组别 只数 PPAR-γ PGC-1α UCP1 CD137 WT 组 6 0.879±0.016 0.705±0.012 0.236±0.020 0.081±0.002 Mstn(+/-)组 6 0.908±0.112 0.711±0.023 0.767±0.069a 0.111±0.004a Mstn(-/-)组 6 1.108±0.026ab 0.926±0.076ab 0.800±0.049a 0.129±0.003ab WT+DM 组 6 0.170±0.005a 0.189±0.012a 0.073±0.001a 0.025±0.002a Mstn(+/-)+DM 组 6 0.190±0.010 0.173±0.010 0.095±0.010 0.060±0.002d Mstn(-/-)+DM 组 6 0.348±0.009de0.311±0.008de0.165±0.008de0.104±0.008de F值 446.360 539.281 528.637 538.335 P 值 <0.001 <0.001 <0.001 <0.001
2.5 六组小鼠棕色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量比较 六组小鼠棕色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量比较,差异均有统计学意义(P<0.05)。其中Mstn(+/-)组PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量均高于WT组,差异有统计学意义(P<0.05);Mstn(-/-)组PPAR-γ、PGC-1α、CD137蛋白相对表达量均高于WT组、Mstn(+/-)组,UCP1高于WT组,差异有统计学意义(P<0.05);WT+DM组PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量均低于WT组(P<0.05),差异有统计学意义;Mstn(+/-)+DM组PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量均高于WT+DM组,差异有统计学意义(P<0.05);Mstn(-/-)+DM组PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量均高于WT+DM组、Mstn(+/-)+DM组,差异有统计学意义(P<0.05),见表4、图4。

图4 六组小鼠棕色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白表达情况Figure 4 Expression levels of PPAR-γ,PGC-1α,UCP1 and CD137 proteins in brown fat of six groups of mice
表4 六组小鼠棕色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量比较(±s)Table 4 Comparison of relative expression levels of PPAR-γ,PGC-1α,UCP1 and CD137 protein in brown fat of six groups of mice

表4 六组小鼠棕色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量比较(±s)Table 4 Comparison of relative expression levels of PPAR-γ,PGC-1α,UCP1 and CD137 protein in brown fat of six groups of mice
注:a表示与WT组相比 P<0.05,b表示与 Mstn(+/-)组相比P<0.05,c表示与 Mstn(-/-)组相比 P<0.05,d表示与 WT+DM 组相比P<0.05,e表示与Mstn(+/-)+DM组相比P<0.05
组别 只数 PPAR-γ PGC-1α UCP1 CD137 WT 组 6 1.359±0.060 0.929±0.008 0.658±0.038 0.079±0.002 Mstn(+/-)组 6 1.920±0.050a 1.111±0.050a 0.809±0.017a 0.152±0.009a Mstn(-/-)组 6 2.052±0.040ab1.556±0.059ab 0.830±0.030a 0.273±0.016ab WT+DM 组 6 0.301±0.014a 0.187±0.011a 0.092±0.007a 0.062±0.003a Mstn(+/-)+DM 组 6 0.455±0.027d 0.251±0.020d 0.129±0.006d 0.130±0.006d Mstn(-/-)+DM 组 6 1.218±0.085de0.645±0.014de0.288±0.010de0.168±0.004de F 值 1 196.913 1 463.654 1 493.055 490.418 P 值 <0.001 <0.001 <0.001 <0.001
3 讨论
越来越多的研究发现Mstn在脂肪生长、分化、代谢中发挥重要作用,参与肥胖的发生。有研究结果显示,Mstn(-/-)小鼠与WT小鼠相比脂肪含量明显减少,血清TG、FFA水平明显降低[4-5]。Mstn(-/-)梅山猪皮下脂肪含量与体质量的比例、血清TG水平明显低于WT[6]。本研究结果显示,Mstn(-/-)组Lee's指数、血清TG、TC水平低于WT组;WT+DM组Lee's指数、HDL-C水平低于WT组,脂肪指数和血清TG、TC、LDL-C、FFA水平高于WT组;Mstn(-/-)+DM组Lee's指数、脂肪指数和血清TG、TC、LDL-C、FFA水平低于WT+DM组,HDL-C水平高于WT+DM组。Lee's指数反映小鼠肥胖程度,脂肪指数反映小鼠体内脂肪量,而血清TG、TC、LDL-C、FFA水平升高,HDL-C水平降低是机体脂代谢紊乱的特征性生化改变,上述结果提示敲除Mstn基因后可明显拮抗T2DM引起的脂肪堆积、脂代谢紊乱等肥胖表征。Mstn(-/-)小鼠脂肪量减少可能与Mstn抑制前体脂肪细胞向成熟脂肪细胞分化有关。在脂肪组织形成初期,前体脂肪细胞由于解除了Mstn的抑制,分化能力增强,提前发育成熟,从而无法继续分裂增殖,成熟脂肪细胞数量减少,导致脂肪总量减少[3]。
脂肪主要分为白色脂肪、棕色脂肪和米色脂肪。白色脂肪组织主要分布于皮下和肠系膜、生殖腺等内脏周围,白色脂肪细胞包含单个较大脂滴,含有大量TG,主要作用为储存机体多余的能量,是导致肥胖的主要因素;棕色脂肪组织主要分布在肩胛,棕色脂肪细胞包含多房小脂滴,胞内含有大量线粒体,以非偶联氧化磷酸化的方式消耗白色脂肪储存的TG,产生热量,调节体温平衡;米色脂肪主要分布在白色脂肪组织间,属于白色脂肪向棕色脂肪转化的中间形态,可于寒冷等外界刺激后被激活,发挥类似棕色脂肪的产热功能,即发生了白色脂肪棕色化[7]。棕色和米色脂肪均可改善机体脂肪代谢、减轻肥胖,其细胞内均存在高表达的标志性基因。研究证实,PPAR-γ、PGC-1α、UCP1、PR结构域蛋白16(PRDM16)、诱导细胞死亡DNA片段化因子α样效应因子A(Cidea)在棕色脂肪细胞中高表达,CD137、跨膜蛋白26(Tmem26)在米色脂肪细胞中高表达,以上基因均是白色脂肪棕色化的标志物[8-10]。PPAR-γ是一种核激素受体,是体内脂肪形成必需的转录因子,在调控脂肪细胞分化中发挥重要作用[11]。PGC-1α受上游信号分子PPAR-γ调控,调节线粒体电子传递链以及氧化呼吸功能,进一步调节棕色脂肪组织的产热作用[12]。UCP1是一种线粒体内膜蛋白,可以消除线粒体内膜两侧由质子浓度差形成的电势差,阻碍线粒体呼吸链的传递,抑制三磷酸腺苷的产生,将储存的能量转化为热量,维持体温平衡[13]。CD137是肿瘤坏死因子受体家族成员之一,是米色脂肪区别于其他脂肪细胞的特异性标志物[14]。通过检测上述基因表达,可反映白色脂肪棕色化的程度。
Mstn可调控白色脂肪棕色化。研究发现,Mstn(-/-)小鼠白色脂肪出现棕色脂肪的表型,能量利用增加,可抵抗遗传性或饮食诱导的肥胖,且皮下白色脂肪组织PGC-1α、UCP1、CD137及Tmem26基因表达均升高[4]。Mstn(-/-)梅山猪背部皮下白色脂肪组织中单室大脂滴细胞数量减少,多房小脂滴细胞数量增加,脂肪 组 织 PGC-1α、PRDM16、Cidea、CD137、Tmem26基因表达均上调,提示白色脂肪棕色化趋势明显增强[6]。本研究结果显示,Mstn(-/-)组白棕比低于WT组,WT+DM组白棕比高于WT组,Mstn(-/-)+DM组白棕比低于WT+DM组;HE染色观察到Mstn(-/-)组较WT组白色脂肪细胞体积明显缩小,数量明显增多,从形态上有向棕色脂肪细胞转化的趋势,WT+DM组白色脂肪细胞体积较WT组明显增大,棕色脂肪细胞间分布大量圆形单房脂滴,而Mstn(-/-)+DM组上述病理改变较轻,表明抑制Mstn表达可抑制T2DM引起的脂肪细胞体积增大,诱导白色脂肪出现棕色脂肪细胞表征。本研究进一步检测了棕色脂肪标记基因PPAR-γ、PGC-1α、UCP1,米色脂肪标记基因CD137在脂肪组织中的表达,结果显示,Mstn(-/-)组白色脂肪及棕色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量均高于WT组,WT+DM组均低于WT组,Mstn(-/-)+DM组高于WT+DM组,结合白色及棕色脂肪组织HE染色,提示T2DM可诱导棕色脂肪及米色脂肪标志性基因表达减少,白色脂肪表型增加,能量储存过剩,而敲除Mstn基因后可明显拮抗此现象,上调棕色脂肪及米色脂肪标志性基因表达,促进白色脂肪棕色化,增加机体产热,促进白色脂肪消耗,减轻肥胖。分析其具体机制,可能与Mstn缺失通过下调miR-34a促进Ⅲ型纤连蛋白结构域包含蛋白5(FNDC5)/鸢尾素(irisin)表达有关[15]。FNDC5是irisin的前体蛋白,主要由骨骼肌分泌,可通过血液循环进入脂肪组织中,促进白色脂肪棕色化,消耗白色脂肪,减少脂肪沉积[6]。也有研究发现,Mstn可调控Smad3介导的β-连环蛋白表达抑制棕色脂肪细胞分化[16]。
本研究结果显示,Mstn(+/-)+DM组白棕比、脂肪指数、血清TG、TC及FFA水平低于WT+DM组,白色脂肪CD137及棕色脂肪PPAR-γ、PGC-1α、UCP1、CD137蛋白相对表达量高于WT+DM组,HE染色显示Mstn(+/-)+DM组白色及棕色脂肪细胞形态介于WT+DM组与Mstn(-/-)+DM组之间,表明部分抑制Mstn表达可在一定程度上拮抗T2DM引起的白色脂肪增多、米色/棕色脂肪减少及脂代谢紊乱的表现。
本研究结果提示,抑制Mstn基因表达可拮抗T2DM引起的白色脂肪堆积、脂代谢紊乱等肥胖表型,上调PPAR-γ、PGC-1α、UCP1、CD137基因表达,促进白色脂肪棕色化,为T2DM、肥胖、肌少症等代谢性疾病的防治提供理论依据。本研究不足之处在于样本量较小,也未进行下游分子机制研究,因此结论有一定局限性,Mstn参与白色脂肪棕色化的具体机制需进一步研究证实。
作者贡献:程经纬负责实验设计与实施,数据收集与统计学分析,论文的构思、设计、撰写;柳杨青负责实验设计与实施,论文修订;汪艳芳负责研究选题,实验的监督管理,论文的质量控制及审校,对论文整体负责。
本文无利益冲突。

