尼莫地平联合辛伐他汀对蛛网膜下隙出血后脑血管痉挛病人微炎症状态及氧化应激水平的影响
解 靖,张 璐,甘 宁,刘思思,田 楠,张 宇,苏 飞,贾同乐
蛛网膜下隙出血(subarachnoid hemorrhage,SAH)是一种急性脑血管疾病,多由颅内动脉瘤破裂等原因所致。脑血管痉挛(cerebral vasospasm,CVS)是SAH的一种严重并发症,多于发病后1~2周内出现,其发生率为50%~70%,如病人未获得及时治疗,极易导致其并发缺血性脑功能障碍,从而增加病人致残、致死风险[1]。SAH后发生CVS的病因尚不明确,但有研究认为炎症反应、氧化应激参与CVS的发生、进展过程[2]。目前,治疗SAH后CVS的常用药物有尼莫地平、辛伐他汀等。尼莫地平为钙离子拮抗剂,易透过血脑脊液屏障对脑血管发挥作用[3]。辛伐他汀为一种羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂,具有抑制血小板聚集、抗炎、稳定斑块等作用,对脑血管疾病有一定治疗效果[4]。鉴于单药治疗SAH后CVS的疗效有限,本研究采用尼莫地平、辛伐他汀联合治疗SAH后CVS,观察其临床疗效及治疗前后炎性因子、氧化应激指标变化情况,以期为更有效地治疗SAH后CVS提供参考依据。
1 资料与方法
1.1 临床资料 选取2017年8月—2020年9月我院收治的94例SAH后发生CVS的病人。纳入标准:①通过动脉血管造影、CT检查证实为SAH;②首次发病,且发病距入院治疗时间不超过72 h;③SAH后3~8d出现头痛、呕吐、意识障碍等症状,且经颅多普勒超声提示为CVS。排除标准:①合并其他脑神经疾病;②合并肝肾功能严重病变、恶性肿瘤等其他重大疾病;③Hunt-Hess分级Ⅴ级。将所有病人按入院顺序编号,采用随机数字表法按1∶1比例分为对照组与研究组,每组47例。对照组,男26例,女21例;年龄46~79(62.31±6.48)岁;Hunt-Hess分级:Ⅰ级7例,Ⅱ级24例,Ⅲ级11例,Ⅳ级5例;发病至入院时间(8.15±2.36)h。研究组,男25例,女22例;年龄47~78(62.06±6.15)岁;Hunt-Hess分级:Ⅰ级9例,Ⅱ级21例,Ⅲ级10例,Ⅳ级7例;发病至入院时间(8.39±2.52)h。两组性别、年龄、Hunt-Hess分级、发病至入院时间比较,差异均无统计学意义(P>0.05),具有可比性。病人家属对本研究知情同意。本研究经医院伦理委员会批准。
1.2 方法 所有病人入院后均进行降颅压、镇静、止吐、调节血压、抗感染等常规治疗。在此基础上,对照组采用尼莫地平治疗,尼莫地平注射液[生产厂家:Bayer Vital GmbH,生产批号:20180213,规格:50 mL(10 mg)],初始剂量0.5 mg/h,2 h内血压未降低可增至1 mg/h,微量泵静脉泵入,维持24 h;连续用药2周后改为口服尼莫地平片(生产厂家:哈药集团三精明水药业有限公司,生产批号:20160420,规格:每片30 mg),每次60 mg,每日3次,无法口服者鼻饲给药。研究组在对照组基础上联合辛伐他汀(生产厂家:福安药业集团烟台只楚药业有限公司,批号:20180404,规格:每片5 mg)治疗,口服或鼻饲给药,每次20 mg,每日1次。两组均以2周为1个疗程,均连用2个疗程。
1.3 观察指标
1.3.1 神经功能及大脑中动脉(MCA)血流速度 于治疗前、治疗4周后,采用临床神经功能缺损程度评分量表(Clinic Neurological Function Deficit Scale,NDS)[5]评定神经功能。NDS总分为45分,分值越高,病人神经功能缺损程度越严重。通过彩超测定MCA平均血流速度。
1.3.2 炎性因子 于治疗前、治疗4周后,采集两组晨起空腹静脉血6 mL,3 000 r/min离心10 min,分离获得血清后,于-70 ℃环境中冷藏待测。采用酶联免疫吸附法检测白细胞介素-6(interleukin 6,IL-6)、C-反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎性因子水平。
1.3.3 氧化应激指标 于治疗前、治疗4周后,取两组病人脑脊液,采用比色法检测超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)等氧化应激指标水平。
1.4 临床疗效评定 治疗4周后评定两组临床疗效。显效:临床症状均消失,生活自理能力恢复如常;有效:症状有明显减轻或完全消失,但有后遗症遗留,生活自理能力部分恢复;无效:症状未见减轻,甚至病情恶化或死亡。
2 结 果
2.1 两组临床疗效比较 研究组治疗总有效率明显高于对照组(89.36%与70.21%,P<0.05)。详见表1。
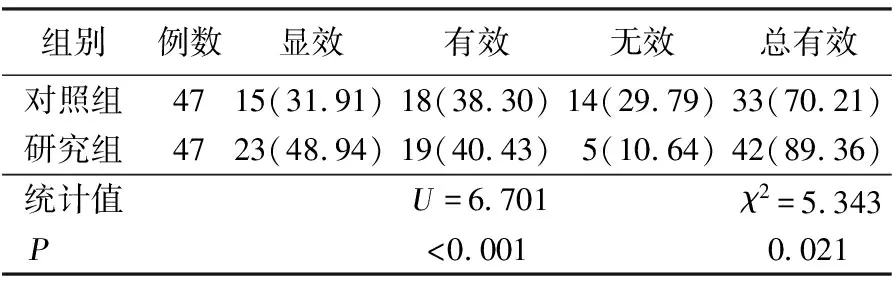
表1 两组临床疗效比较 单位:例(%)
2.2 两组NDS评分、MCA血流速度比较 治疗前,两组NDS评分、MCA血流速度比较,差异均无统计学意义(P>0.05);治疗后,两组NDS评分、MCA血流速度均较治疗前明显降低(P<0.05),且研究组较对照组降低明显(P<0.05)。详见表2。

表2 两组治疗前后NDS评分、MCA血流速度比较 (±s)
2.3 两组血清炎性因子水平比较 治疗前,两组血清IL-6、CRP、TNF-α水平比较,差异均无统计学意义(P>0.05);治疗后,两组血清IL-6、CRP、TNF-α水平均较治疗前明显降低(P<0.05),且研究组较对照组降低更明显(P<0.05)。详见表3。

表3 两组治疗前后血清炎性因子水平比较(±s)
2.4 两组治疗前后脑脊液中氧化应激指标水平比较 治疗前,两组脑脊液中SOD、MDA水平比较,差异均无统计学意义(P>0.05);治疗后,两组脑脊液中SOD水平均较治疗前明显升高(P<0.05),脑脊液中MDA水平均较治疗前明显降低(P<0.05),且研究组脑脊液中SOD水平明显高于对照组(P<0.05),脑脊液中MDA水平明显低于对照组(P<0.05)。详见表4。

表4 两组治疗前后脑脊液中氧化应激指标水平比较(±s)
3 讨 论
CVS是指脑供血动脉的斑块致血管腔变窄并出现血液涡流,当涡流加快时,可对动脉血管壁产生影响,促使其持续收缩而出现暂时性脑缺血发作。当旋涡速度减慢时症状减退。CVS可通过彩超、脑血管造影等检查明确诊断,其作为SAH高危并发症,可对病人神经功能造成较大损伤,严重时可致残、致死。目前,对于SAH后发生CVS的具体机制尚未确切了解,但有关研究认为,炎性反应在其发展中发挥着重要作用[6]。有研究表明,SAH病人血液中核转录因子-κB(NF-κB)表达水平升高,NF-κB介导产生的IL-6、TNF-α等炎性因子可诱导CVS发生、进展[7]。动物实验结果显示,炎性反应可损伤CVS病人神经功能,且损伤程度和炎性反应程度有明显关系[8]。另有研究表明,自由基引起的脂类过氧化、蛋白质氧化降解等除可损伤神经细胞外,还可激活级联反应而导致血脑屏障受损。而通过抑制氧化应激即提高SOD表达水平、降低MDA表达水平可减少细胞凋亡,保护血脑屏障,使CVS所致的大脑损伤减轻[9-10]。
尼莫地平为目前临床治疗CVS的常用药,其属于二氢吡啶类钙离子拮抗药,可选择性作用于钙通道,影响细胞外Ca2+的转运,进而有利于扩张颅内血管,改善脑血管微循环。同时此药可和中枢神经特异受体产生作用,能够减轻脂质氧化,减少活性自由基的生成,从而保护神经功能[11-12]。研究证实,尼莫地平可明显减轻SAH后CVS病人神经功能损伤,有效降低并发症发生率[13]。沈杰等[14]研究发现,单用尼莫地平治疗SAH后CVS的总有效率为73.68%,仍有26.32%的病人未能从中受益。本研究中,对照组治疗总有效率为70.21%,提示单纯采用尼莫地平的疗效有限,建议联合其他药物进行治疗,以增加临床疗效。辛伐他汀亦为治疗CVS的常用药,本研究将其与尼莫地平联合应用于CVS治疗中,结果显示,研究组治疗总有效率为89.36%,明显高于对照组的70.21%;研究组治疗后NDS评分、MCA血流速度及血清IL-6、CRP、TNF-α水平均明显低于同组治疗前及对照组。提示尼莫地平联合辛伐他汀治疗SAH后CVS可有效提高临床疗效,缓解炎症反应,改善神经功能。分析其原因可能为辛伐他汀作为一种HMG-CoA还原酶抑制剂,可上调内皮细胞一氧化氮合成酶水平,调节血管平滑肌细胞凋亡,改善脑血流量,下调炎性因子表达,减轻血管周围炎症反应,降低组织损伤,使血管保持正常功能[15-16]。本研究还发现,治疗后研究组脑脊液中SOD水平明显高于同组治疗前及对照组,脑脊液中MDA水平明显低于同组治疗前及对照组。提示此联合用药方案还可通过减轻氧化应激反应降低病人脑损伤程度。
综上所述,尼莫地平联合辛伐他汀治疗SAH后CVS疗效较好,可明显减轻病人微炎症状态及氧化应激反应,改善临床症状及神经功能。

