子痫前期患者血清和胎盘组织中CXC型趋化因子配体12和人类软骨糖蛋白-39的表达及意义
刘雅雯, 赵 群, 郑皓文, 孔 祥, 宋晶哲
(1. 扬州大学临床医学院 妇产科, 江苏 扬州, 225001; 2. 江苏省兴化市人民医院 妇产科, 江苏 兴化, 225700;3. 江苏省连云港市第一人民医院 妇产科, 江苏 连云港, 222000)
子痫前期(PE)属于妊娠期高血压疾病,是妊娠期特有的一种并发症,发生率为2%~5%[1-2]。PE可导致孕产妇发生子痫、肝肾功能衰竭甚至死亡,同时可引发早产和胎儿生长受限等问题[3]。PE的发病机制十分复杂,研究[4]表明,妊娠时PE患者的血管内皮受损和全身炎症、免疫反应可能与发病机制密切相关。BURTONG J等[5]研究发现,CXC型趋化因子配体12(CXCL12)具有多种功能,包括趋化、血管生成、血管转移、干细胞归巢和器官发生等,与血管内皮变化关系密切。人类软骨糖蛋白-39(YKL-40)参与了细胞的增殖与活化、血管生成、细胞凋亡以及炎症应答等过程[6]。本研究采用酶联免疫吸附试验(ELISA)和免疫组化法(IHC)检测正常晚期妊娠孕妇和PE患者血清和胎盘组织中CXCL12和YKL-40的表达,探讨CXCL12、YKL-40与PE发病机制的关系,现报告如下。
1 资料与方法
1.1 一般资料
选取2018年8月—2021年7月在江苏省扬州大学临床医学院产科住院分娩的100例孕妇,其中50例正常妊娠孕妇设为对照组, 50例PE孕妇设为PE组, PE诊断标准依据《妇产科学(第9版)》[7]。2组孕妇的孕周、孕产次、年龄、体质量指数比较,差异无统计学意义(P>0.05), 2组孕妇均未临产,均无产科其他合并症,分娩方式均为剖宫产。排除有感染、免疫性疾病、原发性高血压、肾脏疾病的患者; 排除有吸烟、酗酒等不良生活习惯的患者; 排除有输血、手术及外伤史的患者。
1.2 方法
收集孕妇空腹静脉血, 3 000转/min分离血清。采用ELISA测定孕妇血中CXCL12和YKL-40浓度,试剂购自美国Life Science公司,按照试剂盒说明书操作。采用IHC两步法对2组孕妇胎盘组织中CXCL12、YKL-40的蛋白表达情况进行检测(具体步骤参照所购试剂盒操作说明书)。CXC12L、YKL-40一抗的工作浓度均为1∶200, 设置空白对照[采用磷酸盐缓冲液(PBS)代替一抗]。
1.3 结果判定
1.3.1 ELISA结果判定: 获得各标准品及样本光密度值(OD值),再减去空白孔的OD值,而后作图。选取标准品的浓度作为纵坐标,选取OD值为横坐标,绘制标准曲线; 根据样品的OD值,依据标准曲线查出相应的浓度,乘以稀释倍数即为样品的实际浓度。
1.3.2 IHC结果判定: 采用染色积分评价标准,对CXCL12、YKL-40蛋白的表达水平进行检测,在每张切片中随机选取10个视野,在显微镜高倍镜下观察(放大倍数400倍),结果出现细胞核或细胞浆内棕黄色颗粒即为阳性染色。根据每张切片上染色强度及阳性细胞百分率综合分析: 0~1分为(-); 2~3分为(+); 4~5分为(); 5~6分为()。
1.4 统计学方法
2 结 果
2.1 2组孕妇一般资料比较
2组孕妇的年龄、孕周、体质量指数比较,差异无统计学意义(P>0.05); PE组收缩压、舒张压、24 h尿蛋白定量高于对照组,新生儿出生体质量低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 2组孕妇一般资料比较
2.2 2组血清CXCL12、YKL-40水平比较
PE组患者血清CXCL12、YKL-40水平高于对照组,差异均有统计学意义(P<0.05), 见表2。

表2 2组血清CXCL12表达比较 ng/mL
2.3 2组胎盘组织中CXCL12、YKL-40蛋白表达比较
IHC发现, CXCL12蛋白主要表达于胎盘合体滋养层细胞, PE组胎盘组织中CXCL12的表达强度高于对照组,差异有统计学意义(χ2=5.367,P<0.05)。见表3。YKL-40蛋白在妊娠阶段主要表达于胎盘合体滋养层细胞,胞核及间质细胞的胞浆也有少量表达, PE组胎盘组织中YKL-40的表达强度高于对照组,差异有统计学意义(χ2=6.472,P<0.05)。见表4。

表3 2组胎盘组织中CXCL12蛋白表达水平比较
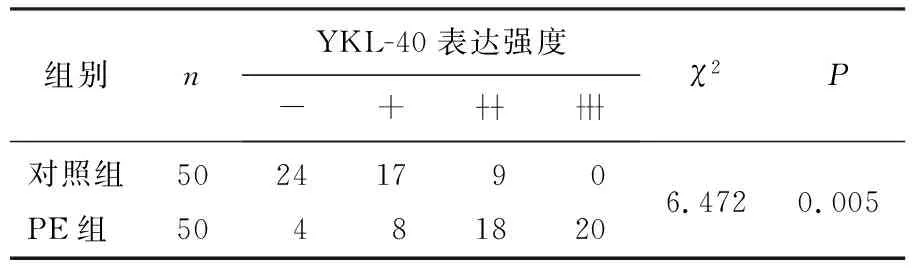
表4 2组胎盘组织中YKL-40蛋白表达水平比较
3 讨 论
PE是妊娠期特有并发症,症状主要为高血压、蛋白尿,严重者可引起子痫,导致多器官功能衰竭,是导致围产期母婴死亡的主要原因。近年来,国外学者[3-5, 7]提出了PE病因学的两步学说: 第一步发生在妊娠早期,发育不良的滋养层细胞导致了胎盘形成不良,引发胎盘缺血缺氧; 第二步是胎盘缺氧进一步加重,包括炎症因子等许多因子释放到母体循环中,导致了母体免疫-炎症系统失衡和内皮细胞功能紊乱,进而引发PE临床症状。PE的两步学说认为PE的发生机制可能与胎盘血管病变导致缺氧和母体免疫-炎症系统失衡有关,正常孕妇体内同样存在轻微炎症应答,但PE孕妇免疫-炎症系统失衡促使炎症应答被放大,导致PE发生。目前研究[1-5]发现, PE孕妇较正常妊娠孕妇的趋化因子和炎性因子水平显著升高,提示在PE的发生机制中,血管内皮受损和免疫-炎症系统失衡可能发挥了作用。
趋化因子包括稳态CXCL12和炎症趋化因子CXCL9、CXCL10等[8-10]。CXCL12的功能主要是控制细胞定向移动,在介导炎症反应、参与多种功能活动如造血干细胞迁移及归巢、恶性血液系统肿瘤的转移和侵润等方面都起着重要的作用[8-10]。CXCL12与CXCR4是一对独特的趋化因子受体-配体,其相互作用不仅影响免疫细胞的活化、迁移、募集等,还参与肿瘤侵袭及转移过程[9]。此外,在血管生成与血管再生方面, CXCL12也发挥了关键作用[10]。目前普遍认为绒毛外滋养细胞在建立子宫胎盘血液循环过程中,通过侵蚀子宫螺旋小动脉产生滋养细胞浅着床是妊娠期高血压发病的关键环节。研究[11-12]发现, CXCL12在PE患者胎盘中表达呈阳性,且随着病情严重程度的增加,其表达也逐步增强。研究[12]发现, CXCL12在胎盘组织中的表达可能主要在妊娠早期发挥作用。CXCL12及其受体广泛存在于胎盘组织和细胞中, CXCL12通过多个过程干扰母胎界面,如胎盘侵袭和胎盘血管生成,影响胎盘和胎儿形成。研究[13-14]表明, IHC显示PE胎盘组织中CXCL12上调可能是代偿机制的结果。氧气对妊娠至关重要,CXCL12的表达通常与缺氧环境有关,缺氧会刺激滋养层细胞而增强CXCL12的表达[15]。
目前已有研究单独对趋化因子CXCL10、CXCL12在PE的表达进行了分析,但研究结果[10, 12, 16-17]并不一致。由于PE病因和发病机制十分复杂,可能是多种因素在PE早期和中晚期同时共同作用的结果,且在PE早期和中晚期的作用机制也可能不一致。既往研究[16-17]发现稳态CXCL12和炎症趋化因子CXCL9、CXCL10、CXCL12在PE的表达结果有所不同, CXCL12可能只在PE早期有变化。但近期研究[18-19]在PE早期发现趋化因子CXCL12与慢性炎症和免疫激活有关, CXCL12趋化因子参与PE早期的发病机制,并在PE发生的异常新生血管形成、胚胎发育和炎症反应中发挥重要作用。PE患者早期趋化因子的变化可能是一种代偿现象,当促炎趋化因子水平升高后,特别是在妊娠期中晚期,全身炎症因子水平升高,导致CXCL12失去稳定状态,与炎症趋化因子CXCL9、CXCL10等共同参与炎症免疫反应,加重了PE器官病变[18-19]。本研究发现, PE患者CXCL12水平升高,提示机体出现趋化因子和促炎免疫细胞、细胞因子增加,如胎盘急性炎症病变的细胞因子白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)及YKL-40等水平升高,进一步会导致母体系统内皮功能障碍,促进PE病情发展[20], 这与PE病因学的两步学说一致。
在哺乳动物中, YKL-40主要由多种炎性相关细胞合成和分泌,如巨噬细胞、肝星状细胞、血管平滑肌细胞、中性粒细胞和软骨细胞。因此,这种蛋白质被称为相关的急性和慢性炎症进展的生物标志物[21-22]。YKL-40在先天免疫系统激活和细胞外基质重塑中发挥重要作用, YKL-40通过各种免疫细胞如中性粒细胞、巨噬细胞、内皮细胞等参与免疫和炎症反应; YKL-40还是一种有效的血管生成因子,特别是在动脉粥样硬化斑块的形成中发挥作用,许多促炎细胞因子如IL-6、TNF、IL-13和IL-18可以上调YKL-40表达,促进血管生成和各种炎症反应。DENG Y J等[22]发现YKL-40可能参与了胎盘的生成和发育以及人类胚胎干细胞的分化,但YKL-40在胎盘中的确切作用以及如何参与转化为母体血浆中的YKL-40尚未明确。本研究发现,在正常妊娠孕妇和PE患者的血清和胎盘组织中YKL-40均有表达,但是PE患者YKL-40的表达水平显著高于正常对照组,推测PE的发生发展与YKL-40的表达有关系,这可能与YKL-40参与血管生成和炎症反应有关。研究[23-24]报道,炎症细胞因子TNF-α、IL-1β可以通过核因子κB(NF-κB)信号突进诱导YKL-40在软骨细胞的表达和持续性分泌,在YKL-40的启动子区域亦含有NF-κB的结合位点, YKL-40的表达可能受NF-κB的调控。最新的对PE病因学的研究[25]更倾向于母体炎症系统激活的说法,炎症与PE的关系甚为密切,易感机体在内在因素和外在因素共同作用之下,激活了NF-κB, 并与YKL-40启动子上的NF-κB结合位点结合,导致YKL-40表达增加,从而引起体内炎症因子的释放,从而导致PE患者母体和胎儿发生一些临床症状,但尚待进一步的研究[26]确认。
综上所述,本研究发现CXCL12、YKL-40在PE患者中高表达,但具体的调节机制尚未阐明,只是说明PE可能与血管内皮受损和炎症免疫相关,后续需要进一步监测PE患者不同时期的血清CXCL12和YKL-40水平变化,这对动态监测PE患者病情变化、及时治疗具有一定的意义。

