TSPAN88参与小鼠非酒精性脂肪性肝病的脂质代谢
非酒精性脂肪性肝病(NAFLD)是与脂代谢异常有关的世界范围内最常见的慢性肝病。据估计全球NAFLD患病率约为25%,近几十年来其患病率日益增长。NAFLD疾病谱广泛,从轻度脂肪变性(即肝细胞内的脂滴沉积)到以脂肪变性、炎症和肝细胞气球样变性为特征的非酒精性脂肪性肝炎(NASH)。单纯性肝脂肪变性是良性和可逆的;然而,NASH 是一种潜在的严重疾病,可进一步发展为肝硬化和肝细胞癌(HCC)。目前该病的发病机制还未完全阐明,多种理论的提出如:二次打击学说、多次打击学说、脂质异位沉积、肠道菌群失调等都只是冰山一角。尽管其发病机制复杂,但NAFLD/NASH 的一个不变特征是它总是在肝脂肪变性的背景下发展,即肝细胞中异常脂滴的积累。当各种细胞内和细胞外应激事件与脂肪变性相结合时,肝细胞会经历应激/损伤反应,最终导致细胞损伤和死亡,这是NAFLD 的关键特征。因此,探索脂质代谢的相关机制对于了解NAFLD的病理生理学至关重要。
四跨膜蛋白8(TSPAN8)是一种具有四次跨膜结构的小相对分子质量的膜蛋白,其通过与自身和其他各种细胞信号分子相互作用形成TSPAN8 介导的蛋白质复合物。这些蛋白质复合物有助于构建富含四跨膜蛋白的微域,可有效介导细胞内信号转导。生理条件下,TSPAN8 在调节生物功能方面起着至关重要的作用,包括白细胞运输、血管生成和伤口修复。以往的研究表明TSPAN8与2 型糖尿病(T2D)和肥胖相关。流行病学研究表明,NAFLD与包括T2D和肥胖在内的代谢紊乱高度相关。临床上,NAFLD 患者往往伴有肥胖、胰岛素抵抗和/或T2D,据报道,超过76%的T2D患者患有NAFLD。此外,超过90%的接受减肥手术的重度肥胖患者患有NAFLD。与NAFLD 相似,肥胖也以脂质代谢异常为特征。同时,我们前期通过蛋白组学的方法发现TSPAN8在人NAFLD肝脏组织的表达量明显低于正常肝脏组织。所以我们推测TSPAN8可能与NAFLD的发生发展有着千丝万缕的联系,然而目前尚无确切研究表明他们之间的直接关联。本研究旨在观察TSPAN8在NAFLD发生发展中的变化,探讨TSPAN8对NAFLD成脂作用的机制。
(1)分析表格中淀粉量的变化情况,推测磷酸化酶的具体功能包括_______________________。
1 材料和方法
1.1 实验材料
6~8 周龄健康C57BL/6J雄性小鼠(SPF 级)30只,体质量18.9±2.77 g,购于重庆医科大学动物实验中心(本研究符合重庆医科大学实验动物伦理委员会所制定的伦理学标准,动物伦理批准号为2021-514),实验环境为明暗周期12 h、恒温26 ℃、小鼠自由饮水与进食;人肝癌细胞株HepG2 细胞(广州赛库生物技术有限公司);高脂饲料(Research Diets),普通饲料由重庆医科大学实验动物中心提供;棕榈酸(PA)、油酸(OA)(Sigma-Aldrich);牛血清白蛋白BSA-Ⅴ(不含脂肪酸)、油红O染色试剂盒(北京索莱宝科技有限公司);甘油三酯(TG)测定试剂盒(迈瑞公司);胎牛血清、高糖DMEM培养基、Opti-MEM™I 减血清培养基(Gibco);TRIzol Reagent(Life Technologies);反转录试剂PrimeScript™RT reagent Kit with gDNA Eraser、TB Green Premix Ex Taq II(TaKaRa);SDS-PAGE凝胶快速配制试剂盒、PIPA裂解液、PMSF蛋白酶抑制剂、Western转模液、TBS漂洗缓冲液、超敏ECL化学发光试剂盒、BeyoColor彩色预染蛋白相对分子质量标准(上海碧云天生物技术有限公司);蛋白含量检测试剂盒(江苏凯基生物技术股份有限公司);β-actin抗体(艾比玛特生物医药有限公司);TSPAN8 抗体(Abcam)。TSPAN8 质粒、空载质粒、GFP质粒(载体均为pcDNA3.1)(上海吉玛制药技术有限公司);Lipofectamine 3000转染试剂盒(Invitrogen)。
1.2 方法
1.2.1 实验动物分组 将30只小鼠适应性喂养1周后,随机分为2组,普通饲料组(ND)和高脂饲料组(HFD)各15只。ND组使用普通饲料喂养,HFD组使用高脂饲料(60%脂肪、20%碳水化合物、20%蛋白质)喂养。分别在1、3、6月末,随机选出ND组与HFD组小鼠各5只,称量小鼠体质量,禁食禁饮12 h后处死,迅速摘除小鼠眼球,取血分离血清后,放于-80 ℃保存,后续检测血清TG含量。取出肝脏,称取肝脏湿重后迅速予以冰生理盐水进行漂洗,部分肝组织经10%福尔马林固定后石蜡包埋进行常规HE染色;其余部分液氮速冻保存备用。
1.2.2 细胞培养与分组 HepG2 细胞用含10%胎牛血清的高糖DMEM 培养液,培养于37 ℃、含5%CO的恒温培养箱中。当6孔板内的细胞密度达到40%~50%时,分成6组,分别给予不同处理。对照(CON)组:完全培养基,培养24 h;游离脂肪酸(FFA)组:终浓度为1 mmol/L FFA[FFA为OA和PA混合物(OA∶PA=2∶1)]溶液+完全培养基,培养24 h;TSPAN8 质粒过表达(PCDNATSPAN8)组:转染TSPAN8-PCDNA3.1质粒24 h;过表达对照(PCDNA3.1)组:转染PCDNA3.1 质粒24 h;PCDNA-TSPAN8+FFA模型干预(PCDNA-TSPAN8+FFA)组:转染TSPAN8-PCDNA3.1 质粒24 h,换终浓度为1 mmol/L FFA 溶液+完全培养基,培养24 h;PCDNA3.1+FFA 模型干预对照(PCDNA3.1+FFA)组:转染PCDNA3.1质粒24 h,换终浓度为1 mmol/L FFA溶液+完全培养基,培养24 h。
1.2.3 细胞质粒DNA转染 转染前1d,将HepG2细胞用胰酶消化后按照约2.5×10/孔细胞在6孔板中进行铺板,24 h内开始转染。对于每孔细胞,用125 μL无血清培养基稀释2.5 μg 质粒DNA 与5 μL P3000,混匀;用125 μL无血清培养基稀释7.5 μL lipo3000,震荡2~3 s混匀;将稀释的DNA溶液加入稀释的转染试剂中,轻轻混匀,室温孵育10~15 min。六孔板中每孔加入2 mL含10%血清的培养基,再每孔逐滴加入上诉250 μL转染试剂-DNA混合液,轻摇培养板使其混匀,置于培养箱中继续培养24 h用于后续实验。
1.2.5 Western blot检测TSPAN8的蛋白表达水平 使用RIPA裂解液与PMSF蛋白酶抑制剂的混合溶液从培养的细胞或小鼠肝组织中提取总蛋白质,BCA法测定蛋白浓度,并用5×上样缓冲液配平,置于100 ℃充分变性10 min,蛋白样品上样后,经电泳、转膜至PⅤDF 膜上;5%脱脂奶粉封闭1 h;4 ℃冷藏室摇床过夜孵育相应一抗(TSPAN8抗体稀释比例为1∶1000);TBST 洗膜3次,10 min/次;室温摇床上孵育二抗1 h(β-actin抗体稀释比例1∶2000);TBST 洗膜3 次,10 min/次;超敏ECL试剂显影。
在农药减量控害的基础上,绿色创新发展才是重中之重。贵州大学教授陈卓介绍说,我国农药科技创新平台已经初具规模,一批国家级、省部级农药科技创新平台相继建立,我国农药创制体系已从仿制为主向自主创新稳步发展,科技创新基础理论体系和方法已经初步形成。
郭施亮(财经名博,职业投资者):2019年到底是炒房还是炒股?从实际情况出发,虽然国内部分地区的房地产市场存在稳中有升的预期,但考虑到价格风险、流动性压力以及政策不明朗等因素,实际上对于房地产的投资也应该趋于理性与谨慎。至于股票投资,笔者认为,可能呈现出先抑后扬的表现,而对于2500点附近乃至以下的A股市场,实际上无需过分恐慌,当市场估值水平以及平均价格水平得到大幅压缩之际,或许更有利于提升市场自身的投资吸引力,同时也为以后股市的回升创造出更好的发挥空间。
女警官笑了,聪明人的话。送何良诸走出办公室,沿楼道前行。警察找人谈话,一般是不送的,更不会送这么远. 女警官很客气。何良诸可不客气,没有说“留步”。本来,一个电话打到文化厅,就能办的事,却兴师动众地把他调来。你们的衙门口,太邪乎了。
睁开双眼时,小伊身穿病号服裹在白色被子里,迎面而来的是来自一些穿着制服的人探寻的目光。出乎意料的是,警察并没有追究他的民事责任,只是指着病房外抽泣着的女人问他是否认识。本来毫不犹豫的“不认识”三个字,不知为何无法说出口,那女人头上的发丝白的有些晃眼,刺痛了他的眼睛,熟悉的阵痛再次袭来。
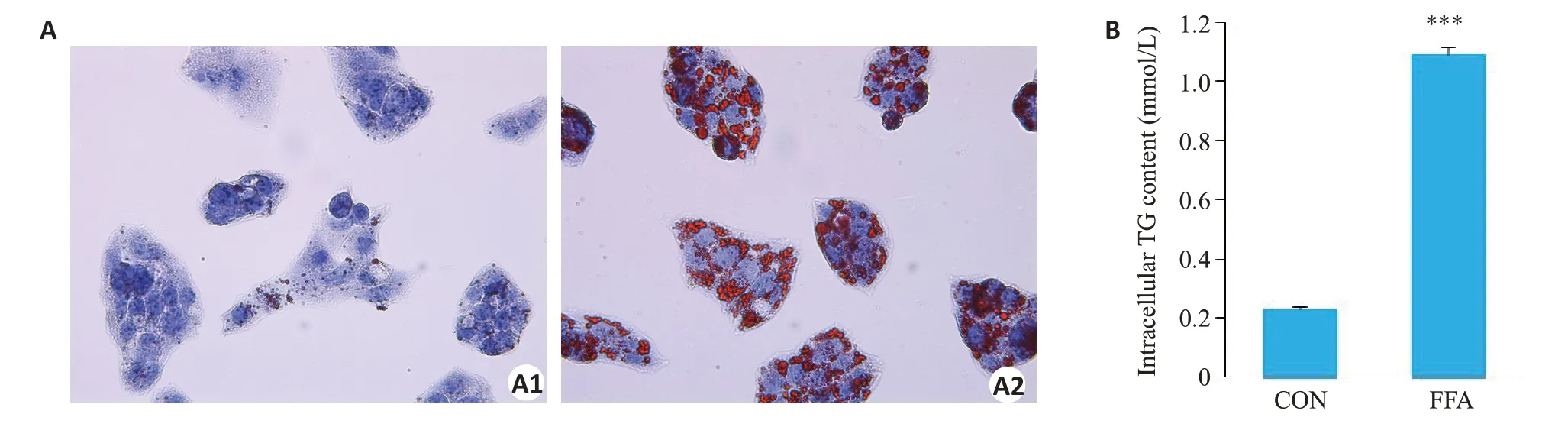
油红O染色结果显示:与CON组(图3A1)比较,FFA组(图3A2)细胞内红色脂滴聚集明显增多,呈较大的圆颗粒状。全自动生化仪检测细胞内TG含量结果显示:FFA组细胞内TG水平高于CON 组,约为CON 组5倍,差异有统计学意义(<0.001,图3B),以上结果充分证明NAFLD体外细胞模型构建成功。
1.2.7 油红O染色 按照油红O染色试剂盒说明书操作,于显微镜下观察细胞内脂滴沉积情况并拍照。
1.3 统计学分析
实验数据以均数±标准差表示,采用GraphPad Prism 9软件进行分析,比较两组间数据采用独立样本检验,以<0.05为差异具有统计学意义。
2 结果
2.1 小鼠体质量和血清TG含量检测
与相同喂养时间ND组小鼠体质量相比,1、3、6月末HFD组小鼠体质量均有增长(<0.01),且随着喂养时间的延长,两种喂养方式的小鼠体质量差距逐渐增大。与相同喂养时间ND组小鼠体质量相比,1月末HFD组小鼠血清TG差异无统计学意义,而3、6月末HFD组小鼠血清TG含量分别为同喂养时间ND组的1.7倍(<0.05)、1.8倍(<0.001),差异均有统计学意义(表2)。
2.2 小鼠肝脏HE染色
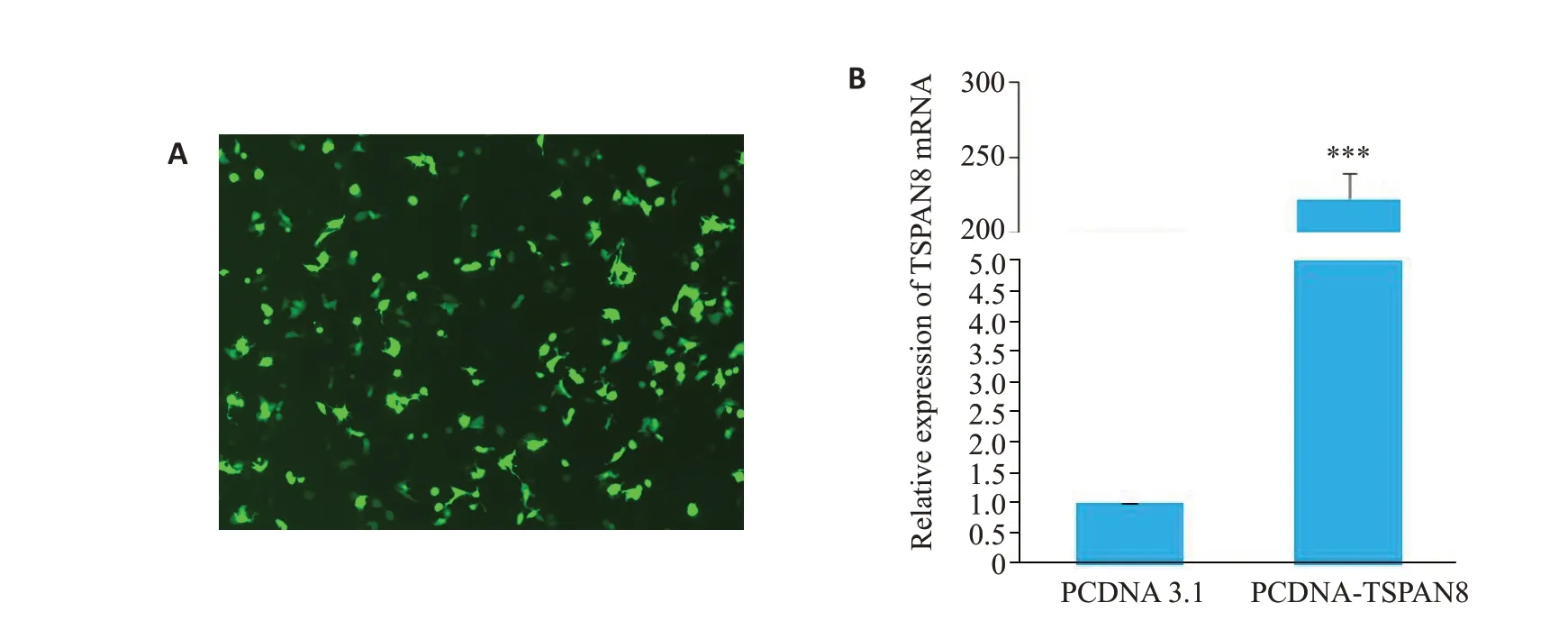
将GFP 质粒、TSPAN8 质粒和空载质粒(PCDNA3.1)分别转染HepG2细胞24 h,荧光显微镜下为绿色的即为转入细胞内的GFP质粒(图5A)。同时通过qRT-PCR 的方法检测TSPAN8质粒转染效率,结果显示该实验条件质粒转染24 h 后可以明显增加TSPAN8质粒在HepG2细胞中的表达水平(<0.001,图5B)。

2.3 TSPAN8在小鼠NAFLD模型中的表达
用qRT-PCR与Western blot法检测CON组与FFA组两组中HepG2细胞TSPAN8的表达情况。qRT-PCR检测结果显示:与CON组比较,FFA组TSPAN8的表达明显下降,约为对照组的0.5 倍(<0.01,图4A);Western blot 实验结果显示,与CON组比较,TSPAN8在FFA组中的蛋白表达降低(图4B),用imagej软件进行半定量分析,FFA组TSPAN8的表达量约为CON组的0.5倍(<0.001,图4C),与qRT-PCR结果趋势一致。
1.2.4 qRT-PCR 检测TSPAN8 和成脂相关基因的mRNA 表达水平 TRIzol 法提取各组细胞总RNA,DEPC水溶解,用微量分光光度计检测总RNA的浓度和纯度,并用反转录试剂盒反转录为cDNA,反应条件为37 ℃15 min,85 ℃5 s,4 ℃1 min。采用TB Green Premix II预混液于荧光定量PCR 仪上进行测定,反应条件为95 ℃30 s;95 ℃5 s,60 ℃30 s,40 个循环;绘制溶解曲线。β-actin基因作为内参,mRNA 相对表达量通过公式2计算。β-actin引物由中国锐博公司设计并合成。其他qRT-PCR 引物均上海生工生物工程股份有限公司合成。qRT-PCR引物序列见表1。
2.4 NAFLD细胞模型验证
1.2.6 生物化学指标的检测 全自动生化分析仪检测小鼠血清和HepG2细胞内TG含量。
2.5 TSPAN8在NAFLD体外模型中的表达
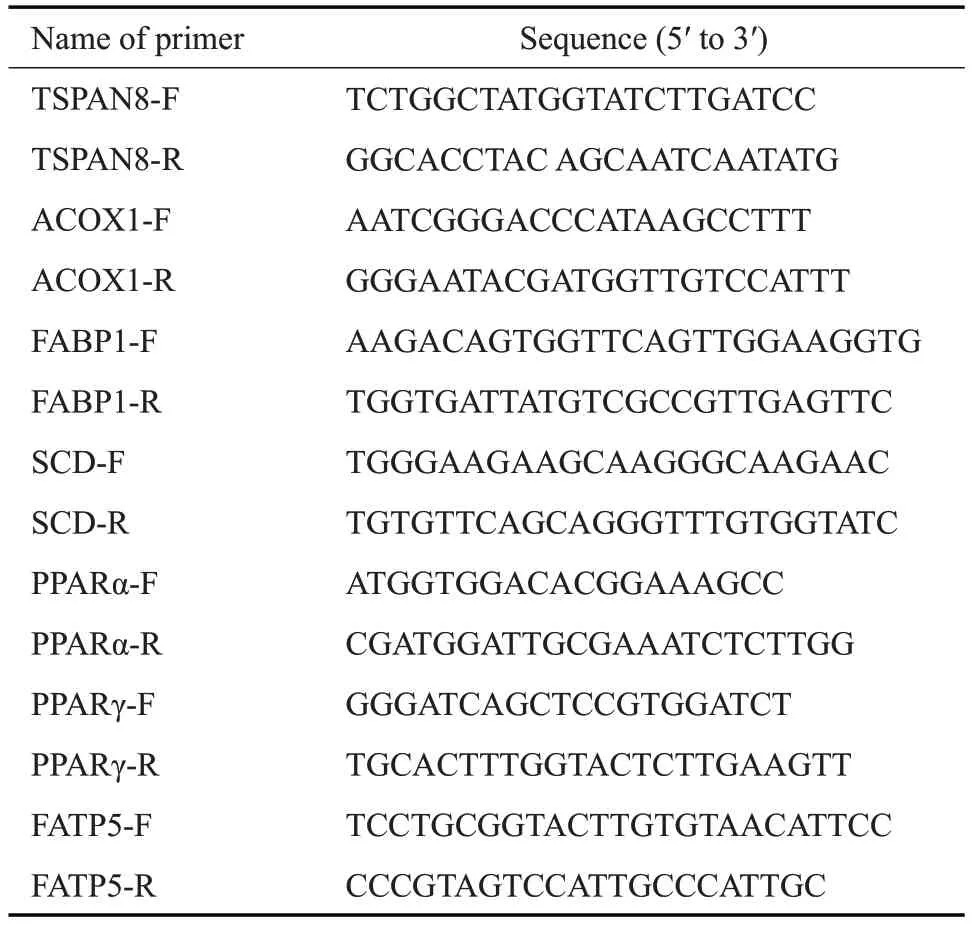
随机选取ND与HFD组1、3、6月末的小鼠各3只,通过Western blot法分别检测其肝脏TSPAN8表达情况(图2A)。用imagej软件进行半定量分析示,与相同喂养时间ND组比较,HFD组TSPAN8相对表达量在喂养1月末差异无统计学意义(>0.05),3、6月末均明显下调(<0.05),3月末TSPAN8的相对表达量约为对照组的0.5倍,6月末约为0.4倍。与1月末HFD组相比较,3、6月末HFD组也均明显下调(<0.05)。与3月末HFD比较,6月末HFD差异无统计学意义(>0.05,图2B)。

2.6 质粒转染验证
小鼠肝脏HE染色结果示:1、3、6月末ND 组小鼠肝脏切片肝小叶结构清晰,肝细胞大小正常、形态规整、无明显脂肪变,无明显炎细胞浸润;而随着高脂饲料喂养时间延长,HFD组小鼠肝脏脂肪变逐渐增多,1月末未见明显脂肪变,3月末可见少量脂肪变,6月末脂肪变较多(>33%),均无明显炎细胞浸润(图1)。以上结果提示6月末HFD组小鼠NAFLD模型构建成功。
2.7 过表达TSPAN8 对HepG2细胞中脂质蓄积的影响
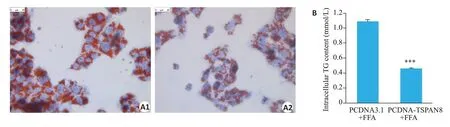
油红O染色法显示:与PCDNA3.1+FFA组(图6A1)相比,PCDNA-TSPAN8+FFA组细胞内脂质堆积明显减少(图6A2)。肝细胞内TG检测结果表明:PCDNATSPAN8+FFA 组细胞内TG 水平低于PCDNA3.1+FFA 组,约为PCDNA3.1+FFA组0.4倍,差异有统计学意义(<0.001,图6B)。
明代王骥德尚词之婉媚,贬苏词之豪放,其在《曲律》中云:“词曲不尚雄劲险峻,只一味妩媚闲艳,便称合作。是故苏长公、辛幼安并置两厢,不得入室。”[11]清代沈谦崇尚婉约之风格,否定苏轼“以诗为词”,其云苏词“为填词之变调,非词之正宗也”(《答毛稚黄论填词书》)。厉鄂以苏词不就声律,故称其词为“硬语”。
2.8 过表达TSPAN8对NAFLD体外模型中成脂基因的影响
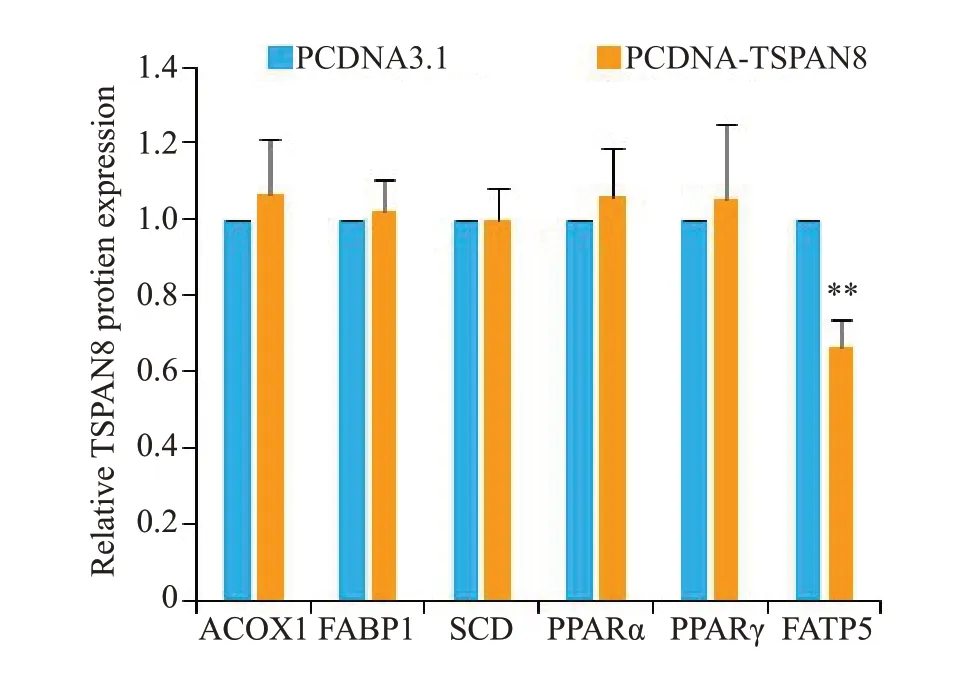
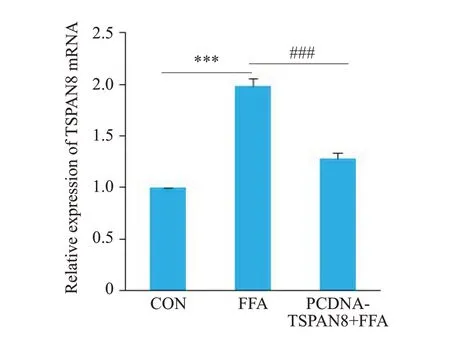
qRT-PCR结果示,与PCDNA3.1 组比较,PCDNATSPAN8 组中的ACOX1、FABP1、SCD、PPARα、PPARγ mRNA表达无明显差异(图7),FATP5 mRNA 的表达量则明显低于PCDNA3.1组(图7,<0.01)。与CON组相比,FFA组FATP5 mRNA 水平明显增加(<0.001),与FFA 组相比PCDNA-TSPAN8+FFA 组mRNA 水平明显降低(图8,<0.001)。
3 讨论
在NAFLD 的发生发展过程中,肝脏中过多的脂肪堆积是对正常肝细胞的首要打击。因此,抑制NAFLD 早期过度脂质积累是对抗NAFLD 的重要策略。以往的一项TSPAN8敲除鼠研究表明TSPAN8与肥胖和脂质代谢有关,TSPAN8基因的缺失会导致正常饮食和高脂肪高碳水化合物饮食雄性小鼠的体质量以及血浆游离脂肪酸水平降低,定量核磁共振显示其总体质量减少是脂肪组织质量和瘦组织质量(分别为16.9%和10.9%)减少导致。但是具体的机制并未阐明,也没有说明这种现象是否与肝脏的脂质代谢功能相关。我们的研究发现TSPAN8在NAFLD的动物和细胞模型中表达降低,过表达TSPAN8会降低NAFLD细胞中的脂质蓄积,似乎与之前的研究矛盾。我们推测可能是小鼠肝脏中的TSPAN8缺失,导致其肝脏摄入游离脂肪酸增多合成TG的能力增加,导致肝内TG蓄积,脂肪重新分布。事实上已经有相关研究表明基因驱动的NAFLD可能会导致“瘦”体质量,实际上是一种“脂肪营养不良NAFLD”表型,其特征是外周脂肪减少但中央脂肪积累增加,循环血脂正常或低。
FATP5是一种肝脏特异性蛋白质,主要由肝细胞表达,并定位于基底膜。FATP5 蛋白在脂肪酸的摄取中起重要作用。而脂肪酸代谢的改变是包括NAFLD在内的许多代谢疾病和病理状况的标志。一项小鼠FATP5因敲除实验表明,该基因的缺失可以防止肝脏TG积聚,显著降低脂质摄取,提高胰岛素敏感性。通过基于气相色谱/质谱的分析,分别在KO小鼠中检测发现肝脏TG含量减少了59%,长链脂肪酸的摄取量减少了50%,同时该研究发现,FATP5 的缺失会改变肝脏脂质摄取和输出的调节,导致脂质从肝脏重新分布到其他FFA 代谢组织。另一项研究表明,在NAFLD的晚期NASH阶段,肝脏FATP5 表达与NAFLD 组织学变化呈负相关,这与NASH 进展为肝硬化期间的肝脏脂肪减少有关。我们的研究表明,与细胞对照组相比,FATP5在由FFA诱导的NAFLD模型中表达显著升高,在细胞中过表达TSPAN8会导致FATP5的表达降低,此时油红O染色以及细胞内TG检测提示细胞中的TG明显减少。结合之前的研究结果,所以我们推测TSPAN8过表达引起的细胞内脂滴的减少可能是通过抑制FATP5的表达实现的。
综上,本研究探索了TSPAN8在NAFLD 动物模型形成过程中的变化,以及在体外细胞模型中对脂滴生成的影响。研究发现TSPAN8在NAFLD动物和细胞模型中表达均下降,TSPAN8过表达可使NAFLD细胞模型中的脂滴减少,而这种作用可能是通过影响下游PAFT5基因的表达,从而改变肝脏对脂肪酸的摄入引起的。这些发现表明TSPAN8 可能在NAFLD 的发生和发展中起着至关重要的作用,为NAFLD脂代谢提供新的作用机制,通过干预TSPAN8抑制肝脏中FATP5 介导的脂肪酸的摄取似乎是治疗NAFLD 的潜在途径。

