t(8;21))急性髓系白血病中RNA N66-甲基腺嘌呤(m6A)的修饰特征
急性髓系白血病(AML)是一种以髓系干/祖细胞克隆性增殖和分化受阻为特征的血液系统恶性疾病。AML1-ETO(AE)来源于t(8;21)(q22;q22)染色体易位,见于约4%~8%的AML。除了通过其RUNT结构域直接与靶基因结合外,AML1-ETO还可以被招募而形成稳定的AETFC复合物与DNA结合,使其在转录水平上通过与靶基因结合而调控转录。AE的缺失会导致转录因子结合的广泛改变,进而改变基因表达,并损害AML的生长。尽管可以确定因AE敲除改变的基因,但鉴于基因表达的调控可以发生在转录和转录后水平上,因此无法确定这些改变是直接还是间接发生的。而AE是否以及如何在转录后水平调控基因表达尚不清楚。
课后交流,同事总结说:“杨老师,你的这堂课,有朗读、静思、讨论、争鸣、共识、多元评价,充满学科特点、人文元素且智慧启迪。你说的话少,却又画龙点睛。满堂课没有花样,却有氛围。让人感觉意犹未尽,听了还想听。”
N6-甲基腺嘌呤(m6A)是高等生物mRNA 和IncRNA上甲基化修饰最普遍的存在方式。m6A通过调节RNA稳定性和蛋白质翻译速率而在转录后水平上调节基因表达并显著影响癌症的发展。m6A甲基化过程表现出动态和可逆的特征,它可以由甲基转移酶复合物(如WTAP、METTL3、METTL14)安装,同时也可以被去甲基化酶(如FTO、ALKBH5)清除,并被m6A 结合蛋白(如YTHDF1/2/3、YTHDC1/2 和IGF2BP1/2/3)识别。研究发现甲基转移酶METTL14在伴有t(8;21)、t(11q23)或t(15;17)的AML中高表达,通过改变m6A修饰模式促进白血病的发展。
因此本研究将AE依赖的转录调控与m6A相结合,通过对AE敲除前后的AML细胞进行m6A测序,分析细胞内的m6A修饰特征,观察AE在转录后水平上通过改变m6A修饰模式对基因表达的影响。
从研究方法可以看出,我国研究者更关注于注重研究实际效果的实证研究,理论研究较少,这对我们实际进行英语词汇学习有直接效果。但是通过分析众多进行实证研究的论文,我们发现研究方法最多是采用问卷和访谈形式,其他方法的使用很少。如马蓉、秦晓晴(2017)通过分发词汇学习问卷和词汇测试卷给294名受试者以研究动机调控的词汇学习模型。
1 材料和方法
1.1 试剂与仪器
MeRIP-Seq和RNA-Seq联合分析结果显示,在AE敲除和未敲除中,与非m6A修饰的基因相比,m6A所修饰的基因表达水平更高(SKNO-1:0.6116±1.2632.010±1.655,<0.0001;SKNO-1 siAE:0.5528±1.2572.067±1.686,<0.0001,图4A)。GO分析显示,转录组参与转录调控、信号诱导等生物过程,其基因产物在细胞质、胞浆与细胞核等部位发挥作用,影响着蛋白质、离子、DNA结合等功能(图4B)。当m6A修饰落在不同区域时,对于仅有一个m6A修饰位点的基因,若其在外显子区被m6A修饰,则表达量低于3'UTR或5'UTR m6A修饰的基因(SKNO-1:1.973±1.7371.018±1.3802.267±1.872,<0.0001;SKNO-1 siAE:2.181±1.8260.9823±1.424,<0.0001,0.9823±1.4242.065±1.860,<0.0001,2.181±1.8262.065±1.860,NS,图4C)。统计所有被m6A 修饰的基因,也表现出相同的趋势(SKNO-1:2.177±1.6331.333±1.4702.449±1.651,<0.0001;SKNO-1 siAE:2.304±1.6711.336±1.5222.394±1.649,<0.05,图4D)。对于m6A修饰的数量与基因表达量关系的分析显示,与仅有一个m6A修饰位点的基因相比,拥有更多m6A修饰位点的基因其表达量也相对更高(图4E)。
1.2 细胞培养
SKNO-1与SKNO-1 SIAE细胞株由301医院血液科实验室提供,自液氮复苏后将细胞培养于含10%胎牛血清、1%双抗的RPMI 1640培养液的培养皿中,放置培养箱培养(37 ℃、5%CO、饱和湿度),每2~3 d换液传代1次。
1.3 MeRIP-seq和RNA-seq
战士们默默地望着眼前这位一年轻的连长,此时,无需语言,无需口号,他们已在心里下定了必死的决心。只要一息尚存,决不会让小鬼子越过高家岭阵地。
1.4 实时荧光定量PCR
对两个细胞系的基因表达水平进行比较,结果显示,敲除AE融合基因后出现6000多个差异表达的基因(图3A,log2 fc>1.5,<0.05),其中2483个基因表达上调,3913个基因表达下降(图3B)。差异表达的基因分布于癌症中的转录失调、肿瘤坏死因子、调节干细胞多能性、癌症通路等多条通路中(图3C)。GO分析表明,这些差异表达的基因参与了包括质膜形成、多细胞生物发育等多种生理过程(图3D)。

1.5 数据分析
1.5.2 统计学分析 采用IBM SPSS Statistics 24.0 及GraphPad Prism 9软件进行统计分析。定量资料采用均数±标准差表示,独立样本检验用于符合正态分布定量资料的组间比较;Mann-Whitney用于不符合正态分布定量资料的组间比较,<0.05为差异有统计学意义。
利用MeRIP-Seq在AE(+)和敲除AE的AML细胞系中进行RNA m6A测序,分析整个转录组m6A修饰的变化。利用高通量测序技术进行转录组测序(RNA-seq)。基因测序由杭州联川生物技术股份有限公司进行。使用Trizol 试剂提取总RNA 后,使用Oligo-dT 磁珠对total RNA带有polyA的mRNA进行富集。对磁珠进行富集,得到带有polyA的mRNA。之后加入片段化试剂,将完整的mRNA进行片段化,片段化长度约为100 nt。将片段化后的RNA分成2份。一份加入带有预混好的m6A抗体免疫磁珠,对含有m6A甲基化的mRNA片段进行富集。另一份作为对照,直接构建常规的转录组测序文库。对m6A抗体免疫磁珠进行富集,带有m6A的mRNA片段进行回收后,按照转录组的建库流程构建常规的测序文库。分别将构建好的2 个测序文库,即m6A-seq library(IP)和RNA-seq library(input)分别进行高通量测序,测序平台为Illumina Novaseq™6000,测序模式为150 PE。
1.5.1 MeRIP-seq&RNA-seq 数据分析 Cutadapt 以及本地perl脚本去除低质量序列、污染序列以及测序仪接头序列,得到CleanData。使用fastp软件对CleanData进行质控。使用HISAT2的默认参数将reads比对到参考基因组上。exomePeak 和ChIPseeker 进行Peak calling分析和Peak注释。MEME和HOMER对富集区域进行motif分析。基因定量软件为StringTie,归一化方式为FPKM。基因差异分析采用R 包edgeR。ggplot2 包对GO 富集分析结果以散点图展示,Rich factor表示位于该GO的差异基因个数/位于该GO的总基因数。
2 结果
2.1 SKNO-1与SKNO-1 siAE细胞系的m6A修饰
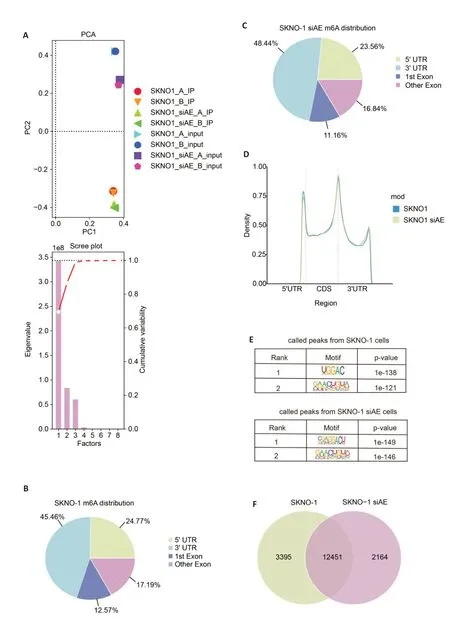
通过MeRIP-Seq 技术对AE(+)的AML 细胞系SKNO-1与敲除AE的SKN0-1 siAE细胞系进行RNA m6A甲基化测序,测序结果的主成分分析显示,SKN0-1 siAE细胞系的2个样本可以与SKNO-1细胞系的2个样本区别开,具有可比性(图1A)。为了分析m6A在两个细胞系转录组中的分布,根据其在mRNA上的位置,将m6A peak划分为5′非翻译区(5'UTR)、蛋白质编码区(CDS)及3′非翻译区(3'UTR),m6A peak主要在2个细胞系的外显子区及3'UTR富集(图1B、C)。峰密度分析也显示m6A peak主要富集于CDS区与3'UTR(图1D)。Motif 分析显示,在2 个细胞系内均有m6A 结合基序RRACH(图1E)。在测序结果中,共检测到26 441个基因,包含了72 036个m6A peak。其中有2164个基因仅在SKNO-1 细胞系中表达,3395个基因仅在SKNO-1 siAE细胞系中表达,12 451个基因在两细胞系共表达(图1F)。
马约翰先生在1934年谈到体育时就说清华的体育终极目标是普及,要教导学生们不仅在学校里要进行体育锻炼,进入社会也不能停止锻炼,倡导终生体育。“动是健康的源泉”,这是马约翰先生在早年提出的理论,并在1954年出版《我的健康是怎么得来的》一书中反复强调。他
2.2 m6A动态分析
AE敲除后细胞内的m6A peak数量由37 042个变成34 994个(图2A)。其中1278个peak显著上调,1225个peak显著下调,20 827个peak无显著变化(<0.05,log2fc>1,图2B)。分析显示AE敲除后增多的peak主要集中在CDS区与3'UTR区,降低的peak则主要集中在CDS区(图2C)。AE敲除后新出现了1316个m6A修饰的基因,1830 个基因失去了m6A 修饰(图2D)。KEGG通路分析的结果显示,差异的peak主要在癌症、人类T淋巴细胞白血病病毒Ⅰ、嘌呤代谢、血小板活化等通路中富集(图2E)。
综上,网络课程具有便捷、内容丰富、节约成本、受众广泛等特征,前两个特征是对于学习者来说的,而后一个则是设计者需要考虑的。网络课程相较于传统课程来说,它虽有如此之多的好处,却无法保证学习者的同一性。即目前绝大多数的网络教育只解决了距离和空间上的问题, 却忽视了参与者的广泛性、多样性和特殊性[3]。不论是从学习需要还是从设计者的经济效益来说,应解决这些障碍,完善网络课程学习模式。

2.3 AE敲除后基因表达水平变化
SKNO-1与SKNO-1 siAE培养1周后,通过trizol法提取总RNA。紫外分光光度计测定RNA浓度。利用快速逆转录试剂盒制备cDNA。KAPA SYBRFAST qPCR 试剂盒进行实时定量荧光PCR。以GAPDH作为对照。20 μL反应体系,95 ℃20 s;95 ℃3 s,60 ℃20 s,72 ℃20 s,40 个循环。所用引物如表1。

2.4 RNA-seq与m6A-seq的联合分析
RPMI 1640培养液、胎牛血清、青霉素链霉素双抗混合液(Gibco),mRNA 提取试剂盒Magnetic mRNA Isolation Kit S1550S[NEB(北京)有限公司],Hybond-N+膜(GE Healthcare),Dot Blot(170-3938)(Bio-Rad),m6A抗体(Proteintech),二抗抗兔抗体(CST),ChemiDoc™成像系统(BIO-RAD)。
2.5 AE敲除后m6A相关酶水平的变化
AE 敲除后,测序结果显示,AE 敲除后2 种甲基转移酶WTAP、METTL14 与去甲基化酶ALKBH5 表达量均升高(WTAP:5.36±0.565713.19±0.3253,METTL14:2.850±0.15568.815±1.761,ALKBH5:13.70±0.459639.84±6.067,<0.05,图4F)。qPCR检测敲除AE前后METTL14、WTAP、ALKBH5的表达水平,结果显示WTAP表达量升高1.7倍、ALKBH5表达量升高2.4倍,而METTL14表达量降低至0.93倍(图4G)。

3 讨论
M6A修饰作为真核生物中最普遍的转录后修饰不改变碱基配对和编码,但通过不同的甲基转移酶、去甲基化酶、阅读蛋白和相关复合物相互作用,在多个水平上广泛影响基因表达。因此,动态m6A修饰对许多正常生物过程以及癌症的发生、进展、转移、耐药性和癌症复发至关重要。以往对于AML中AML1-ETO融合基因与m6A修饰的研究大多集中于这二者独立的作用机制。如AE调节的转录对白血病发生发展的影响,或m6A及m6A相关酶在白血病中的作用。鲜少有对AE与m6A之间关系的研究。因此本研究希望观察AE在转录后水平上通过改变m6A修饰模式对基因表达的影响,探索AE依赖的转录与m6A修饰之间的联系。
本研究发现m6A peak主要在敲除AE和表达AE的外显子区及3'UTR富集,这与此前真核生物细胞内有关m6A的研究结果一致。且Motif分析显示在两个细胞系内均有m6A结合基序RRACH,符合先前研究中对m6A共识结合基序[G/A/U][G>A]m6AC[U>A>C]的认识。这证明本研究结果中对m6A的研究是准确可靠的。
既往研究证实,在SKNO-1细胞中抑制AML-ETO可导致细胞分化和白血病细胞生长抑制,通过siRNA将AML1-ETO敲除可使SKNO-1细胞系对诱导细胞分化的TGFβ1敏感,克隆形成减少,抑制细胞增殖并诱导衰老。本研究在敲除AE和表达AE的AML细胞系中进行RNA m6A甲基化测序,结果显示AE敲除后新出现了1316个m6A修饰的基因,1830个基因失去了m6A修饰。增多的peak主要集中在CDS区与3'UTR区,降低的peak则主要集中在CDS区。AE的敲除对细胞内的m6A修饰数量和位点均造成了影响,显示出AE对m6A修饰模式的调控作用。结合敲除AML1-ETO后细胞内m6A修饰模式的改变,可以推测AML1-ETO这种对细胞功能的影响或许与其改变m6A修饰模式的能力有关。
RNA-seq结果的GO分析显示差异表达的基因与m6A peak富集在干细胞多能性的调节、癌症中的转录失调等多条通路中,提示AE与m6A对癌症发生发展的重要性。KEGG通路分析显示差异的m6A peak与基因在转化生长因子、肿瘤坏死因子等信号通路中富集,其与细胞生长、凋亡、分化与肿瘤发生发展有着密切联系。MeRIP-Seq和RNA-Seq联合分析提示,是否有m6A修饰、m6A修饰位点的数量与位置对调控基因表达水平起着重要的作用。当t(8;21)AML 发生时,AML1-ETO或许是通过在这些通路上调控基因的m6A修饰状态进而调节其表达,促进AML的发展。
此外,在RNA-seq与实时荧光定量PCR的结果中均检测到AE敲除后甲基化酶WTAP、METTL14和去甲基化酶ALKBH5的表达变化,这提示AE或许通过调控一种或多种m6A相关酶的表达控制细胞内的甲基化水平。其中甲基转移酶WTAP不止作为甲基转移酶复合物的重要组成部分,其自身也作为一种致癌因子在体内起着重要的作用,并且与正常细胞相比,WTAP在急性髓系白血病细胞中的表达高于正常水平。AE的敲除所造成的m6A相关酶差异表达展示了AE对于细胞内m6A相关酶的影响,推测AML1-ETO融合基因或许可以调控一种或多种m6A相关酶的表达控制细胞内的甲基化水平,影响m6A修饰模式,从而起到调节白血病细胞侵袭性生长的作用。这或许能为m6A调节剂治疗AE(+)的AML提供新的思路。

