基于贝叶斯的苯并(α)芘PBPK模型优化与健康风险评估应用
孟祥晖,王宏洋*,孙宇巍,张明慧,朱光灿3*,沈亚琴,柳慧芳
基于贝叶斯的苯并(α)芘PBPK模型优化与健康风险评估应用
孟祥晖1,2,王宏洋2*,孙宇巍2,张明慧2,朱光灿1,3*,沈亚琴2,柳慧芳2
(1.东南大学能源与环境学院,江苏 南京 210096;2.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012;3.东南大学,环境医学工程教育部重点实验室,江苏 南京 210096)
应用基于生理的药代动力学(PBPK)模型预测苯并(α)芘(BaP)暴露的人体内部剂量,基于贝叶斯的马尔科夫链蒙特卡洛模拟(MCMC)方法对模型参数进行校准和优化,最后运用已优化的模型对BaP内暴露基准值进行推导.研究发现,基于贝叶斯的MCMC方法对模型后验参数校准后,模型精度明显提高,两个数据集验证结果显示残差平方和分别降低了72%和94%.PBPK模型以BaP和子代谢物3-羟基苯并(α)芘(3-OHBaP)的体内动力学过程为结构基础,模拟BaP体内浓度分布大小为脂肪>肾脏>皮肤>缓慢灌注组织>快速灌注组织>静脉血>肝脏;3-OHBaP体内浓度分布大小为肾脏>快速灌注组织>脂肪>肺>静脉血>缓慢灌注组织>肝脏>皮肤.敏感性分析显示,快速灌注组织-血分配系数对模型输出影响最大,灵敏度系数超过了200%;排泄系数影响最小,只有肾小球过滤率KBR的灵敏度系数超过了1%.以美国国家环境保护局推荐的参考浓度2.0×10-6mg/m3为外暴露安全基准值,基于PBPK模型推导了职业暴露的BaP生物监测当量(BE),结果显示BE值为0.405pmol/mol肌酐(尿液3-OHBaP平均浓度),为基于人体内暴露剂量水平进行定量健康风险评估奠定了基础.
苯并(α)芘;贝叶斯统计;马尔科夫链蒙特卡洛方法(MCMC);基于生理的药代动力学(PBPK)模型;3-OHBaP;生物监测当量
多环芳烃(PAHs)是环境中一类重要的持久性有机污染物,分布于自然界的各个角落[1].苯并(α)芘(BaP)作为PAHs中毒性最明确、致癌性最强的污染物受到了广泛关注.研究表明BaP存在于烘烤食物、土壤、河湖沉积物和街道空气等环境中,具有污染分布广、持续时间长和危害作用大等特点[2–5].作为一种五环化合物,BaP体内代谢过程复杂,在多种酶作用下迅速转化为多种代谢产物(羟基化物、醌类、环氧化物等)[6].其中3-羟基苯并(α)芘(3-OHBaP)是解毒反应的最终产物,相比较于其他代谢产物具有化学性质稳定和易检测分析等优势,所以尿液3- OHBaP被认为是一种反映BaP暴露情况的良好生物标志物[6–10].
依据现有报道,目前对BaP的健康风险评估一般是基于可接受的安全剂量标准和外暴露浓度[11–13].随着3-OHBaP这种生物标志物的研究不断深入,基于3-OHBaP内部剂量水平进行BaP健康风险评估或许是一种更为科学的方式.这种内暴露健康评估方法能够反映不同途径接触污染物的综合情况,摒弃了传统方法中将多个途径的风险简单相加的方式[14].虽然已经有多个研究监测并分析了人群中尿液3-OHBaP含量,但依然存在着BaP内暴露基准值缺失等问题,导致难以定量评估BaP内暴露健康风险,所以BaP内暴露基准值对于风险评估和风险管理尤为重要.
基于生理的药代动力学(PBPK)模型是预测化合物在生物体内剂量水平的数学模型,研究表明PBPK模型应用于内暴露健康风险评估具有一定的优势[15-16].在BaP的人体PBPK模型研究中,存在着人体代谢动力学数据缺失和BaP物化参数误差较大等缺陷,最终导致模型可靠性低[17].贝叶斯统计是一种基于概率分布分析未知参数不确定性的统计学方法,该方法是在已有的先验信息基础上,利用观测数据估计未知参数的后验概率分布[18].在多参数的贝叶斯模型中,通常利用马尔科夫链蒙特卡洛(MCMC)方法进行高维度的数值积分运算.已有研究运用基于贝叶斯的MCMC方法估计PBPK模型参数后验概率分布,模型验证结果表明该方法是一种可靠的模型校准和不确定性分析方法[19-20].
本文使用基于贝叶斯的MCMC方法对BaP和3-OHBaP 的人体PBPK模型参数进行了校准,分析讨论了优化后模型的准确性和BaP与3-OHBaP在人体内的动力学过程;并在PBPK模型基础上,推导了BaP职业暴露内暴露基准值,即人体生物监测当量,为基于内暴露的BaP定量健康风险评估提供了支撑.
1 材料与方法
1.1 PBPK模型结构和参数

图1 BaP和代谢产物3-OHBaP的PBPK模型结构
PBPK模型以生理学、生物化学和解剖学为基础,基于质量守恒定律模拟化合物在生物体内的吸收、分布、代谢和排泄等生理过程,并预测生物体内部组织剂量.在人体内暴露剂量难以检测的情况下,该模型已广泛应用于污染物的药代动力学和健康风险评估研究[15,21].BaP是一种复杂大分子化合物,进入人体内迅速代谢转化为其他产物,所以本文考虑了BaP生物标志物3-OHBaP的子模型.如图1, BaP与3-OHBaP的PBPK模型结构由肺部(Lung)、脂肪(Adipose Tissue)、皮肤(Skin)、肾脏(Kidney)、快速灌注组织(Richly Perfused Tissue)、缓慢灌注组织(Slowly Perfused Tissue)、肝脏(Liver)、静脉血(Venous Blood)和动脉血(Arterial Blood)等九个房室构成.模型各个腔室由血液循环联系,依据质量平衡关系建立常微分方程组对各个房室的BaP和3- OHBaP浓度进行求解,最终获得浓度-时间曲线.其中,模型参数的初始值是依据已发表文献:生理参数是以体重为70kg的成年人为标准,借鉴Brown等[22]的成年人房室体积和血流量推荐值;物化参数涉及BaP和3-OHBaP在不同房室的分配系数和血-气分配系数等;代谢参数依据最新人体肝脏微粒体代谢动力学的体外实验数据[23];排泄系数考虑了3- OHBaP的肝肠循环,即排泄过程中肠道对3-OHBaP的重吸收,该过程对3-OHBaP经胆汁和肠道的粪便排泄有一定影响[24].
1.2 贝叶斯统计与MCMC方法

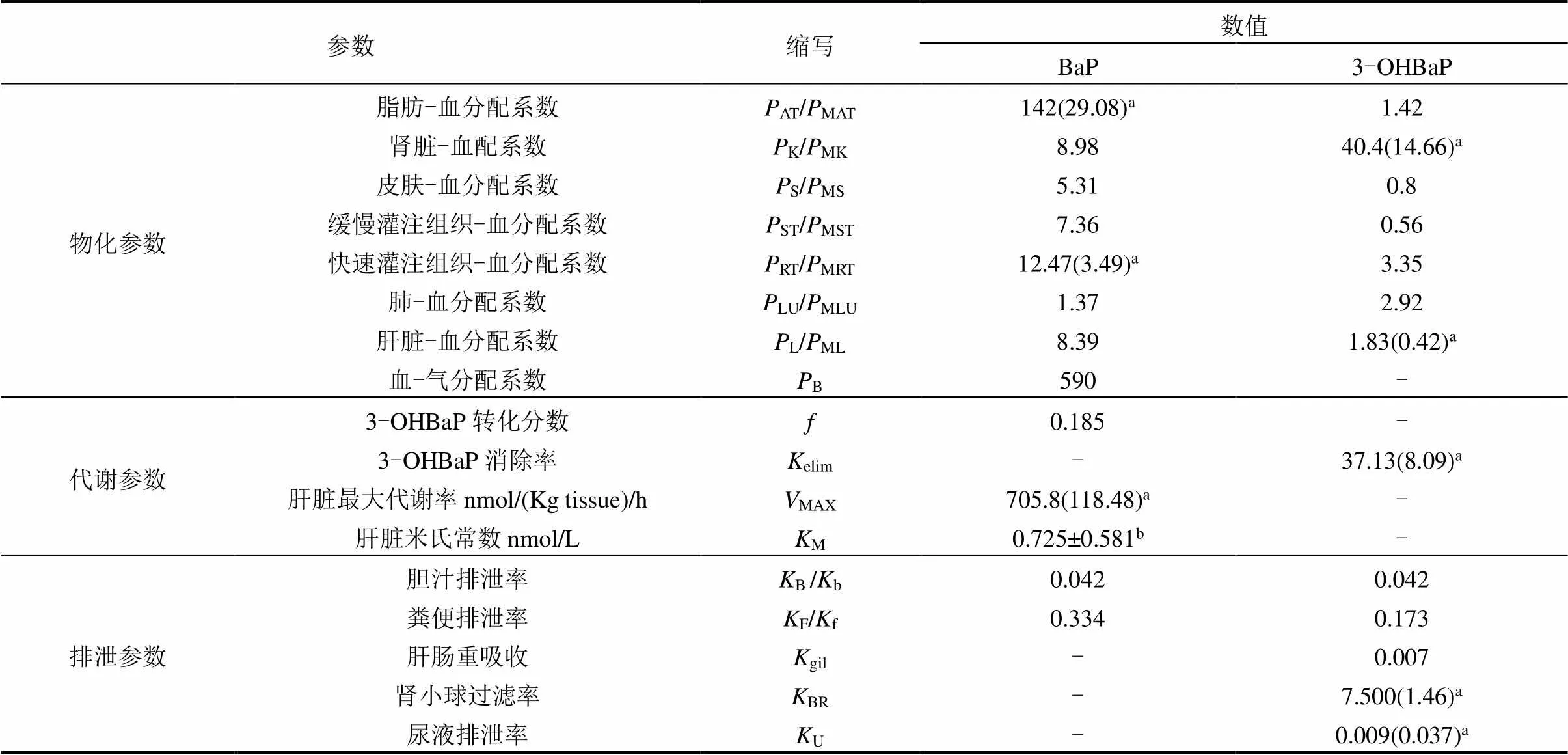
表1 PBPK模型参数先验值
注:a 括号中是Levenberg-Marquarelt算法和Barbeau等[26]的数据集对模型进行初步拟合的先验值; b取均值.
1.3 敏感性分析
对模型的后验参数进行敏感性分析,确定模型中对特定模型输出较为敏感的参数.归一化灵敏度系数(NSC)使用下列公式计算[27]:
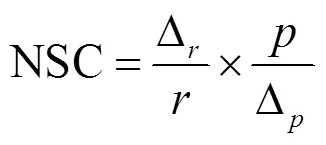
式中:是模型输出值;Δ是参数变化1%时模型输出的变化量;是目标参数;Δ代表参数1%的变化量.归一灵敏度系数的相对影响大小分类标准为低影响:|NSC|<20%;中影响:20%£|NSC|<50%;高影响: |NSC|>50%[19].
1.4 生物监测当量
传统人体健康风险评估一般是基于污染物外暴露浓度,最近研究表明生物监测结果可以反映污染物多途径吸收、实际生物学接触和混合物暴露情况等[14].人体生物监测是对生物样本中的生物标志物进行检测,生物样本包括血液、尿液或其他介质,最终结果可以表征人体污染物内暴露情况.Pletz 等[28]提出基于可接受的外暴露基准值(如每日可接受摄入量TDI、参考剂量RfD、参考浓度RfC等)估计人体内暴露基准值的方法,将该基准值定义为生物监测当量(BE).PBPK模型可以实现从外暴露安全基准值到BE的转化,将外暴露基准值作为模型输入,基于PBPK模型估算污染物或代谢物的内部剂量基准值,即为目标物质的BE值.在BE推导过程需要解决3个科学问题:1.可靠的外暴露基准值;2.合适的生物标志物;3.可靠的PBPK 模型.由于检测技术的限制,3-OHBaP的检出限较高,所以BaP的人体生物监测研究主要集中在职业暴露领域[8],但BE基准值的缺失导致无法基于生物监测结果对职业人群内暴露健康风险进行定量估算.
美国国家环境保护局关于BaP的外暴露安全基准值具有可靠的数据资料[13],结合已有的其他物质BE推导方法理论和3-OHBaP研究现状[8,28-29],本文基于优化后的PBPK模型推导BaP职业暴露BE值.对于致癌效应,一般认为大于零的所有剂量都有可能产生致癌风险,即零阈量[30].所以本文首先推导BaP非致癌效应BE基准值,以BaP非致癌效应的参考浓度2.0×10-6mg/m3作为外暴露基准浓度[13],将一周作为一个工作周期,工作日每天工作8h,基于PBPK模型估算尿液中3-OHBaP浓度[31].该方法遵循了Hays等[32]提出的推导原则,将一周内尿液中的3-OHBaP平均浓度作为BaP职业暴露BE基准值.
2 结果与讨论
2.1 模型验证与敏感性分析

综上,该研究基于贝叶斯和MCMC方法对模型参数进行了校准,优化后的模型精度明显提高.该方法所得到的后验参数概率分布95%置信区间比先验分布区间更小,降低了参数的不确定性.
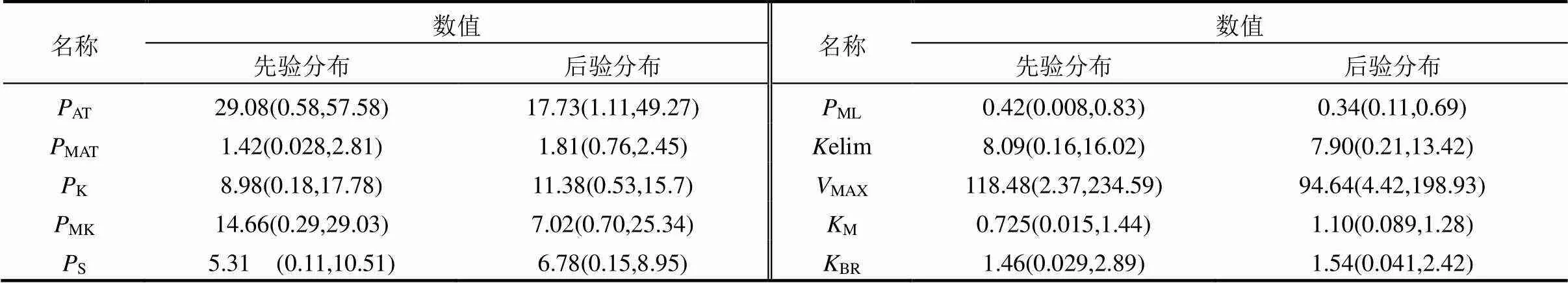
表2 MCMC模拟参数先验概率分布和后验概率分布的中位值(2.5%,97.5%)

续表2

2.1.2 模型敏感性分析 敏感性分析以BaP和3-OHBaP的静脉血浓度作为模型输出,依据公式(1)计算模型优化后各参数的归一化灵敏度系数.根据计算结果,选取归一化灵敏度系数大于1%的参数见图3.其中组织-血分配系数对模型具有较高的影响,特别是BaP快速灌注组织-血分配系数AT和BaP缓慢灌注组织-血分配系数PST.图3(a)和(b)显示AT的灵敏度系数最高,均超过了200%;ST的灵敏度系数也分别达到了104%和87%.这说明各个房室的吸收和分配作用显著影响了BaP和3-OHBaP在静脉血中的浓度,而快速灌注组织和缓慢灌注组织的影响最大.
另外,敏感性分析结果显示代谢参数的灵敏度系数大多数在20%~50%,对模型输出具有一定影响,这与Deng等[24]的结果类似.相比较对BaP静脉血浓度的影响,M和MAX代谢参数对3-OHBaP静脉血浓度的影响更高,灵敏度系数达到了30%;由于BaP在肝脏代谢转化为3-OHBaP,转化分数会显著影响3-OHBaP静脉血浓度,灵敏度系数高达100%.人体模型和大鼠模型的敏感性分析结果也有一定差异,研究表明大鼠PBPK模型的代谢参数对模型的影响最高[36],这与本研究的人体模型结果有所不同,推测是大鼠和人类的代谢动力学差异导致的.
相对于吸收和代谢过程,排泄参数对BaP和3-OHBaP的静脉血浓度影响不显著.在影响3-OHBaP静脉血浓度的参数中,只有肾小球过滤率BR的灵敏度系数超过了1%,达到22%.综上,敏感性分析结果显示各个房室的分配系数影响比代谢参数更高,排泄参数影响很低,这与Ortiz等[17]报道的PBPK模型敏感性分析结果具有差异,原因是该文献的敏感性分析是将尿液3-OHBaP作为模型输出值.

2.2 BaP与3-OHBaP体内动力学分析
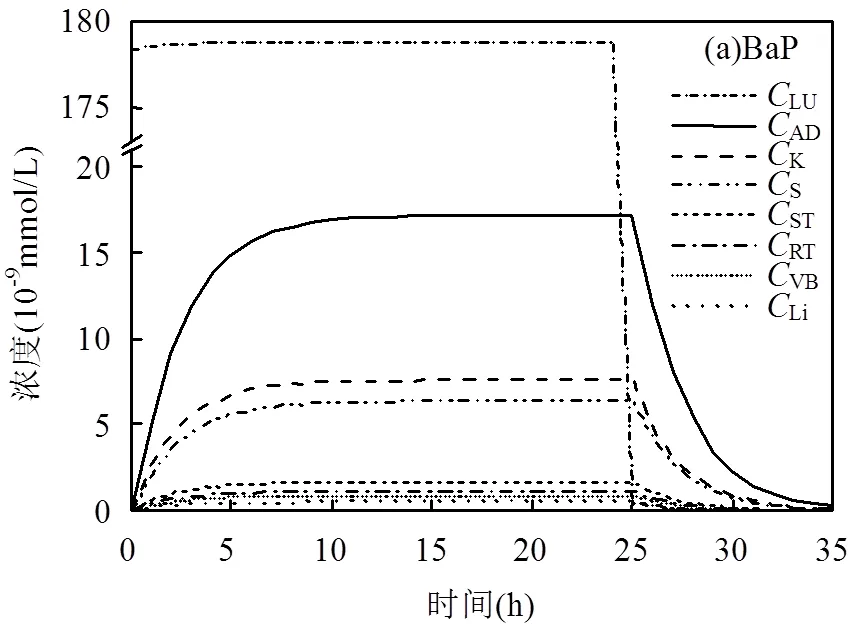
2.2.1 BaP体内动力学分析 图4(a)显示了24h连续暴露0.1mg/m3BaP之后,人体内BaP浓度随时间的变化情况.由于肺部作为BaP吸入暴露的第一房室,前24h内呈现持续高浓度的状态,所以BaP在房室的浓度大小排序也未考虑肺部.停止暴露后,第25h肺部BaP浓度急剧下降至0.456pmol/L,这与污染物吸入暴露的血液循环有关: BaP首先在肺部历经动、静脉血的交换,然后通过血液循环达到其他房室进行吸收、分配和代谢等动力学过程.其他房室BaP浓度在第26h也开始下降,35h之后下降至极小值.
如图4(a),BaP在房室中的浓度大小:脂肪>肾脏>皮肤>缓慢灌注组织>快速灌注组织>静脉血>肝脏.比较模型后验参数的中位值,BaP的脂肪-血分配系数最高(AT中值为17.73),这是脂肪中BaP浓度最高的主要原因.Péry等[37]的大鼠PBPK模型解释了BaP在大鼠脂肪和血液中的分配及扩散过程,其他研究也表明BaP具有高亲脂性,易在生物体脂肪中富集[38].虽然肝脏-血分配系数比缓慢灌注组织-血分配系数高2倍以上,但结果显示肝脏的BaP浓度比缓慢灌注组织中低得多,这是由于BaP主要在肝脏进行代谢.Crowell等[39]对小鼠、大鼠和女性的肝脏微粒体对BaP的体外代谢过程进行了实验,计算了MAX和M等代谢动力学参数,表明肝脏是BaP主要的代谢器官,其他大鼠动力学研究也证明了这个结论[36].针对其他的代谢器官,虽然Payan等[40]的大鼠[14C]-BaP暴露实验显示BaP在皮肤存在微弱的代谢和转化过程,但具体代谢转化机制尚未阐明.
2.2.2 3-OHBaP体内动力学分析 如图4(b),3- OHBaP在体内的浓度上升和下降过程都比BaP缓慢,停留时间较长,每个房室的3-OHBaP浓度均小于BaP浓度,这是由于BaP在体内的代谢过程复杂,3-OHBaP仅仅是BaP氧化产生的代谢物之一[6],在人体内还存在多种BaP代谢物.3-OHBaP在体内动力学的缓慢现象与生物监测中职业工人尿液3- OHBaP的延迟排泄结果相吻合[26].
3-OHBaP在各个房室中的浓度大小:肾脏>快速灌注组织>脂肪>肺>静脉血>缓慢灌注组织>肝脏>皮肤(图4b).本研究发现,与BaP的体内动力学不同, 3-OHBaP在肾脏的浓度最高.比较3-OHBaP尿液排泄和粪便排泄的后验参数分布,肾小球过滤率中位值为1.54,比胆汁排泄率和粪便排泄率中位值高1~2个数量级,这说明3-OHBaP的排泄过程中经尿液的排泄途径占主要,可能直接导致了肾脏中3-OHBaP的浓度最高.另一方面,虽然肝脏对BaP具有高度代谢作用[36,39],但模型模拟结果显示肝脏的3-OHBaP浓度处于较低的水平.本研究发现3-OHBaP肝脏组织-血分配系数的后验分布为0.34(0.11,0.69),相比较于其他组织-血分配系数低1个数量级,这可能是导致3-OHBaP在肝脏中浓度较低的原因.
2.3 尿液排泄与生物监测当量
随着检测技术不断提高,已有较多研究监测职业人群尿液中3-OHBaP浓度来评价接触BaP的情况,并使用尿液肌酐校正水平来进行表征.Lutier等[41]对6名冶金工人的尿液样本中3-OHBaP浓度进行了监测,研究表明尿液3-OHBaP浓度为0.05~ 0.33nmol/mol肌酐.相比较于冶金工人,常年接触烧烤的人群尿液3-OHBaP浓度更高,达到了0.98~ 2.67nmol/mol肌酐[10].经过对职业工人尿液中3- OHBaP与环境BaP浓度的关系进行定量分析,结果发现大体呈现线性相关性[34].综上,虽然有较多研究对职业工人尿液中3-OHBaP的浓度进行了监测,但仅仅是对剂量水平、排泄特征等进行定性分析,并未根据监测结果对人群接触BaP的内暴露健康风险进行定量估算.

图5 尿液中3-OHBaP浓度-时间曲线
本研究将BaP非致癌效应的参考浓度2.0× 10-6mg/m3作为安全基准值,以职业工人连续5d吸入暴露8h作为暴露场景,基于PBPK模型模拟一周内尿液中3-OHBaP的排泄浓度(图5).研究发现,尿液3-OHBaP峰值出现在当日停止暴露后的6~8h,具有一定的延迟排泄现象;在一周的暴露周期内,最后两天3-OHBaP尿液排泄浓度的峰值最高.Lutier等[41]的生物监测研究也表明3-OHBaP的尿液排泄具有延迟现象,采样应在轮班后第2d早上进行.在大鼠的BaP代谢动力学研究中发现3-OHBaP在肾脏有所累积,或许可以解释这种延迟排泄现象[42].依据Boogaard等[43]报道的甲苯BE值推导方法,将一周内尿液3-OHBaP的平均浓度0.405pmol/mol肌酐作为BaP的职业暴露非致癌效应BE值(图5虚线).若职业人群生物监测中3-OHBaP的尿液平均浓度高于该BE值时,则暴露人群可能存在BaP非致癌风险,但基于人体内部剂量的非致癌风险定量估算方法还需要进一步探索.
3 结论
3.1 基于贝叶斯的MCMC方法对BaP和3-OHBaP人体PBPK模型中的多参数进行了同步优化,两个数据集验证结果显示残差平方和降低了72%和94%,后验参数分布的置信区间相比先验参数分布有所减小.
3.2 对PBPK模型模拟的BaP和3-OHBaP静脉血浓度影响最大的是BaP快速灌注组织-血分配系数,超过了200%.其他组织-血分配系数的归一化灵敏度系数也处于较高水平.大部分代谢参数的灵敏度系数为20%~50%,但3-OHBaP转化分数对3- OHBaP静脉血浓度的影响较高,灵敏度系数高达100%.排泄系数对BaP和3-OHBaP静脉血浓度输出影响较低.
3.3 BaP在房室的浓度大小为:脂肪>肾脏>皮肤>缓慢灌注组织>快速灌注组织>静脉血>肝脏,脂肪中BaP浓度比其他组织器官高一倍以上.3-OHBaP在房室的浓度大小为:肾脏>快速灌注组织>脂肪>肺>静脉血>缓慢灌注组织>肝脏>皮肤,3-OHBaP在各个房室中浓度上升和下降过程都更缓慢,其在肾脏的浓度最高,在肝脏的浓度处于较低水平.
3.4 以BaP非致癌效应的参考浓度作为外暴露安全基准值,将一个周期内尿液3-OHBaP平均浓度作为生物监测终点,推导出BaP职业暴露BE值为0.405pmol/mol肌酐,在一个工作周期内的3-OHBaP尿液平均浓度高于该值则可能存在非致癌风险.
[1] Kim K H, Jahan S A, Kabir E, et al. A review of airborne polycyclic aromatic hydrocarbons (PAHs) and their human health effects [J]. Environment International, 2013,60:71–80.
[2] Dimitriou K, Kassomenos P. The influence of specific atmospheric circulation types on PM10-bound benzo(a)pyrene inhalation related lung cancer risk in Barcelona, Spain [J]. Environment International, 2018,112:107–114.
[3] 周 煜,沈 毅,王姝婷,等.杭州市居民谷物和烧烤油炸类食品多环芳烃暴露风险评估[J]. 预防医学, 2019,31(3):260-264,270.
Zhou Y, Shen Y, Wang S T, et al. Risk assessment of polycyclic aromatic hydrocarbons exposed from cereal, fried and grilled food in Hangzhou [J]. Preventive Medicine, 2019,31(3):260-264,270.
[4] 孟祥帅,陈鸿汉,郑从奇,等.焦化厂不同污染源作用下土壤PAHs污染特征[J]. 中国环境科学, 2020,40(11):4857-4864.
Meng X S, Chen H H, Zhen C Q, et al. Pollution characteristics of PAHs in soil at an abandoned coking plant affected by different sources [J]. China Environmental Science, 2020,40(11):4857-4864.
[5] 康 杰,胡 健,朱兆洲,等.太湖及周边河流表层沉积物中PAHs的分布、来源与风险评价[J]. 中国环境科学, 2017,37(3):1162-1170.
Kang J, Hu J, Zhu Z Z, et al. Distribution, source and risk assessment of PAHs in surface sediments from Taihu Lake and its surrounding rivers [J]. China Environmental Science, 2017,37(3):1162-1170.
[6] 刘晓晨.苯并[a]芘暴露生物标志物的研究[J]. 大连:大连医科大学, 2013.
Liu X C. Study on exposure biomakers of benzo(a)pyrene [D]. Dalian: Dalian Medical University, 2013.
[7] Richter B S, Dettbarn G, Jessel S, et al. Ultra-high sensitive analysis of 3-hydroxybenzo[a]pyrene in human urine using GC-APLI-MS [J]. Journal of Chromatography B, 2019,1118–1119:187–193.
[8] Zając J, Dziedzina S, Zając A, et al. Relationship between variants of detoxification genes and 3-hydroxybenzo[a]pyrene concentration in urine of coke plant workers [J]. Polycyclic Aromatic Compounds, 2020,40(1):1–12.
[9] Fernández S F, Pardo O, Hernández C S, et al. Children’s exposure to polycyclic aromatic hydrocarbons in the Valencian Region (Spain): Urinary levels, predictors of exposure and risk assessment [J]. Environment International, 2021,153:106535.
[10] Oliveira M, Capelas S, Delerue-Matos C, et al. Grill workers exposure to polycyclic aromatic hydrocarbons: Levels and excretion profiles of the urinary biomarkers [J]. International Journal of Environmental Research and Public Health, 2020,18(1):230.
[11] EPA, 2019. Guidelines for human exposure assessment [J]. Risk Assessment Forum U.S. Environmental Protection Agency: 223.EPA/ 100/B-19/001.
[12] 侯 荣,阿依博塔·吐尔逊别克,秦 宁,等.室内空气中苯并[a]芘的健康限值研究[J]. 中国环境科学, 2020,40(5):434–441.
Hou R, Ayibota T, Qin N, et al. Research on benzo[a]pyrene criteria in indoor air [J]. China Environmental Science, 2020,40(5):2287-2294.
[13] EPA, 2017. Toxicological review of benzo[a]pyrene [R]. Integrated Risk Information System National Center for Environmental Assessment Office of Research and Development U.S. Environmental Protection Agency. Washington, DC:EPA/635/R-17/003Fa.
[14] Louro H, Heinälä M, Bessems J, et al. Human biomonitoring in health risk assessment in Europe: Current practices and recommendations for the future [J]. International Journal of Hygiene and Environmental Health, 2019,222(5):727–737.
[15] 刘 远,王中钰,陈景文,等.基于PBPK模型评价三氯乙烯的职业暴露健康风险[J]. 生态毒理学报, 2019,14(4):83-91.
Liu Y, Wang Z Y, Chen J W, et al. Health risk assessment of occupational exposure to trichloroethylene based on PBPK model [J]. Asian Journal of Ecotoxicology, 2019,14(4):83-91.
[16] Zhang Y, Han X, Niu Z. Health risk assessment of haloacetonitriles in drinking water based on internal dose [J]. Environmental Pollution, 2018,236:899–906.
[17] Ortiz H R, Maître A, Barbeau D, et al. Use of physiologically-based pharmacokinetic modeling to simulate the profiles of 3- hydroxybenzo(a)pyrene in workers exposed to polycyclic aromatic hydrocarbons [J]. PLoS ONE, 2014,9(7):e102570.
[18] 茆诗松,汤银才.贝叶斯统计[M]. 2版.北京:中国统计出版社, 2012:237-241.
Mao S S, Tang Y C. The Bayesian statistics [M]. 2nd edition. Beijing: China Statistics Press, 2012:237-241.
[19] Chou W C, Lin Z. Bayesian evaluation of a physiologically based pharmacokinetic (PBPK) model for perfluorooctane sulfonate (PFOS) to characterize the interspecies uncertainty between mice, rats, monkeys, and humans: Development and performance verification [J]. Environment International, 2019,129:408–422.
[20] Ratier A, Lopes C, Labadie P, et al. A Bayesian framework for estimating parameters of a generic toxicokinetic model for the bioaccumulation of organic chemicals by benthic invertebrates: Proof of concept with PCB153 and two freshwater species [J]. Ecotoxicology and Environmental Safety, 2019,180:33–42.
[21] 宋 韬.基于PBPK模型的多环芳烃暴露人群剂量与健康风险研究[D]. 广州:暨南大学, 2018.
Song T. Populational Dose and health risk assessment on polycyclic aromatic hydrocarbons based on PBPK model [D]. Guangzhou: Jinan University, 2018.
[22] Brown R P, Delp M D, Lindstedt S L, et al. Physiological parameter values for physiologically based pharmacokinetic models [J]. Toxicology and Industrial Health, 1997,13(4):407–484.
[23] Smith J N, Mehinagic D, Nag S, et al. In vitro metabolism of benzo[a]pyrene-7,8-dihydrodiol and dibenzo[def,p]chrysene-11,12 diol in rodent and human hepatic microsomes [J]. Toxicology Letters, 2017,269:23–32.
[24] Deng L, Liu H, Deng Q. Physiologically-based pharmacokinetic modeling of benzo(a)pyrene and the metabolite in humans of different ages [J]. International Journal of Environmental Health Research, 2019,31(2):202–214.
[25] Gelman D, Koch C P, Kosloff R. Dissipative quantum dynamics with the surrogate Hamiltonian approach. A comparison between spin and harmonic baths [J]. The Journal of Chemical Physics, 2004,121(2): 661–671.
[26] Barbeau D, Lutier S, Bonneterre V, et al. Occupational exposure to polycyclic aromatic hydrocarbons: relations between atmospheric mixtures, urinary metabolites and sampling times [J]. International Archives of Occupational and Environmental Health, 2015,88(8): 1119–1129.
[27] Lin Z, Fisher J W, Ross M K, et al. A physiologically based pharmacokinetic model for atrazine and its main metabolites in the adult male C57BL/6mouse [J]. Toxicology and Applied Pharmacology, 2011,251(1):16–31.
[28] Pletz J, Blakeman S, Paini A, et al. Physiologically based kinetic (PBK) modelling and human biomonitoring data for mixture risk assessment [J]. Environment International, 2020,143:105978.
[29] Apel P, Rousselle C, Lange R, et al. Human biomonitoring initiative (HBM4EU) - Strategy to derive human biomonitoring guidance values (HBM-GVs) for health risk assessment [J]. International Journal of Hygiene and Environmental Health, 2020,230:113622.
[30] 刘 柳,张 岚,李 琳,等.健康风险评估研究进展[J]. 首都公共卫生, 2013,(6):264–268.
LIU L, ZHANG L, LI L, et al. Research progress on health risk assessment [J]. Capital Journal of Public Health, 2013,(6):264–268.
[31] Angerer J, Aylward L L, Hays S M, et al. Human biomonitoring assessment values: Approaches and data requirements [J]. International Journal of Hygiene and Environmental Health, 2011,214 (5):348–360.
[32] Hays S M, Becker R A, Leung H W, et al. Biomonitoring equivalents: A screening approach for interpreting biomonitoring results from a public health risk perspective [J]. Regulatory Toxicology and Pharmacology, 2007,47(1):96–109.
[33] Lafontaine M. Polycyclic aromatic hydrocarbon exposure in an artificial shooting target factory: Assessment of 1-hydroxypyrene urinary excretion as a biological indicator of exposure [J]. The Annals of Occupational Hygiene, 2000,44(2):89–100.
[34] Gendre C, Lafontaine M, Delsaut P, et al. Exposure to polycyclic aromatic hydrocarbons and excretion of urinary 3-hydroxybenzo[a] pyrene: assessment of an appropriate sampling time [J]. Polycyclic Aromatic Compounds, 2004,24(4/5):433–439.
[35] Kondo K, Wakasone Y, Iijima K, et al. Inverse analysis to estimate site-specific parameters of a mathematical model for simulating pesticide dissipations in paddy test systems [J]. Pest Management Science, 2019,75(6):1594–1605.
[36] Heredia O R, Bouchard M. Understanding the linked kinetics of benzo(a)pyrene and 3-hydroxybenzo(a)pyrene biomarker of exposure using physiologically-based pharmacokinetic modelling in rats [J]. Journal of Pharmacokinetics and Pharmacodynamics, 2013,40(6):669– 682.
[37] Péry A R R, Brochot C, Desmots S, et al. Predicting in vivo gene expression in macrophages after exposure to benzo(a)pyrene based on in vitro assays and toxicokinetic/toxicodynamic models [J]. Toxicology Letters, 2011,201(1):8–14.
[38] 张昭勇,欧莉莉,罗嘉莹,等.空气中多环芳烃在人体中的代谢反应及其对吸入性过敏性疾病的影响机制[J]. 环境卫生学杂志, 2017, 1(v.7):75–80.
Zhang Z Y, Ou L L, Luo J Y, et al. Metabolic Response in Human Body to Air Polycyclic Aromatic Hydrocarbons and their Effects on Inhalant Allergic Diseases [J]. Journal of Environmental Hygiene, 2017,1(v.7):75–80.
[39] Crowell S R, Hanson-Drury S, Williams D E, et al. In vitro metabolism of benzo[a]pyrene and dibenzo[def,p]chrysene in rodent and human hepatic microsomes [J]. Toxicology Letters, 2014,228(1): 48–55.
[40] Payan J-P, Lafontaine M, Simon P, et al. 3-Hydroxybenzo(a)pyrene as a biomarker of dermal exposure to benzo(a)pyrene [J]. Archives of Toxicology, 2009,83(9):873–883.
[41] Lutier S, Maître A, Bonneterre V, et al. Urinary elimination kinetics of 3-hydroxybenzo(a)pyrene and 1-hydroxypyrene of workers in a prebake aluminum electrode production plant: Evaluation of diuresis correction methods for routine biological monitoring [J]. Environmental Research, 2016,147:469–479.
[42] Marie C, Bouchard M, Heredia O R, et al. A toxicokinetic study to elucidate 3-hydroxybenzo(a)pyrene atypical urinary excretion profile following intravenous injection of benzo(a)pyrene in rats [J]. Journal of Applied Toxicology, 2010,30:402–410.
[43] Boogaard P J, Hays S M, Aylward L L. Human biomonitoring as a pragmatic tool to support health risk management of chemicals – Examples under the EU REACH programme [J]. Regulatory Toxicology and Pharmacology, 2011,59(1):125–132.
Optimization of benzo (α) pyrene PBPK model based on bayes and its application in health risk assessment.
MENG Xiang-hui1,2, WANG Hong-yang2*, SUN Yu-wei2, ZHANG Ming-hui2, ZHU Guang-can1,3*, SHEN Ya-qin2, LIU Hui-fang2
(1.Southeast University School of Energy and Environment, Nanjing 210096, China;2.State Key Laboratory of Environment Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;3.Key Laboratory of Environmental Medical Engineering, Ministry of Education, Southeast University, Nanjing 210096, China)., 2022,42(5):2370~2378
The physiologically based pharmacokinetic(PBPK) model was used to predict the human internal dose of benzo(α)pyrene(BaP) exposure. The parameters of the model were optimized based on bayes statistics and Markov Chain Monte Carlo simulation (MCMC), and the optimized model was adopted to derive the reference value regarding the internal dose of BaP. It was found that the accuracy of the model was significantly improved after calibrating the posterior parameters by Monte Carlo simulation, and thevalidation results of two datasets showed that the sums of squared residuals were reduced by 72% and 94%. The PBPK model was based on the pharmacokinetic of BaP and its metabolite 3-hydroxybenzo(α)pyrene(3-OHBaP). The internal concentration distribution of BaP followed the order of fat>kidney>skin>slowly perfused tissue>richly perfused tissue>venous blood>liver, while that of 3-OHBaP was in the order of kidney>richly perfused tissue>fat>lung >venous blood >slowly perfused tissue> liver>skin. Besides, the sensitivity analysis indicated that the rich perfused tissue-blood distribution coefficients showed the strongest influence on the model output, which sensitivity coefficient exceeded 200%. While the coefficients related to excretion showed the weakest influence, and only sensitivity coefficient of glomerular filtration rate KBRexceeded 1%. According to the reference concentration 2.0×10-6mg/m3recommended by U.S. Environmental Protection Agency, the biomonitoring equivalent of BaP was derived based on the optimized PBPK model. The results showed that the reference value for the occupational populations was 0.405pmol/mol creatinine (i.e., the mean concentration of 3-OHBaP in urine), which lays a foundation for the quantitative health risk assessment based on the human internal dose.
benzo(α)pyrene;bayes statistics;Markov Chain Monte Carlo(MCMC);physiologically based pharmacokinetic (PBPK) model;3-OHBaP;biomonitoring equivalents
X592
A
1000-6923(2022)05-2370-09
孟祥晖(1997-),男,四川绵阳人,硕士研究生,研究方向为PBPK模型和环境人体健康.发表论文1篇.
2021-09-26
国家重点研发计划项目(2021YFE0106600)
* 责任作者, 高级工程师, wanghongyang_why@126.com; 教授, gc-zhu @seu.edu.cn

