镍的环境生物地球化学与毒性效应研究进展
何 珊,郭 渊,王 琛,吴丰昌,何 佳
镍的环境生物地球化学与毒性效应研究进展
何 珊1,2,郭 渊3,王 琛3,吴丰昌3,何 佳1*
(1.北京师范大学水科学研究院,城市水循环与海绵城市技术北京市重点实验室,北京 100875;2.吉林大学,地球探测科学与技术学院,吉林 长春 130026;3.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012)
目前镍的毒性评价大多基于单一指标和室内控制实验研究,如何综合考虑镍在水环境中的形态及天然复合水化学条件的影响,进而准确预测水体中镍的生物毒性是水质基准及生态风险评估领域的难题.本研究结合国内外最新研究进展,对镍的来源、形态、生物有效性、毒性机理、水质基准和标准及污水处理工艺等进行归纳总结.重点围绕镍的环境行为和毒性效应展开,剖析了水化学因子对镍生物有效性的影响,概述了镍对不同营养级水生生物的毒性表现,总结出镍对淡水水生生物的六大毒性作用机理,展望镍的生物有效性对毒性效应的影响趋势,对我国镍的淡水水生生物水质基准的制定具有重要意义.
镍;环境行为;毒性机理;生物有效性;水质基准
在地球元素总含量排名中,镍(Ni)处于第六位[1],是元素周期表第28号元素,位于第四周期第Ⅷ副族,在戈尔德施密特元素地球化学分类中属亲铁元素,集中分布在地核.Ni的化合物主要有NiSO4、NiCO3、NiCl2和Ni(NO3)2,它们多用于电镀行业和催化剂生产中.Ni也是水、土壤、空气和生物体内的天然元素,在各个圈层地球化学循环中发挥重要作用.
Ni作为典型重金属是一类特殊的具有高度生态意义的水资源污染物,由于它的持久性,Ni可以积聚在水库,进入食物链,对水生生物和人类健康构成潜在威胁[2-3].在淡水生态系统中,Ni的毒性效应包括损害气体交换、抑制生物调控、促进氧化应激反应等[4-5].
许多国家都发布各项污染物在水环境中的基准值以保护本土水生生物不受危害[6-7].水质基准强调的是“以人(生物)为本”及人与自然和谐共处的理念,是制(修)定水质标准、评价水质和进行水质管理的科学依据与理论基础[8].我国关于Ni水质基准的研究相对滞后,地质、气候、生态环境特征、产业发展模式、居民饮食习惯等与国外相比也有显著差异,亟需制定适合本国国情的Ni水质基准[9].
本研究对于Ni在水环境中的全生命周期进行综述,主要研究Ni的来源、水环境形态、迁移转化、生物有效性、毒性作用机理及治理工艺等内容,为科学合理制定我国Ni淡水水生生物水质基准提供科学基础和依据.
1 Ni的来源
1.1 天然来源
Ni在自然界广泛分布,其在地壳表面的含量为80mg/kg[10].在复杂的地球化学循环模式下,Ni在水环境普遍存在.水环境中它的天然来源可包括:大气颗粒物沉降、岩石风化及岩浆活动等.Ni存在于50余种矿物中,存在形态以NiS为主,也以类质同象的形态存在于磁黄铁矿.每年全世界Ni的岩石风化量约320000t,河流输送量约19000t[11],因此Ni具有在土壤和水环境中富集的地质潜力.在瑞典一个研究案例中,某地下水厂Ni浓度升高的原因很大程度上与硫化冰川黏土的地质作用有关[12].此外,地壳运动导致的火山爆发会向地表输送大量熔岩、火山灰、气体球状物等,在循环背景下,这一活动也是水中Ni的另一天然来源.近期研究表明,岩浆活动喷出的富Ni气溶胶粒子甚至是5.4亿年前二叠纪末物种灭绝的重要因素[13].
大气中Ni污染物主要以颗粒态形式存在,可通过干、湿沉降进入土壤和水环境;进入土壤中的Ni2+被土壤有机和无机复合体吸附于土壤表面,由于地表径流,以NiCl2、Ni(NO3)2为主的可溶态Ni随水迁移,进入水环境;当Ni进入水体后,常以水合离子、可溶性有机络离子形式溶解于水中,在沉淀、共沉淀作用下,水中Ni向底质迁移,富集于底质沉积物[14-15];由于含Ni化合物(除Ni(CO)4以外)的低蒸气压,土壤和水中的Ni很难通过挥发重新进入大气.[10]
基于不同的地质条件背景,自然水体中Ni浓度存在显著差异,天然小溪、河流和湖泊Ni浓度为0.2~ 10μg/L,靠近Ni矿和冶炼厂的浓度能达到6.4mg/L,海水中Ni的浓度大概是1.5μg/L,其中50%是以自由离子态形式存在[16].
1.2 人为来源
Ni的人为来源以工业生产、工业产品的使用、含Ni废物处理等为主.以电镀行业为例,作为含Ni废水的重要来源,我国目前约有1万多家电镀厂,废水排放量约40亿m3/a.
Ni储量和工业应用是导致不同地区人为来源Ni污染程度差异的重要因素.美国地质调查局公布,2020年全球探明Ni基础储量约9400万t,印度尼西亚以2100万t Ni储量(占全球Ni储量比例22.34%)高居世界第一,第二到第六位分别是:澳大利亚、巴西、俄罗斯、古巴、菲律宾,我国以280万t储量与加拿大并列第七. 2020年,在美国,初级Ni主要用途依然是不锈钢和合金,占国内消费的85%以上.由于全球Covid-19的影响,2020年美国国内报告的初级Ni消费量约下降20%[17].有关部门估算,现在全球每年向自然环境排放的有毒重金属污染物达数百万吨,其中Ni排放量大约为38.1万t,并仍然呈逐年上升趋势[18].目前,亚洲已成为全球最大的自然资源使用洲,全球Ni物质流分析表明,随着亚洲、非洲工业化发展、人口和经济增长,可能会导致未来Ni需求量不断增加[19],这也会带来更多与Ni有关的环境问题.直接排入水体的Ni、通过地表径流由土壤输入的Ni和大气颗粒物沉降的Ni,最终引起水中Ni含量剧增.Ni在环境的主要输入输出途径见图1.
特别地,在水环境中人为带来的Ni输入可能会产生“蝴蝶效应”:上世纪,工业迅速发展的时期,海洋和内陆沉积物Ni浓度显著增加[20-21],而远在主要人为污染源几千公里以外的偏远地区,比如挪威北极地区和芬兰拉普兰克地区,也能观察到Ni浓度的增加[22];在我国长江流域,重庆市、武汉地区和长三角地区大量溶解性Ni的来源分别是攀枝花矿区、南岭矿区和铜陵矿区的人为活动[23].

图1 Ni在环境中的主要输入输出途径
2 Ni的形态及环境行为
2.1 Ni在水环境中的形态
Ni通常以溶解态(存在于水相中)、颗粒态(存在于悬浮相的悬浮态和沉积物中的沉积态)的形式存在于水环境[24].好氧条件下,Ni主要以水合离子态存在,此时,Ni的水合离子态受铁、锰含水氧化物控制.在较高pH值条件下,由于Ni2+与带负电荷氧化物表面静电吸引的增加,Ni更倾向于吸附在铁锰氢氧化物上;较低pH值条件下,Ni2+和H+之间的竞争导致Ni从含氧化物中解离.缺氧或厌氧条件下,硫化物会通过形成难溶的Ni-S控制Ni的形态.湖泊中,Ni主要以离子态和与有机质结合态存在.河流中,Ni吸附于颗粒物或与有机物结合,随颗粒物或有机物迁移[25].由于Ni稳定的电子构型,Ni形成有机配合物的反应非常慢.Ni首次进入水生态系统时,可能会在很长一段时间内保持其原有的形态,从而打乱系统中原有的Ni分布.这一结果可能造成毒性最强的Ni2+长时间以溶解态存在于水环境,对水生生物产生威胁[26].
2.2 Ni在沉积物中的形态
沉积物中Ni的形态主要为残渣态、可还原态、可氧化态和可交换态[27].沉积物中Ni的分布具有明显的空间和环境效应.例如,宝乡河表层沉积物在上游沉积物中,Ni主要存在于残渣态(84%),可还原态(8%)、可氧化态(7%),可交换态(1%)的含量较低[28];巴厘贝诺瓦湾沉积物中,与碳酸盐相(可交换态)结合的Ni占了总Ni的22.3% ~ 42.3%,与铁/锰相(可还原态)结合的Ni占总的21.8% ~ 34.7%,与有机相(可氧化态)结合的Ni占总的8.2% ~ 29.7%,与矿物相相关(残渣态)结合的Ni占总的5% ~ 36.8%[29].
2.3 Ni的环境行为
水中可溶性Ni2+能与水结合形成水合离子Ni[(H2O)6]2+,也能与氨基酸、胱氨酸、富里酸等结合形成可溶性有机络离子,它们都可随水迁移.由于吸附、沉淀作用,水环境的Ni向沉积物迁移,同时,沉积物Ni2+也会释放到水环境.水体的Ni大部分富集在沉积物,沉积物含Ni量约18×10-6~ 47×10-6,为水中含Ni量的38000 ~ 92000倍.
Ni的存在形式受环境条件的影响,Ni不会永久附着在沉积物上或存在于水环境中[30].外界条件(如pH值、硬度、氧化还原电位、DOC等)的改变可能使Ni形态发生变化,从而导致水环境中Ni分布的改变[31-32].
pH值是影响水环境Ni行为的重要因素之一,会直接影响Ni、Fe、Mn等重金属的溶解度及其在固液相的分配[33].当人类活动排入大量酸性废水或碱性废水时,水的pH值急剧变化,可能造成水环境颗粒态、沉积物可交换态Ni2+的解离或吸附沉积[34].
硬度也会影响Ni在水中的分布.水中的悬浮颗粒和沉积物的粘土矿物大多带有负电荷,为保证电中性必然会从环境介质吸附等量的阳离子,悬浮颗粒和粘土沉积物对阳离子的吸附交换作用,是水环境保持重金属痕量浓度的主要原因.当水环境硬度改变时,吸附于沉积物黏土矿物上的可交换态Ni,会与Ca2+、Mg2+等发生交换作用[35].
重金属-无机矿物质是控制水环境重金属形态的另一项重要机制[36].以Ni的可还原态为例,Fe/Mn氧化物比表面积大,具有多微孔结构且富含结合电位,表现出对Ni较强的专属吸附作用.因此,当水环境氧化还原电位降低或者氧分压减少时,Fe/Mn氧化物发生还原反应,导致吸附于Fe/Mn氧化物上的Ni被释放[37].
研究表明,有机物中的腐殖质,包括腐殖酸(HA)和富里酸(FA),对Ni2+在水环境中的形态分布与迁移转化起重要作用[38].当有机物主要以溶解态形式存在时,因其可与重金属络合而阻止重金属在固相表面的吸附,或与重金属竞争固相表面的吸附点位,从而增加Ni及其化合物的溶解度.相反,固相中的有机物对Ni的络合吸附作用则会降低Ni的迁移性.
此外,Ni与DOC的结合基于DOC的聚电解质效应:当阳离子与聚阴离子的酸性官能团发生反应时,化学自由能因所有邻近长程库仑引力而增强.pH值会影响DOC表面官能团质子化过程:随着pH值的增加,HA结构内电荷密度增加,HA开始分解,HA分子量降低这一过程通常会在HA分子中打开新的结合位点,因此较高pH值条件下,这种聚电解质效应可以大大加强金属离子与多阴离子的结合,从而影响Ni在环境介质上的吸附、解吸.金属(M)和官能团(L)反应(反应式1)的自由能变化(Δ)是化学自由能变化(Δchem)和库仑自由能变化(Δcoul)的总和(反应式2).Δchem变化受反应官能团本身反应的影响,Δcoul变化受金属M与所有聚阴离子的静电相互作用的影响.由此,Ni-DOC配合物的结合能分为两部分:(1)化学结合能;(2)库伦结合能.由于Ca2+、Mg2+在Ni与DOC结合过程中会竞争特定结合位点,因此Ca2+、Mg2+过量会导致DOC多阴离子的扩散双电子层中Ca2+、Mg2+大量存在,从而通过屏蔽DOC多阴离子上的电荷,显著降低Ni-DOC的总结合能[39],进而影响水环境Ni形态的变化.
D=DDChem+Dcoul(2)
3 Ni的毒性效应及机理
3.1 水生生物毒性
20世纪初,Ni被认为无毒,随后越来越多的证据推翻了这一观点.Ni的毒性被忽视的原因主要是其毒性被其他金属的毒性所掩盖,尤其是在受采矿、电镀和不锈钢生产污染的水中,研究表明Ni慢性毒性暴露的浓度甚至比急性毒性时低2个数量级以上,此时就会抑制无脊椎动物的生长或繁殖[40].国际癌症研究机构(IARC)已将Ni化合物归为一类致癌物,将Ni和Ni合金归入为2B类致癌物清单中.
Ni对水生生物的毒性主要表现为:
高浓度Ni会干扰水生植物的生命过程,进而可能引起污染水域水生植物群落的物种结构变化:0.25mg/L Ni2+浓度下培养浮萍、浮叶眼子菜、伊乐藻、金鱼藻等水生植物,在第5d这些植物的潜在光合速率均降低了1.3~2.2倍[41].紫萍和浮萍暴露于40μmol/L的NiCl2溶液,第4d观察到新生的紫萍、浮萍颜色出现萎黄,相比于对照组同时期新生的叶片,暴露于Ni溶液的浮萍体型更小;第7d,紫萍和浮萍叶片数量明显减少[42].
浮游动物在Ni暴露实验中的毒性表现有繁殖率下降、后代死亡率增加等:21d慢性Ni暴露实验下,蚤状溞在1.8和18μg/L浓度组中均出现不同程度的繁殖抑制,相比于对照试验组,产仔率分别下降了21%和27%.Ni对大型溞也有明显的繁殖和生长抑制作用:0.16mg/L Ni2+浓度暴露中对大型溞进行世代培养,其平均寿命和体长随世代增加而显著降低[43].
高浓度Ni也会抑制底栖动物的生长发育,如:14d慢性毒性试验中,与暴露于低浓度(0, 10μg/ L)Ni溶液相比,高浓度(250μg/L)暴露下约有70%静水椎实螺出现了明显的生长发育抑制现象[44].
鱼类的生理功能也会受Ni暴露的影响,毒性主要表现在:生长发育抑制(骨骼畸形)、器官衰竭、癌症发生率增加等.有研究表明胡子鲶在3mg/L Ni溶液暴露下表现出适应性反应,暴露48h后可发生脊柱卷曲和纵向运动等生理适应特征[45].鲤鱼暴露于高浓度(1.25mmol/L)Ni溶液48h后,出现鳃小片呼吸上皮细胞坏死、脱落,肝血窦淤血,肝细胞核固缩等鳃和肝脏的组织病理变化;中低浓度(0.72~ 1.09mmol/L)时,出现鳃小片呼吸上皮水肿浮离,细胞增生,血窦充血,肝细胞胞浆空泡化等现象[46].在10, 25, 50和100mg/L Ni2+浓度下暴露96h导致鲫鱼体重下降和运动活动下降(1%~25%),与对照组相比,Ni暴露显著降低了淋巴细胞数量,诱导了鱼肝脏的氧化应激[47].此外,鱼类Ni中毒症状还包括浮出水面,嘴巴和嘴盖快速移动,死亡前抽搐和失去平衡等[48].
3.2 Ni的生物有效性
金属及其化合物可能会对环境中的生物生存构成威胁,由于地球化学过程,它们自然存在于地表水中,一些金属甚至是生物体的基本元素.先前研究表明,金属对生物体的有效性和毒性很大程度上取决于水质条件,且水中的金属毒性与总金属浓度并不存在显著相关性,实际上环境的金属总量只有一部分可以被生物体吸收,并随后诱发不利影响[49].金属的生物有效性不仅取决于该金属在环境的总(或溶解)浓度,也取决于物理化学和生物因素之间的复杂相互作用.生物有效性通常是引发机体反应的限制因素,它会受到暴露介质的酸碱度、竞争位点化学物质(如钙、钠或镁)的存在、生物体特性(如结合位点的数量和类型)的影响[50].从各途径进入水环境的过量Ni会对水生生物产生不利影响,又由于各项水质参数(pH值、硬度、氧化还原电位、DOC等)影响了Ni的环境行为,因此Ni的毒性需基于生物有效性来评估.
Ni在水环境的形态受水质因子的影响,水质因子改变时,Ni的吸附、解吸、络合等环境行为均会对Ni的生物有效性产生限制,不同水质因子下Ni对水生生物的毒性也具有显著差异.然而我国水域面积广阔,水质因子复杂多变,如,我国典型流域地表水硬度范围约52.5~218.39mg/L,pH值全年平均值范围约7.01~8.49;DOC范围约0.92~19.26mg/L[51],通过毒性试验的手段对每个特定区域水质因子进行测定,再评估Ni的生物有效性势必消耗大量人力物力和财力也无法完全覆盖水质情况的变化.因此生物有效性的定义决定了单纯物理化学或生物评价方法都不能准确评价重金属的生物有效性,评价结果误差较大.
随着计算机和分析化学的发展,20世纪80年代开始出现模型预测金属毒性:如:自由离子活度模型(FIAM)、鱼鳃电位交互作用模型(GSIM)、生物配体模型(BLM)、多元线性回归模型(MLR).其中,预测Ni毒性的BLM已在欧洲天然水域开发并得到验证.已有研究表明,Ni对水生生物慢性毒性的BLM可以推广到许多其他物种,包括藻类、鱼类等[52].经过近几十年BLM的科学发展,这些模型目前被认为适用于淡水水体中金属的监管风险评估[53].欧盟水框架指令中也将BLM用于Ni环境质量标准的推导.日本也开始从水化学角度验证该模型[54].
目前,国内有关Ni毒性的研究相对其他典型重金属毒性研究较少.且多数毒性实验仅研究单一水质因子对Ni毒性效应的影响,依靠单一实验条件、测试物种的选择以及暴露溶液的配置而获得的毒性试验结果无法很好地解释天然水中Ni对水生生物毒性的作用机理,对于实际水体金属毒性的推导可参考性较小.应尽快将Ni对水生生物毒性的模型应用到实际水体中,以便合理有效保护全国各地的水环境.
3.3 Ni的毒性作用机理
Ni的毒性很大程度上同它进入细胞的方式有关,其化合物随毒性的升高分为以下三类:水溶性Ni、颗粒态Ni、脂溶性Ni(CO)4.尽管Ni的毒性随其化合物水溶性降低而增加,但是细胞内最终形成的游离Ni2+才是真正的毒源.这种表面矛盾可以解释为细胞对Ni的吸收和排出的结果[40].
Ni对淡水水生生物的潜在毒性作用机理主要包括如图2所示的六大反应.
3.3.1 Ca2+稳态的失调 静水锥实螺()在Ni 14d慢性暴露中,幼螺的生长相对于对照组减少了48%,Ca2+稳态显著受到Ni的影响.研究表明钙的吸收途径可能被Ni替代,进而影响部分生物体内Ca2+的平衡[55].因此,Ni暴露会导致Ca2+稳态的失调,进而降低Ca2+可用性,最终导致水生生物骨骼、外壳生长受损[56].
3.3.2 Mg2+稳态的失调和Fe2+/Fe3+动态平衡的失配 Mg2+和Fe2+/Fe3+在生物系统中有多种作用,主要包括稳定核酸和蛋白质功能、参与ATP的合成以及维系水生植物光合作用[57].Ni与多种Mg2+转运体之间的相互作用在细菌中得到广泛证明[58-59].研究表明尼罗罗非鱼在3d短期暴露(30μmol/L)和30d长期暴露(10μmol/L)于Ni2+溶液中时,均出现ATP酶活性下降的现象[60].黄鲈12d长期暴露(68.5±6.8)μg/L Ni条件下,基于铁的多个基因(转铁蛋白受体,转铁蛋白)表达发生显著性改变,这一变化表明Ni诱导的铁缺乏会产生代偿反应[61].介于Mg2+和Fe2+/Fe3+在生物体内的普遍性和功能性,Ni可以通过对生物体内Mg2+稳态和Fe2+/Fe3+动态平衡造成影响从而影响水生生物的正常生理运转.

图2 Ni对淡水水生生物的潜在毒性作用机理
3.3.3 活性氧(ROS)造成氧化损伤 当ROS产生量超过体内自身消除量时,可导致ROS增加的状态称为“氧化应激”[62].Ni积累到一定程度可导致金鱼肾脏超氧化物歧化酶、谷胱甘肽过氧化物酶、谷胱甘肽还原酶和葡萄糖-6-磷酸脱氢酶等氧化应激标志物活性的抑制,此时肾脏发生氧化应激[63].Ni化合物的毒性和致癌作用正是由于Ni介导的大分子氧化损伤和/或抑制细胞抗氧化防御.由此,Ni2+会增加ROS的产生,导致细胞DNA损伤、蛋白质损伤和脂质过氧化,同时触发氧化应激防御系统.
3.3.4 激活T细胞 作为半抗原的Ni2+通过树突细胞被运送到引流淋巴结,导致T细胞原位的激活和增殖[64].Ni对水生生物存在潜在过敏反应,研究发现虹鳟鱼锶的过敏特征有:鳃的次生片层水肿和氧气扩散距离增加,主要表现在相应的氧提取效率和动脉氧含量降低,动脉CO2增加,血液pH值降低以及包括通气率、通气量和红细胞压积的增加[48].
3.3.5 酶活性影响 Ni对于水生生物体内的酶有3种毒性机制[4]:①Ni取代金属蛋白的固有金属; ②Ni与非金属酶的催化残基结合;③Ni结合在酶的外催化位点进而抑制酶的作用.此外,Ni对不同DNA聚合酶的影响存在差异:Ni是大肠杆菌DNA聚合酶I中常用金属的替代品,是噬菌体T4酶的弱抑制剂,是噬菌体T7酶的更有效抑制剂.
与淡水环境相比,Ni对海水水生生物的毒性研究较少.由于海水与淡水的水化学条件差异性显著,使Ni的生物有效性也有明显差别,如:海水DOC浓度低于淡水,海水中高盐含量意味着有更多离子竞争DOC结合位点,这有效降低了Ni与DOC的结合能力.通常情况下,海水中Ni产生毒性效应的浓度要高于淡水.Ni对海水水生生物致毒机制主要包括三方面:离子调节损伤、抑制呼吸作用、促进氧化应激,这与淡水中的机制相似[65].如:发育的海胆胚胎中,Ni抑制Ca2+内流,这可能是Ni暴露条件下海胆胚胎发育骨骼畸形的原因[66];海水Ni的暴露浓度一般不足以影响生物的呼吸功能,尤其是考虑到海水Ni的生物有效性存在降低的可能性,因此这一毒性机制对海洋生物致毒的可能性较低[67];研究表明,暴露于3mg/L Ni浓度的青蟹,ROS的解毒能力受损,表现出氧化应激效应[67].
此外,纳米材料正以指数增长的速度应用于工业,纳米材料对生态的潜在危害也越来越受到人们重视.Ni纳米颗粒对水生生物的毒性作用机理一般为:Ni纳米颗粒吸附/粘附在生物体外表面,并与细胞膜、细胞壁和组织/器官表面发生化学反应,可能导致细胞功能受损和死亡.Ni纳米颗粒也会诱导生物体内部或外部ROS的产生释放,引起氧化应激.此外,Ni纳米颗粒可以部分溶解在水或生物体内,释放Ni2+,可导致与溶解Ni相关的离子调节受损、抑制呼吸、产生氧化应激效应等[68].
4 Ni的水质基准和标准
水质基准和标准是规范进行水环境管理的重要依据之一,水环境的安全与人体健康和水生生物的安全息息相关.水质基准的建立是基于合理可信且保证足够数量和质量的生态毒理学数据,并通过模型计算获得最终值.由于物种多样性存在明显的地理差异,制定水质基准和标准需要从不同营养级考虑.目前基准计算方法主要为评价因子法、物种敏感度分布曲线法、生态毒理模型法、毒性百分数排序法,各方法定义及优缺点见表1.

表1 基准推导方法及优缺点分析[69]
另外在推导Ni水质基准的过程中需充分考虑区域环境差异特征对水质基准的影响机理.区域要素主要包括理化要素特征(如pH值、DOC及硬度等)、气候条件、生物区系和污染程度等,这些因素通过影响Ni在水环境中的环境行为,进而影响Ni对水生生物的毒性效应,从而对水基准值产生影响.应建立由多参数构成的毒性校正函数来对基准值进行校正,建立具有区域特征的水质基准.表2是国外已发布的淡水水生生物Ni水质基准,主要考虑了理化要素硬度对Ni毒性作用的影响.
我国尚未发布关于Ni的水质基准,但国内已有研究基于我国本土水生生物毒性值推导了Ni的水质基准值(表3).
前文已叙述水化学条件影响Ni的生物有效性,并有大量研究证实硬度与Ni的水生生物毒性之间存在显著相关性,我国目前Ni水质基准研究并未讨论水化学条件对其产生的影响,未来研究中有待完善.
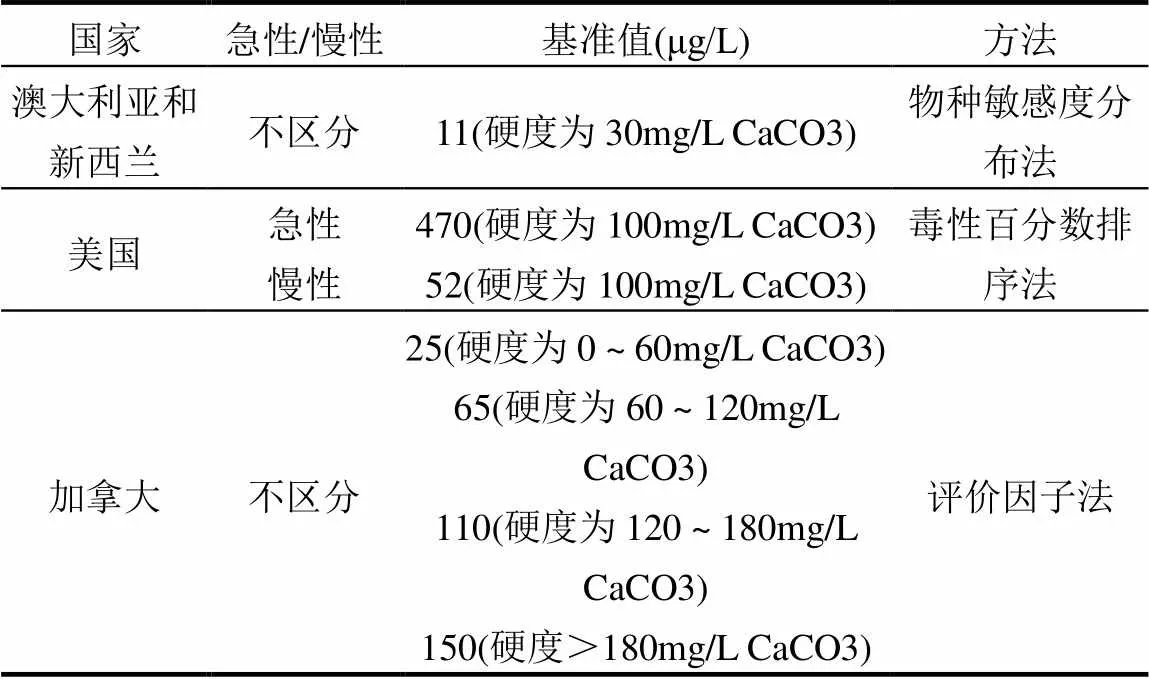
表2 国外已发布的淡水水生生物Ni水质基准

表3 我国Ni的水质基准研究
我国现行各类水环境质量标准,如《地表水环境质量标准》(GB 3838 - 2002)[72]、《渔业水质标准》(GB 11607-89)[73]和《生活饮用水卫生标准》(GB 5749-2006)[74]中,Ni最高允许标准值分别为20, 50和20 μg/L.标准中存在同一标准值保护多项内容的情况,如:《地表水环境质量标准》[72]中规定达到Ⅱ类和Ⅲ类标准的水体既可用作管理集中式生活饮用水源地的一级和二级保护区,也可用于保护珍稀水生生物栖息地和渔业水域,同时这一标准兼顾保护人体健康不受侵害和保护水生生物安全的双重需要.对比表2、表3,我国如果仅使用目前Ni标准值,对于特定区域水化学条件的水体,统一的水质基准与标准可能过于苛刻或者无法起到保护作用,对生态安全和环境质量评价构成潜在威胁和评价偏差.
5 Ni污水处理工艺
为了维护Ni在水体中不超过水环境质量标准和基准的阈值,含Ni污水处理处置是一项不可忽视的重要工作.目前常规含Ni污水处理工艺以沉淀法[75]、膜分离法[76-77]、离子交换法[78]、吸附法[79]等技术为主,部分工艺还可以对Ni进行回收再利用,实现Ni的全生命周期管理模式[80].
5.1 沉淀法
沉淀法常用于处理化学镀Ni废水[81].化学镀Ni废水由有机螯合剂组成,主要成分包含柠檬酸钠和复合Ni2+等,其中柠檬酸根离子具有较强的抗氧化性,单纯氧化还原工艺处理后并不能将其有效去除,需要增加沉淀工艺进一步处理.
多数沉淀工艺处理Ni废水需要先进行芬顿(Fenton)、电化学氧化等高级氧化法,将络合态的Ni2+转化成游离态,再通过调节pH值、臭氧氧化、投加次氯酸钙等方法将Ni2+沉淀去除[82].例如:利用芬顿法与混凝沉淀法相结合[83-84],通过控制H2O2投加量、Fe2+与H2O2的摩尔比、反应时间等因素,将电镀退洗废水中的大部分Ni2+去除(74.62%),以满足后续深度处理要求,减轻膜处理单元的压力.
除此之外,可以利用碱—磷酸盐两级沉淀法处理高浓度含Ni浓水,通过化学氧化破络、初次沉淀和二次沉淀完成Ni处理工作[85].当初次沉淀pH值为9.5、二次沉淀pH值为10.0时,出水的总Ni浓度可稳定低于0.2mg/L,再与其他废水混合后完成处理.去除结果基本可以满足GB 21900 - 2008《电镀污染物排放标准》[86]中Ni排放限值(0.1mg/L)的要求.但是沉淀法处理含Ni废水均存在不同程度的工艺冗长、占地面积大、费用较高等问题.
5.2 膜分离技术
根据不同膜的选择透过性将膜分离技术主要分为微滤(MF)、超滤(UF)、纳滤(NF)和反渗透(RO).微滤膜的孔径范围在0.1~0.01μm,目前已应用于反渗透系统的预处理工艺中,适合对悬浮液和乳液进行截留或浓缩以及低浊度液体除菌[85].超滤膜截留分子量范围约2~200kD,在工业上应用超滤膜处理含Ni废水过程中,可添加重金属络合剂以强化超滤过程,例如:以丙烯酸—马来酸共聚物(PMA- 100)为络合剂,通过聚合物络合金属离子的强化超滤处理含Ni废水,在最优条件下,可以实现Ni2+的截留率达99%以上,但是截留率会因NaCl和Na2SO4的存在而降低[87].纳滤膜截留分子量约150~300kD,由于其特殊的孔径范围和荷电性,对二价、多价离子有较高的脱除性能,纳滤是介于超滤和反渗透之间的一种压力驱动膜过程,在合适的操作压力、pH值等条件下,纳滤膜对于Ni2+的截留率可以达到98%[88-89].反渗透是一种高效的保留溶解盐和低摩尔质量有机分子的工艺,可实现Ni2+99%的截留率.近年来,纳滤和反渗透技术普遍用于处理酸性金属污染废水,还可实现从电镀废液中对金属Ni的回收[90].
根据不同膜材料的特性,选择性地复合使用,可提高含Ni废水的处理效果.研究表明[91]采用膜分离技术的两级分级组合,一级抗污染反渗透膜分离可去除大部分Ni2+,截留率大于99%.二级海水反渗透膜分离中将废水浓缩10倍及以上,无机离子的截留率可高达99.5%.后续处理中调节漂洗水的pH值,防止废水中的氢氧化物产生沉淀,定期自动冲洗的化学和物理步骤,可实现透过液回用,末级浓缩液直接回用,预处理后零排放的治理效果.
5.3 离子交换法
离子交换法作为传统的重金属废水的治理技术,主要是利用树脂含有的活性基团(如大量的氨基、羟基、羧基等)与废液中的重金属离子发生螯合反应,从而达到脱除的目的[92].离子交换法具有效率高、树脂无毒、设备简单、无二次污染等优点[93].选择合适的离子交换树脂,可有效去除工业废水(例如电镀废水)的高浓度Ni2+.例如,c160离子交换树脂在一次50min的循环吸附过程后,Ni2+的浓度从30000mg/L下降到6300mg/L,去除率约79%,并且离子交换器的可再生效率高达84%[94].然而,离子交换技术易受到水质条件(如pH值、流速、温度)的影响,在不合适的水质条件下,去除率甚至低于10%[95].
5.4 吸附法
吸附法主要是通过分子间作用力吸附Ni2+的物理吸附作用,和通过电子转移或电子对共用形成化学键或生成表面配位化合物等方式产生的化学吸附作用来完成去除过程[96].
研究表明用二甲基乙二肟(DMG)在10% NaOH和96%乙醚溶液中对碳基吸附剂进行改性,吸附量明显高于原吸附剂(改性前70%,改性后90%),并且在碱性环境中达到最大吸附量,吸附量随温度的升高而增加[97].另外,可生物降解的壳聚糖在中等pH值下具有质子化和天然氨基,用作水中Ni2+的吸附材料,具有随Ni2+浓度的增加壳聚糖吸附容量增大的特性.基于含氧阴离子的价态不同,壳聚糖对Ni2+的吸附能力存在明显差异(溶液中存在二价硫酸根阴离子,Ni吸附效率约70%;溶液中存在一价硝酸根阴离子时,吸附效率约30%).由于溶液中阳离子和阴离子与已经被吸附的离子之间可能存在更多的静电相互作用,因此较高的阴离子价会导致较高的吸附容量,该材料适用于高浓度含Ni废水[98].
表4是对目前常规含Ni污水处理工艺的对比.Ni污水主要集中在电镀行业,其加工量仅次于锌.工业快速发展,Ni污水处理工艺也逐渐趋向工程化,以解决实地工业重金属污染为目标.在选择污水处理工艺时,不局限于单一处理方法,可多项联用,需严格考虑:成本、去除率、二次污染、材料可回收性、废液可回收性、能否大规模应用等.目前,污水处理工艺也在不断进步完善,以达到社会的可持续发展.

表4 Ni污水处理工艺
6 总结与展望
6.1 关键科学问题总结
由于Ni在环境中分布的广泛性以及水生生物对其毒性的敏感性,Ni污染问题已受到国内外高度重视.然而,关于Ni在水环境中的生物地球化学行为及毒性效应研究尚多集中在实验室内开展,即在研究过程中仅考虑单一环境要素对Ni的影响,没有系统研究实际水体中复合多要素条件下Ni的环境行为及毒性效应.
Ni在环境中的存在形态受到来源、性质及环境因素的多重影响,这也使Ni的环境行为受多方面因素的控制,目前单一环境要素,例如,不同pH值条件下对Ni环境行为的影响机理相对充分,但尚未系统研究复合多要素联合变化条件下Ni在溶解态、颗粒态及沉积物可交换态的解离或吸附沉积机制;室内毒性评价中,Ni对水生生物毒性主要表现为生长发育抑制、繁殖率下降、后代死亡率增加等,而天然复合水化学要素影响下生物有效性发生改变,造成Ni对水生生物的毒性效应尚不清楚;我国尚未发布关于Ni的水质基准,仅靠目前国家现行标准中对Ni浓度的限制,对于特定区域水化学条件的水体,统一的水质基准与标准可能过于苛刻或无法起到保护作用,对生态安全和环境质量评价构成潜在威胁和评价偏差.
6.2 研究发展方向
6.2.1 系统探索天然水体中Ni的形态及环境行为 实验室内研究关于单一环境要素(pH值、Ca2+、Mg2+、DOC等)变化条件下Ni的形态及环境行为作用机理已相对清晰,但在实际水体中尚未开展系统的研究,而实际水体中涉及环境要素多,不同水体间环境要素的种类和含量都存在显著性差异,亟需系统研究多要素联合变化条件下Ni形态及行为的变化规律,揭示天然水体中Ni的环境行为变化规律.
6.2.2 亟需开展复合多要素水体条件下Ni的毒性评价 目前,本土水生生物的毒性研究相对较少,且多数为室内控制研究不考虑或仅考虑单一水化学参数对Ni形态和毒性效应的影响,而野外环境复合水化学条件下Ni对本土水生生物的生物有效性和毒性作用机制等关键科学问题仍认识不清.亟需开展复合多要素条件下Ni对不同营养级水生生物的毒性试验,建立外暴露剂量-效应关系、内暴露剂量-效应关系,阐明复合水化学条件对Ni的生物有效性及与累积特征的内在联系,揭示水化学条件对Ni的毒性作用机制,评价实际水体中Ni可能存在的毒性风险.
6.2.3 制定适用于特定区域Ni的水质基准和标准 我国流域面积幅员辽阔,不同区域间环境特征要素有显著性差异,而我国现行《地表水环境质量标准》(GB3838-2002)中关于Ni的标准仅有一个保护限值,用于保护全国流域生态安全,显然缺少科学性和合理性,严重制约了Ni在流域高质量发展中的精细化管理,亟需制定适用于不同区域环境要素和生物区系的水质基准值,为地表水环境质量标准的制修订提供科学基础和技术支撑.对准确评估Ni在我国不同区域水环境中的生态风险,制定污染控制策略及Ni的安全开发与利用有重要的科学和实践意义.
[1] Morgan J W, Anders E. Chemical composition of Earth, Venus, and Mercury [J]. Proceedings of the National Academy of Sciences, 1980,77(12):6973-6977.
[2] Suresh G, Ramasamy V, Sundarrajan M, et al. Spatial and vertical distributions of heavy metals and their potential toxicity levels in various beach sediments from high-background-radiation area, Kerala, India [J]. Marine Pollution Bulletin, 2015,91(1):389-400.
[3] Simpson S L, Vardanega C R, Jarolimek C, et al. Metal speciation and potential bioavailability changes during discharge and neutralisation of acidic drainage water [J]. Chemosphere, 2014,103(5):172-180.
[4] Blewett T A, Leonard E M. Mechanisms of nickel toxicity to fish and invertebrates in marine and estuarine waters [J]. Environmental Pollution, 2017,223(APR.):311-322.
[5] Pane E F, Smith C, Mcgeer J C, et al. Mechanisms of acute and chronic waterborne nickel toxicity in the freshwater cladoceran, Daphnia magna [J]. Environmental Science & Technology, 2003,37 (19):4382.
[6] Cui L, Wang X, Li J, et al. Ecological and health risk assessments and water quality criteria of heavy metals in the Haihe River [J]. Environmental Pollution, 2021,290.
[7] 张 远,林佳宁,王 慧,等.中国地表水环境质量标准研究 [J]. 环境科学研究, 2020,274(11):92-97.
Zhang Y, Lin J N, Wang H, et al. Study on environmental quality standard for Surface water [J]. Research of Environmental Sciences, 2020,274(11):92-97.
[8] 郭海娟,龚 雪,马 放.我国水质基准现状及发展趋势研究 [J]. 环境保护科学, 2017,43(4):32-35.
Guo H J, Gong X, Ma F. Study of the status and development of water quality criteria in China [J]. Environmental Protection Science, 2017,43(4):32-35.
[9] 冯承莲,赵晓丽,侯 红,等.中国环境基准理论与方法学研究进展及主要科学问题 [J]. 生态毒理学报, 2015,10(1):2-17.
Feng C L, Zhao X L, Hou H, et al. Research progress and main scientific problems of theory methodology of China's environmental quality criteria [J]. Asian Journal of Ecotoxicology, 2015,10(1):2-17.
[10] 常元勋.金属毒理学 [M]. 北京:北京大学医学出版社, 2008:41.
Chang Y X. Metal toxicology [M]. Beijing: Peking University Medical Press, 2008:41.
[11] 雷 停,孙传敏.重金属镍的土壤污染及迁移转化 [J]. 地球科学进展, 2012,27(S1):359-361.
Lei T, Sun C M. Soil pollution, migration and transformation of heavy metal Nickel [J]. Advances in Earth Science, 2012,27(S1):359-361.
[12] Jacks G, Fredlander D. Nickel in groundwater - a case study from northern Sweden [M]. London: Iwa Publishing, 2012:247-249.
[13] Li M H, Grasby S E, Wang S J, et al. Nickel isotopes link Siberian traps aerosol particles to the end-Permian mass extinction [J]. Nature Communications, 2021,12(1):2024.
[14] 杨宏伟,王明仕,徐爱菊,等.黄河(清水河段)沉积物中锰,钴,镍的化学形态研究 [J]. 环境科学研究, 2001,14(5):20-22.
Yang H W, Wang M S, Xu A J, et al. Study on the chemical speciation on manganese, cobalt and nickel in sediments from Yellow River (Qingshuihe section) [J]. Research of Environmental Sciences, 2001, 14(5):20-22.
[15] 旷 攀,李秋华,金 爽.贵州高原普定水库水环境重金属的时空分布特征及风险评价 [J]. 环境科学研究, 2021,34(3):576-588.
Kuang P, Li Q H, Jin S. Spatial and temporal distribution of heavy metals in water environmental of Puding Reservoir in Guizhou Province and risk assessment [J]. Research of Environmental Sciences, 2021,34(3):576-588.
[16] Wright D A, Welbourn P, 朱 琳.环境毒理学 [M]. 北京:高等教育出版社, 2007:286.
Wright D A, Welbourn P, Zhu L. Environmental toxicology [M]. Beijing: Higher Education Press, 2007:286.
[17] U.S. Geological Survey, Mineral commodity summaries 2021 [R]. U.S.: 2021. https://doi.org/10.3133/mcs2021.
[18] 郑海华,徐礼春.重金属废水处理技术研究进展 [J]. 江西化工, 2019,144(4):91-94.
Zheng H H, Xu L C. Research progress of heavy metal wastewater treatment technology [J]. Jiangxi Chemical Industry, 2019,144(4): 91-94.
[19] Nakajima K, Daigo I, Nansai K, et al. Global distribution of material stocks: iron, copper and nickel [J]. Materiaux & Techniques, 2018, 105(511):5-6.
[20] 李照全,方 平,黄 博,等.洞庭湖区典型内湖表层沉积物中氮,磷和重金属空间分布与污染风险评价 [J]. 环境科学研究, 2020,33(6): 1409-1420.
Li Z Q, Fang P, Huang B, et al. Distribution and ecological risk assessment of nitrogen, phosphorus and heavy metals in surface sediments of typical internal lakes in Dongting Lake area [J]. Research of Environmental Sciences, 2020,33(6):1409-1420.
[21] 温 泉,赵艳民,曹 伟,等.潮白河中游沉积物中重金属分布、来源及生态风险评估 [J]. 环境科学研究, 2020,33(3):599-607.
Wen Q, Zhao Y M, Cao W, et al. Distribution characteristics, sources and potential ecological risk of heavy metal pollution in the middle reaches of Chaobai River [J]. Research of Environmental Sciences, 2020,33(3):599-607.
[22] Sigel A. Biogeochemistry of nickel and its release into the environment [M]. Wiley-Blackwell, 2007:1-29.
[23] Wen Y, Yang Z, Xia X. Dissolved and particulate zinc and nickel in the Yangtze River (China): distribution, sources and fluxes [J]. Applied Geochemistry, 2013,31(complete):199-208.
[24] Mukherjee A B. Nickel: A review of occurrence, uses, emissions, and concentration in the environment in Finland [J]. Environmental Reviews, 2011,6(3/4):173-187.
[25] Bencko V. Nickel: a review of its occupational and environmental toxicology [J]. Journal of Hygiene, Epidemiology, Microbiology, and Immunology (Prague), 1983,27(2):237-247.
[26] 章 骅,何品晶,吕 凡,等.重金属在环境中的化学形态分析研究进展 [J]. 环境化学, 2011,30(1):130-137.
Zhang H, He L J, Lv F, et al. A riview on the methods for investigating heavy metal speciation in environmental chemistry [J]. Environmental Chemistry, 2011,30(1):130-137.
[27] 李佳璐,姜 霞,王书航,等.丹江口水库沉积物重金属形态分布特征及其迁移能力 [J]. 中国环境科学, 2016,36(4):1207-1217.
Li J L, Jiang X, Wang S H, et al. Heavy metal in sediment of Danjiangkou Reservoir: chemical speciation and mobility [J]. China Environmental Science, 2016,36(4):1207-1217.
[28] Xiao D, Shi Z, Wu F, et al. Seasonal and spatial variations of heavy metals in surface sediments collected from the Baoxiang River in the Dianchi Watershed, China [J]. Human & Ecological Risk Assessment, 2018,24(7/8):1916-1929.
[29] Budiyanto F, Lestari L, Hindarti D, et al. Speciation of copper and nickel in sediment from Benoa Bay, Bali by modified BCR procedure [C]. SolarPACES: International Conference on Concentrating Solar Power and Chemical Energy Systems, 2018.
[30] Mitra A. Legislation to curb illegal fishing [J]. Marine Pollution Bulletin, 2008,56(8):1385-1388.
[31] Pyle G G, Swanson S M, Lehmkuhl D M. The influence of water hardness, pH, and suspended solids on nickel toxicity to Larval Fathead Minnows (Pimephales promelas) [J]. Water Air and Soil Pollution, 2002,133(1-4):215-226.
[32] Doig L E, Liber K. Influence of dissolved organic matter on nickel bioavailability and toxicity to Hyalella azteca in water-only exposures [J]. Aquatic Toxicology, 2006,76(3/4):203-216.
[33] Dijkstra J J, Meeussen J, Comans R. Leaching of heavy metals from contaminated soils: an experimental and modeling study [J]. Environmental Science & Technology, 2004,38(16):4390-4395.
[34] Hua Z, He P J, Shao L M, et al. Leaching behavior of heavy metals from municipal solid waste incineration bottom ash and its geochemical modeling [J]. Journal of Material Cycles & Waste Management, 2008,10(1):7-13.
[35] 王亚平,王 岚,许春雪,等.pH对长江下游沉积物中重金属元素Cd、Pb释放行为的影响 [J]. 地质通报, 2012,31(4):594-600.
Wang Y P, Wang L, Xu C X, et al. The influence of pH on the release behavior of heavy metal elements Cd and Pb in sediments of the lower reaches of the Yangtze River [J]. Geological Bulletion of China, 2012,31(4):594-600.
[36] Gustafsson J P, Pechová P, Berggren D. Modeling metal binding to soils: the role of natural organic matter [J]. Environmental Science & Technology, 2003,37(12):2767-2774.
[37] 王 海,王春霞,王子健.太湖表层沉积物中重金属的形态分析 [J]. 环境化学, 2002,1(5):430-435.
Wang H, Wang C X, Wang Z J. Speciations of heavy metals in surface sediments of Taihu Lake [J]. Environmental Chemistry, 2002,1(5): 430-435.
[38] Chakraborty P, Boissel M, Reuillon A, et al. Ultrafiltration technique in conjunction with competing ligand exchange method for Ni-humics speciation in aquatic environment [J]. Microchemical Journal, 2013,106(2013):263-269.
[39] Mandal R, Hassan N M, Murimboh J, et al. Chemical speciation and toxicity of nickel species in natural waters from the Sudbury area (Canada) [J]. Environmental Science & Technology, 2002,36(7):1477- 84.
[40] Wright D A, Welbourn P,朱 琳.环境毒理学 [M]. 北京:高等教育出版社, 2007:286-288.
Wright D A, Welbourn P, Zhu L. environmental toxicology [M]. Beijing: Higher Education Press, 2007:286-288.
[41] Maleva M G, Nekrasova G F, Bezel V S. The response of hydrophytes to environmental pollution with heavy metals [J]. Russian Journal of Ecology, 2004,35(4):230-235.
[42] Appenroth K J, Krech K, Keresztes A, et al. Effects of nickel on the chloroplasts of the duckweeds Spirodela polyrhiza and Lemna minor and their possible use in biomonitoring and phytoremediation [J]. Chemosphere, 2010,78(3):216-223.
[43] Pereira C M S, Everaert G, Blust R, et al. Multigenerational effects of nickel on Daphnia magna depend on temperature and the magnitude of the effect in the first generation [J]. Environmental Toxicology and Chemistry, 2018,37(7):1877-1888.
[44] Crémazy A, Brix K V, Smith D S, et al. A Mystery Tale: Nickel is fickle when snails fail—investigating the variability in Ni toxicity to the Great Pond Snail [J]. Integrated Environmental Assessment and Management, 2020,16(6):983-997.
[45] Ujah I, Okechukwu N. An insight into effects of pollution in aquatic environment through effects of Nickel accumulation on catalase activity of Clarias Gariepinus [J]. Annals of clinical toxicology, 2018, 1(1):1-3.
[46] 陈代宇,杨 飞,陈德芳,等.水环境中Ni2+对鲤鱼鳃和肝脏的组织损伤 [J]. 西北农业学报, 2020,29(2):175-181.
Cheng D Y, Yang F, Cheng D F, et al. Histopathology of gill and liver of cyprinus carpio exposed to Ni2+in aquatic environment [J]. Acta Agriculturae Boreali-occidentalis Sinica, 2020,29(2):175-181.
[47] Zheng G H, Liu C M, Sun J M, et al. Nickel-induced oxidative stress and apoptosis in Carassius auratus liver by JNK pathway [J]. Aquatic Toxicology, 2014,147(2014):105-111.
[48] Svecevicius G. Acute toxicity of nickel to five species of freshwater fish [J]. Polish Journal of Environmental Studies, 2010,19(2):453-456.
[49] Ruedel H, Diaz Muniz C, Garelick H, et al. Consideration of the bioavailability of metal/metalloid species in freshwaters: experiences regarding the implementation of biotic ligand model-based approaches in risk assessment frameworks [J]. Environmental Science and Pollution Research, 2015,22(10):7405-7421.
[50] Adams W, Blust R, Dwyer R, et al. Bioavailability assessment of metals in freshwater environments: a historical review [J]. Environmental Toxicology and Chemistry, 2020,39(1):48-59.
[51] 廖 伟,冯承莲,刘大庆,等.基于累积概率分布法评估典型水环境因子对铜毒性的影响 [J]. 环境工程, 2019,257(11):28-32.
Liao W, Feng C L, Liu D Q, et al. Evaluation of influence of typical water conditions on cooper toxicity based on the cumulative probability distribution method [J]. Environmental Engineering, 2019, 257(11):28-32.
[52] Nys C, Janssen C R, Van Sprang P, et al. The effect of pH on chronic aquatic nickel toxicity is dependent on the pH itself: Extending the chronic nickel bioavailability models [J]. Environmental Toxicology and Chemistry, 2016,35(5):1097-106.
[53] Rudel H, Diaz Muniz C, Garelick H, et al. Consideration of the bioavailability of metal/metalloid species in freshwaters: experiences regarding the implementation of biotic ligand model-based approaches in risk assessment frameworks [J]. Environmental Science and Pollution Research International, 2015,22(10):7405-21.
[54] Mano H, Shinohara N. Acute toxicity of nickel to Daphnia magna: validation of bioavailability models in Japanese rivers [J]. Water, Air, & Soil Pollution, 2020,231(9):459.
[55] Pourkhabbaz A, Khazaei T, Behravesh S, et al. Effect of water hardness on the toxicity of cobalt and nickel to a freshwater fish, Capoeta fusca [J]. Biomedical and Environmental Sciences, 2011,24(6):656-660.
[56] Niyogi S, Brix K V, Grosell M. Effects of chronic waterborne nickel exposure on growth, ion homeostasis, acid-base balance, and nickel uptake in the freshwater pulmonate snail, Lymnaea stagnalis [J]. Aquatic Toxicology, 2014,150(2014):36-44.
[57] Kubota T, Shindo Y, Tokuno K, et al. Mitochondria are intracellular magnesium stores: investigation by simultaneous fluorescent imagings in PC12cells [J]. Biochimica Et Biophysica Acta Molecular Cell Research, 2005,1744(1):19-28.
[58] Kohen E. Flavin-dependent thymidylate synthase: A novel pathway towards thymine [J]. Archives of Biochemistry and Biophysics, 2010,493(1):96-102.
[59] Muyssen B, Brix K V, Deforest D K, et al. Nickel essentiality and homeostasis in aquatic organisms [J]. Environmental Reviews, 2004, 12(2):113-131.
[60] Atli G. The effect of waterborne mercury and nickel on the ATP ases and AChE activities in the brain of freshwater fish (Oreochromis niloticus) depending on the Ca2+concentrations [J]. Turkish Journal of Fisheries and Aquatic Sciences, 2019,19(5):363-371.
[61] Bougas B, Normandeau E, Pierron F, et al. How does exposure to nickel and cadmium affect the transcriptome of yellow perch (Perca flavescens) - Results from a 1000candidate-gene microarray [J]. Aquatic Toxicology, 2013,142(2013):355-364.
[62] Lushchak V I. Contaminant-induced oxidative stress in fish: a mechanistic approach [J]. Fish Physiology and Biochemistry, 2016, 42(2):711-747.
[63] Kubrak O I, Husak V V, Rovenko B M, et al. Tissue specificity in nickel uptake and induction of oxidative stress in kidney and spleen of goldfish Carassius auratus, exposed to waterborne nickel [J]. Aquatic Toxicology, 2012,118(2012):88-96.
[64] Zahid S, Mustafa A, Dina A, et al. Nickel challenge up regulates CD69expression on T lymphocyte sub-sets from patients with nickel induced contact dermatitis [J]. African Health Sciences, 2019,19(1): 1460-1466.
[65] Blewett T A, Leonard E M. Mechanisms of nickel toxicity to fish and invertebrates in marine and estuarine waters [J]. Environmental Pollution, 2017,223(2017):311-322.
[66] Blewett T A, Smith D S, Wood C M, et al. Mechanisms of nickel toxicity in the highly sensitive embryos of the sea urchin evechinus chloroticus, and the modifying effects of natural organic matter [J]. Environmental Science & Technology, 2016,50(3):1595-1603.
[67] Blewett T A, Wood C M. Low salinity enhances Ni-mediated oxidative stress and sub-lethal toxicity to the green shore crab (Carcinus maenas) [J]. Ecotoxicology and Environmental Safety, 2015,122(2015):159-170.
[68] Meyer J S, Lyons-Darden T, Garman E R, et al. Toxicity of nanoparticulate nickel to aquatic organisms: review and recommendations for improvement of toxicity tests [J]. Environmental Toxicology and Chemistry, 2020,39(10):1861-1883.
[69] 吴丰昌.水质基准的理论与方法学导论 [M]. 北京:科学出版社, 2010:24-28.
Wu F C. Introduction to the theory and methodology of water quality criteria [M]. Beijing: Science Press, 2010:24-28.
[70] 杜东阳.中国重金属铬和镍的淡水水质基准研究 [D]. 北京:中国地质大学(北京), 2012.
Du D Y. The study on water quality criteria of heavy metals chromium and nickel in China [D]. Beijing: China University of Geosciences (Beijing), 2012.
[71] 丹增强白,王 琛,王梦杰,等.镍的中国淡水水生生物水质基准及水体硬度的影响研究 [J]. 西北大学学报(自然科学版), 2020, 50(1):81-89.
Dan Z Q B, Wang C, Wang M J, et al. The water quality criteria of nickel and the influence affected by water hardness to protect freshwater aquatic organisms in China [J]. Journal of Northwest University(Natural Science Edition), 2020,50(1):81-89.
[72] GB 3838-2002 地表水环境质量标准 [S].
GB 3838-2002 Environmental quality standards for surface water [S].
[73] GB 11607-1989 渔业水质标准 [S].
GB 11607-1989 Water quality standard for fisheries [S].
[74] GB 5749-2006 生活饮用水卫生标准 [S].
GB 5749-2006 Standards for drinking water quality [S].
[75] 施银燕,徐玉福,胡献国.化学沉淀法回收化学镀镍废水中镍的研究[J]. 电镀与环保, 2011,31(5):44-46.
Shi Y Y, Xu Y F, Hu X G. A Study of recovering nickel from electroless niclel plating wastewater by chemical precipitation [J]. Electroplating & Pollution Control, 2011,31(5):44-46.
[76] 关耀昌.膜分离技术在镀镍废水处理中的应用 [J]. 电镀与涂饰, 2010,29(6):42-44.
Guan Y C. Application of membrane separation technique to nickel plating wastewater treatment [J]. Electroplating & Finishing, 2010,29 (6):42-44.
[77] Benvenuti T, Rodrigues M S, Bernardes A M, et al. Closing the loop in the electroplating industry by electrodialysis [J]. Journal of Cleaner Production, 2017,155(PT.1):130-138.
[78] Otrembska P, Gega J. Separation of nickel(II) and cadmium(II) with ion-exchange process [J]. Separation Science and Technology, 2012, 47(9):1345-1349.
[79] Kern A M, Zierath B, Fey T, et al. Adsorption of nickel ions on oxygen-functionalized carbons [J]. Chemical Engineering & Technology, 2016,39(4):715-722.
[80] Shao J, Qin S, Davidson J, et al. Recovery of nickel from aqueous solutions by complexation-ultrafiltration process with sodium polyacrylate and polyethylenimine [J]. Journal of Hazardous Materials, 2013,244(2013):472-477.
[81] Tsai T H, Chou H W, Wu Y F. Removal of nickel from chemical plating waste solution through precipitation and production of microsized nickel hydroxide particles [J]. Separation and Purification Technology, 2020,251(2020):117315.
[82] 漆雅丽,吴雨时,吴平益.一种化学镍废水处理方法:中国, CN105884078A [P]. 2016-08-24.
Qi Y L, Wu Y S, Wu P Y. A method for treating chemical nickel wastewater: China, CN105884078A [P]. 2016-08-24.
[83] 周安东,赵 永.Fenton法处理退镀镍漂洗的含镍络废水 [J]. 电子技术(上海), 2020,49(2):158-160.
Zhou Y D, Zhao Y. Treatment of rinsing wastewater containing complex nickel by Fenton process [J]. Electronic Technology, 2020, 49(2):158-160.
[84] 蔡文良.Fenton氧化-混凝沉淀处理电镀废水中重金属镍的研究 [J].矿冶工程, 2020,194(4):109-112.
Cai W L. Treatment of heavy metal nickel in electroplating wastewater with Feton oxidation and coagulation precipitation [J]. Mining and Metallurgical Engineering, 2020,194(4):109-112.
[85] 陈振国,汪晓军.两级沉淀法处理电镀含镍废水 [J]. 电镀与涂饰, 2014,33(21):935-938.
Cheng Z G, Wang X J. Treatment of nickel-containing electrop;ating wastewater by two-stage precipitaion process [J]. Electroplating & Finishing, 2014,33(21):935-938.
[86] GB 21900-2008 电镀污染物排放标准 [S].
GB 21900-2008 Emission standard of pollutants for electroplating [S].
[87] 郜国英,韦玉青,邱运仁.丙烯酸-马来酸共聚物强化超滤处理含镍废水 [J]. 中南大学学报(自然科学版), 2012,43(1):54-58.
Gar G Y, Wei Y Q, Qiu Y R. Treatment of wastewater containing nickel ions by polymer enhanced ultrafiltration with copolymer of acrylic acid-maleic acid [J]. Journal of Central South University (Science and Technology), 2012,43(1):54-58.
[88] 王少明,王建友,卢会霞,等.纳滤膜技术浓缩分离含镍离子溶液 [J]. 水处理技术, 2010,36(8):92-95.
Wang S M, Wang J Y, Lu H X, et al. Concentration and separation nickel wastewater by nanofiltration [J]. Technology of Water Treatment, 2010,36(8):92-95.
[89] 薛莉娉.纳滤处理含镍废水的试验研究 [J]. 安徽建筑工业学院学报(自然科学版), 2009,17(6):73-75.
Xue L P. Experimental study on nickelic wastewater by nanofiltration [J]. Journal of Anhui Jianzhu University, 2009,17(6):73-75.
[90] Ricci B C, Ferreira C D, Marques L S, et al. Assessment of the chemical stability of nanofiltration and reverse osmosis membranes employed in treatment of acid gold mining effluent [J]. Separation and Purification Technology, 2017,174(2017):301-311.
[91] 盛 祥.膜分离技术在含镍电镀废水回收利用中的应用——以浙江兴华电池有限公司电镀废水回收利用为例 [J]. 污染防治技术, 2015,33(3):95-98.
Sheng X. Application of membrane separation technology in the recycling of nickel-containing electroplating wastewater - an example of recycling electroplating wastewater from Zhejiang Xinghua Battery Co. [J]. Pollution Control Technology, 2015,33(3):95-98.
[92] 李 玲,温建康,阮仁满.离子交换法分离回收溶液中镍的研究进展 [J]. 贵金属, 2007,8(S1):75-79.
Li L, Wen J K, Ruan R M. Research and development in recovery of nickel from solution by ion-exchange [J]. Precious Metals, 2007, 8(S1):75-79.
[93] 杨 海,黄 新,林子增,等.离子交换法处理重金属废水的研究进展 [J]. 应用化工, 2019,48(7):1675-1680.
Yang H, Huang X, Lin Z Z, et al. Research progress in the treatment of heavy metal wastewater by ion exchange [J]. Applied Chemical Industry, 2019,48(7):1675-1680.
[94] Godyń K, Dutka B. The impact of the degree of coalification on the sorption capacity of coals from the Zofiówka Monocline [J]. Archives of Mining Sciences, 2018,(63)3:727-746.
[95] 陆继来,曹 蕾,周海云,等.离子交换法处理含镍电镀废水工艺研究 [J]. 工业安全与环保, 2013,39(12):13-15.
Lu J L, Cao L, Zhou H Y, et al. Nickel plating rinse wastewater treatment by ion-exchange method [J]. Industrial Safety and Environmental Protection, 2013,39(12):13-15.
[96] 张家桦,施 岩.吸附法处理重金属废水的研究进展 [J]. 当代化工, 2014,34(6):991-993.
Zhang J H, Shi Y. Research progress in adsorption treatment of heavy metal wastewater [J]. Contemporary Chemical Industry, 2014,34(6): 991-993.
[97] Pomazkina O I, Filatova E G, Lebedeva O V, et al. Adsorption of nickel (II) ions by aluminosilicates modified by poly-1-vinyl imidazole and poly-4-vinyl pyridine [J]. Protection of Metals and Physical Chemistry of Surfaces, 2018,54(4):582-586.
[98] Mende M, Schwarz D, Steinbach C, et al. The influence of salt anions on heavy metal ion adsorption on the example of nickel [J]. Materials, 2018,11(3):373.
A comprehensive review on environmental biogeochemistry and toxic effects of nickel.
HE Shan1,2, GUO Yuan3, WANG Chen3, WU Feng-chang3, HE Jia1*
(1.Beijing Key Laboratory of Urban Hydrological Cycle and Sponge City Technology, College of Water Sciences, Beijing Normal University, Beijing 100875, China;2.College of Geoexploration Science and Technology, Jilin University, Changchun 130026, China;3.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China)., 2022,42(5):2339~2351
At present, toxicity evaluation of nickel is mostly based on single indicator and laboratory control experiment. How to evaluate the influence of the forms and natural complex hydrochemical conditions is the difficult problem in the field of water quality criteria and ecological risk assessment. This study comprehensive reviewed on the sources, forms, bioavailability, toxic mechanism, water quality criteria and standards, and wastewater treatment processes of nickel. The study focused on the environmental behaviour and toxicity effects and mechanism of nickel. The impacts of water chemistry factors on bioavailability of nickel were analyzed, the toxic effect on aquatic organisms of different trophic levels were outlined, the six response mechanisms of nickel toxicity to freshwater aquatic organisms were summarized. The influence trend of bioavailability of nickel on toxicity was prospected. And it is of great significance to derive water quality criteria of nickel for protection of freshwater aquatic organisms in China.
nickel;environmental behaviour;toxic mechanism;bioavailability;water quality criteria
X142
A
1000-6923(2022)05-2339-13
何 珊(1998-),女,新疆伊犁人,博士研究生,主要从事水质基准与风险评估,水生生物毒性效应及环境地球化学研究.发表论文1篇.
2021-10-13
国家自然科学基金创新群体项目(41521003);国家自然科学基金资助项目(42007369);中央高校基本科研业务费专项基金资助项目(2019NTST19)
* 责任作者, 讲师, hejia@bnu.edu.cn

