光学显微成像技术在液-液相分离研究中的应用
关苑君,马显才
(1.中山大学中山医学院科研仪器管理中心,广东广州 510080;2.中山大学热带病防治研究教育部重点实验室,广东广州 510080;3.广州实验室,广东广州 510005)
在真核细胞内存在着功能各异的区室(compartment),使得细胞的生化反应相对独立、有序和高效地进行。这些区室分为有膜和无膜两种结构。有膜区室在空间上具有膜结构,从而可以与其他区室分开,例如线粒体、溶酶体等细胞器。而部分区室是无膜结构,例如核仁、中心体、Cajal 小体、应力颗粒、P颗粒等[1-2]。许多无膜结构的区室都具有液滴的性质,细胞里不同成分相互碰撞、融合形成液滴,从而使部分成分被包裹在液滴内部,一些组分被阻隔在液滴外,该现象被称为液-液相分离或者相变(liquid-liquid phase separation,phase transition)。
相分离形成的过程会聚集蛋白,高蛋白浓度往往会引发堵塞,导致固体凝胶或晶体的形成,从而导致生化反应不适于在其中进行。在一些疾病的进程中也观察到液-液相分离向液-固相变的现象。例如,在运动神经元疾病或肌萎缩型脊髓侧索硬化症(ALS)[3-4]、阿尔茨海默病[5]、肿瘤[6]等疾病研究中。也有研究表明,液-液相分离对细胞有保护作用[7]。此外,通过生物大分子多价相互作用(multivalent)、寡聚作用(oligomerizing)、RNA 多价互作结合(RNA binding)、内在无序区域(intrinsically disordered regions,IDRs)、静电相互作用(electrostatic interaction)、β 折叠股(β-strand)等形式[8],液-液相分离参与到细胞基因组失活[9]、转录调控[10-11]、重塑染色质结构[12]、药物等方面的研究中。
液体表面张力决定了无膜结构的液-液相分离液滴具有融合、聚结、滴出的特性,并保持球形的结构[13]。在细胞中,液滴会与细胞质进行物质交换,液滴内部物质也会重组[1]。基于无膜液滴的特性,观察和验证体内或体外的相分离,主要使用显微成像技术、光调控系统等手段验证其:①无膜圆形结构;②融合、裂变和阻断;③扩散性;④成核机制等[14-15]。而针对相分离液滴的其他物理特性,需要运用物理方法测定浑浊度、表面张力、液滴内部硬度、聚合网格孔径等在体外完成[16]。因为光学显微成像技术可直观地检测其表面张力部分的特性,包括无膜圆形结构、融合、裂变、阻断;可定性或定量观察和阐明扩散相关问题(内部扩散和跨界扩散),从而证明相分离液滴的存在与形成过程,以便后续研究其功能,所以光学显微成像技术是强有力的研究工具。依据体内外样品和是否标记荧光,明场显微技术、荧光显微技术各有优缺点,能够响应液-液相分离研究中不同的问题(图1)。
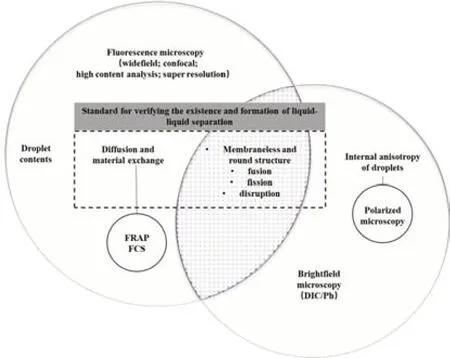
图1 液-液相分离研究中的光学显微成像技术Fig.1 Optical microscopy techniques in phase separation research
1 液-液相分离表面张力特性的检测
1.1 明场显微技术
为研究体内外相分离现象,运用明场显微镜中的微分干涉、相衬(相差)可有效地检测液滴的形态、融合或裂变过程等。明场观察的优点是样品无需标记,对样品伤害少;缺点是无法确认液滴的内涵物,且无法说明扩散与物质交换等问题。
1.1.1 微分干涉显微技术 微分干涉显微镜(differential interference contrast)又称Nomarski 相差显微镜,简称DIC显微镜。DIC利用偏振光成像,微分光线后干涉,把相位变成了相位差,再将相位差通过干涉变成振幅变化。在显微镜光路中有四个特殊的光学部件:偏振器(polarizer)、DIC 棱镜、DIC 滑行器和检偏器(analyzer)[17-18]。微分干涉的优势在于,更突显样品边界。Zeng等[16]使用DIC 显微技术在体外观察了SynGAP CC-PBM/PSD-95 PSG 混合物形成液滴的过程,小液滴随着时间变化融合成大液滴;以及该液滴在加入15AA肽后,液滴迅速分散的过程。
1.1.2 相衬(相差)显微技术 结构的相位变化可通过相衬成像反映出来,例如细胞内部结构,但不容易反映细胞的边界[18]。相衬显微镜(phase contrast),在光路中加入相差环,对通过环带光线的0级光相位改变180°,于1 级衍射光相位相位,从而突出1 级衍射光所表征的结构特征,同时由于0 级光变弱,背景变暗。而由于1 级衍射光会有部分产生强度和相位变化,在和0 级衍射光合成时产生光晕,这是相衬成像的缺点。
1.2 荧光显微技术
标记荧光蛋白或RNA 的样品,可应用荧光显微技术进行观察和分析。与明场显微技术相比,荧光显微技术有以下的优点:①信噪比高,液滴边缘和内部情况更为清晰;②排除了细胞内其他细胞器或蛋白等的影响,更有利于观察体内研究;③依据标记的蛋白或RNA,可明确液滴内涵物,并可进行定量分析;④观察与分析设备选择性范围更广,例如在观察和分析液滴形成、大小、融合、裂变、可逆性重组等现象时,可以运用宽场荧光显微技术、共聚焦显微技术、高内涵成像分析技术、超分辨显微成像技术等。
1.2.1 宽场荧光显微技术与共聚焦显微技术 宽场荧光和共聚焦显微技术,都是以特定激发波长照射标本,并通过滤光器收集特定发射波长信号。宽场荧光显微镜下的标本暴露在荧光下,所有焦平面信号都被检测到,对于低自发背景荧光的、厚度薄的标本,如贴壁细胞等更为有利。而共聚焦显微镜因为具备针孔(pinhole),有效减少非焦平面的自发荧光,可获取多层光学切面图像。两种显微技术都广泛应用于相分离的体外和体内研究中。Li 等[19]结合DIC 和宽场荧光显微镜,在体外观察了SH34、PRM4 和OG-SH34 的混合物通过多价大分子相互作用形成相分离和融合的情况,揭示了相分离的形成机制。Molliex 等[4]应用激光共聚焦显微镜和图像分析软件,证明了RNA 结合蛋白hnRNPA1 通过低复杂性序列域介导富含蛋白质的液滴形成,并测量了相关比例。
1.2.2 高内涵成像分析技术 随着显微技术的发展,高内涵成像分析技术因其高通量、高效、数据信息丰富,被广泛用于筛选性实验。在不同强力霉素浓度处理后,Plys 等[20]应用高内涵成像分析技术完成了多个不同位点的CBX2 突变株和CBX7 蛋白区,高通量统计了三组重复样品细胞核内斑点数目的平均数目,以及每个细胞核内的斑点数目。从而说明CBX2 中含有对相分离形成很重要的结构域,与染色质压实和发展的结构域是一致的。此外,Zhou 等[21]基于生物过程中出现的相分离现象,运用高通量筛选的方法,研发出一种用于生物分子相互作用的检测方法,称为“相分离凝聚辅助下的在试管中的生物分子富集”(CEBIT),可选择性地将生物分子招募到含有同源结合体的相分离凝聚物中。
1.2.3 超分辨率显微技术 超分辨率显微技术能更好地解析蛋白之间空间位置关系、蛋白聚集的情况,尤其是液滴内涵物超过一种的情况,该技术有一定的优势。Fu 等[22]运用随机重构超分辨显微技术(stochastic optical reconstruction microscopy,STORM)观察到人骨肉瘤细胞中,N6-甲基腺嘌呤(m6A)结合蛋白YTHDF 在超高饱和状态下,常在压力颗粒(stress granule,SG)的边缘或在SG核心群间间隙中形成群簇,并有可能通过降低活化能障碍和SG 凝聚物的主要大小,从而促进SG 形成。实验结果提示了m6A 结合的YTHDF 蛋白在调控SG 形成中的新功能。Zeng等[23]运用mEos2质粒,精准地观察到,人骨肉瘤细胞在渗透胁迫下IGF2BP1 和Poly(A)mRNA 向SGs 的募集情况。揭示了渗透胁迫中一个新颖的、多阶段LLPS过程,在这个过程中IGF2BP 蛋白的快速聚集启动了SG 组装。Agotearan 等[24]使用FXR1 siRNA 处理HeLa 细胞,通过超分辨率显微镜的进一步分析显示,相对于在对照组细胞中的更规则、圆形的小细胞质核孔蛋白聚集点,脆性相关蛋白(fragile X-related protein 1,FXR1)缺陷细胞核周区域的核孔蛋白呈非晶态聚集。Ma 等[25]运用结构光照明成像技术(structural illumination microscopy,SIM)和STORM 技术观察了染色质组装因子蛋白CAF-1小体的结构。
2 液-液相分离中的扩散与物质交换检测
运用共聚焦显微技术中的荧光漂白后恢复、荧光相关光谱等功能,可获得液滴内部流动性、液滴与外部的物质交换、扩散与动力学等相关数据。
2.1 荧光漂白后恢复技术
相分离研究的关键是要证明所研究的蛋白存在动态可逆的聚集-解聚状态变化,并且这一变化与蛋白的功能有关。常用的技术是基于激光共聚焦显微镜的荧光漂白后恢复实验技术。荧光漂白后恢复(fluorescence redistribution after photobleaching,FRAP),是在显微镜的选择区域中采用脉冲的高强度激光将该区域漂白,观测该区域随时间推移荧光恢复的动力学过程。FRAP是非常有效的研究分子动力学变化的技术手段,在体外和体内相分离研究中发挥了重要作用,可说明物质可以流动和交换形成聚集性复合物。Molliex 等[4]以水凝胶相为对照,分别对含有hnRNPA1 组分形成的相分离液滴在体外和应力颗粒内进行荧光漂白后恢复实验,获得其恢复特性,从而表明应力颗粒是通过液-液相分离形成液相。Ma 等[25]对GFP 标记的染色质组装因子CHAF1A 进行了光漂白后的荧光恢复(FRAP)实验,发现荧光恢复得很快,说明其形成的染色质组装因子蛋白CAF-1 相分离液滴,具有内部扩散性。
值得注意的是,FRAP 技术并不是一种“液态”性质的测试手段,它只能测量在特定条件下液滴的动力学变化过程。因为FRAP 的定量计算依赖于分子扩散模型,但在细胞中的分子状态不同于简单的溶液或胶体,机制复杂。尤其是细胞内的三维空间,其复杂性更强于细胞膜的二维双层流动分子模型[26-27]。所以,在实际实验中,可发现同样的蛋白在内源表达、过表达、体外表达等条件下,其恢复情况会有不同的表现[27]。同时,FRAP 的实验结果无法确定一个隔室(compartment)是否为一个单独的液相。实际操作相关实验时,需要注意相关条件和细节,根据实验需求考虑参数的计算和应用(表1)。

表1 液-液相分离研究中FRAP技术操作注意事项Table 1 Precautions for FRAP technology in liquid-liquid separation studies
2.2 荧光相关光谱
荧光相关光谱(fluorescence correlation spectroscopy,FCS)是一种通过检测微区内(共聚焦体积,一般<10-15L)的荧光团由于布朗运动或化学反应而导致的荧光强度的涨落,分析样品特性的检测技术,类似于传统的荧光分光光度计,主要用于液态样品的成分分析。在液-液相分离当中,使用荧光相关光谱技术,主要是获得扩散率、多组分扩散和浓度等检测参数,从而说明液相的性质[30-32]。Wei 等[33]运用荧光相关光谱技术观察、分析了秀丽杆线虫蛋白LAF-1,揭示了这种可在体外形成类似于P 颗粒液滴的蛋白,其有效网格大小约为3-8 nm,这决定了液滴特性如何影响分子扩散和渗透性。同时,通过荧光交叉相关光谱技术,可进一步说明了LAF-1 和不同长度的RNA 分子的相互作用,更好地阐明了液-液相分离的组装在细胞生理过程之中的作用机理。
3 展望
在生物学液-液相分离研究当中,通常需要结合多种现象或数据阐明相关问题,而光学显微成像技术的应用可协助研究人员获得相关参数(表2)。随着技术发展,目前已有更多的光学显微技术可用于相关的研究,包括偏振光显微技术,依据折射率的不同,检测液滴内部分子在空间排列的变化,如内部纤维化或固态样结构[4],[18],[34];荧光寿命成像技术(fluorescence lifetime imaging,FLIM),监测活细胞内荧光标记蛋白的分子间和分子内动态变化;快速结构光照明技术(SIMS),实现活细胞和细胞内动态的超分辨率时间序列成像;光调控系统(OptoDroplets、CasDrop)等,其中,OptoDropets 这种利用光线操纵活细胞内物质的工具,可以解释蛋白如何组装成不同的液态和凝胶状固态,这是理解很多关键的细胞运转过程的关键[15]。CasDrop技术则是基于Cas9 平台,让其在光激活时诱导其他蛋白质与基因结合,使局部生产相分离,在染色质区域形成小液滴[35]。在实际应用过程中,应结合相分离的实验需求、设备硬件条件、各光学显微成像技术优势而选用相关技术手段。
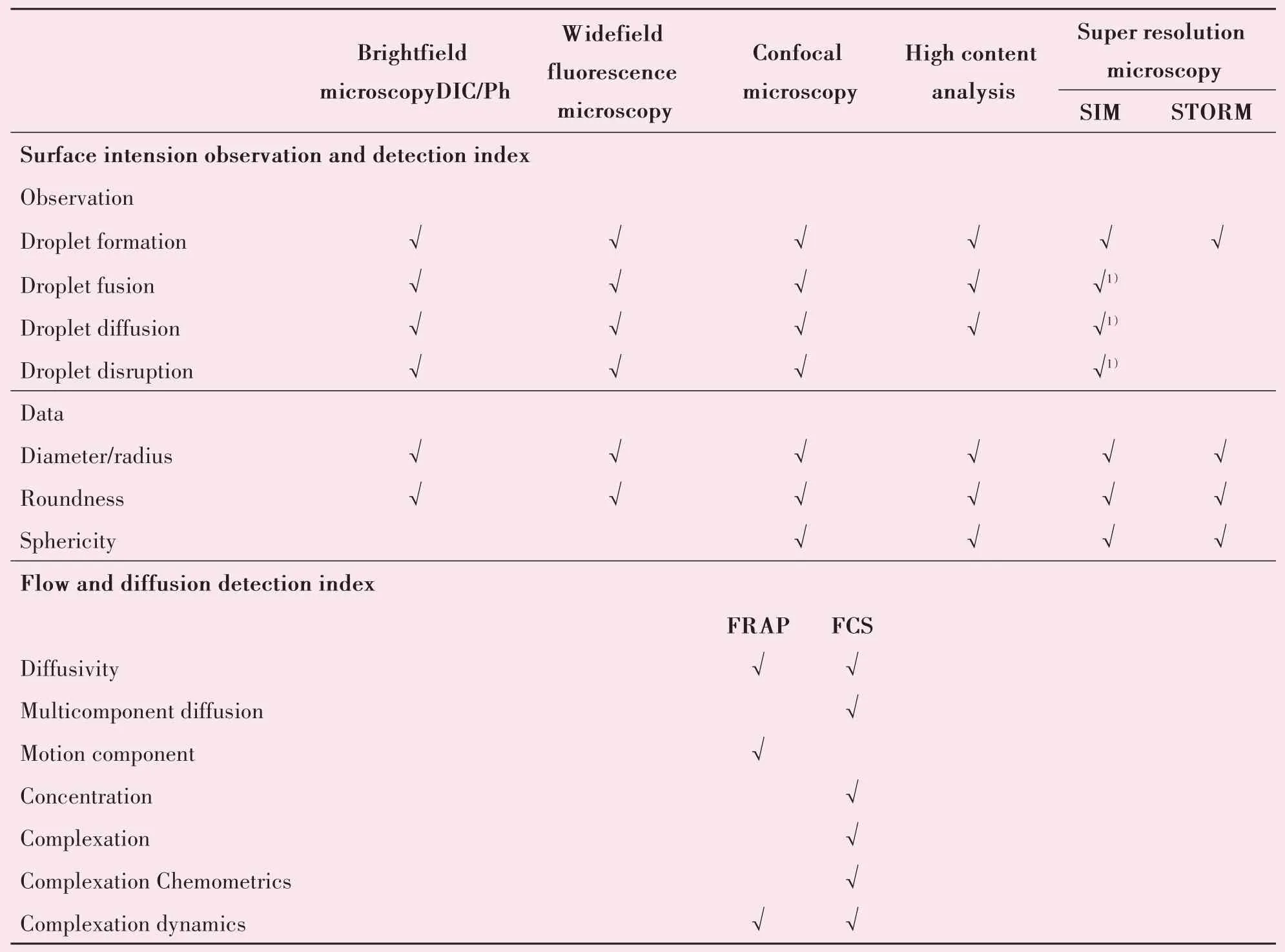
表2 光学显微成像技术可检测液-液相分离的参数表Table 2 The detection index of liquid-liquid phase separation obtained by optical microscopic imaging techniques

