外源钙对盐胁迫下单叶蔷薇种子萌发和幼苗生长的影响
闫 振,李 进,阿丽努尔·阿卜来提,谢姆斯耶·肖开提
(新疆特殊环境物种保护与调控生物学实验室,干旱区植物逆境生物学实验室,新疆师范大学生命科学学院,新疆 乌鲁木齐830054)
许多植物在整个生长发育过程都会受到盐胁迫的影响,盐胁迫是抑制种子萌发和幼苗生长的重要因素,过量的盐会引起植物产量、生理生化、信号转导、基因调控以及新陈代谢等一系列复杂的变化,关于盐对植物生理生化的影响以及植物耐盐适应机制的研究至关重要[1]。钙是植物生长和代谢的重要调节物质之一,同时也是生理和生化反应的第二信使。前人对外源钙的研究表明,盐胁迫下大量Na+会与质膜结合,Ca2+内流功能受到抑制,外排能力增强,细胞内的钙稳态被打破。施加外源钙能够降低Na+与质膜的结合能力,减少Ca2+的外泄,重建细胞内的钙稳态并恢复质膜的完整性,从而缓解盐胁迫对植物的损害[2]。李广鲁、麻莹等人的研究显示通过施加不同浓度的外源钙可以缓解盐胁迫对植物体内离子代谢、渗透调节与光合作用等方面的伤害[3-6],植物借助钙能够减少根系对钠离子的吸收、维持钾离子的浓度以及提升抗氧化酶的保护能力进而起到对盐胁迫的缓解效应[7]。
世界上存在极其丰富的蔷薇科(Rosaceae)植物资源,目前已发现的蔷薇科植物有1 000余种,主要分布在在欧亚森林、欧亚草原亚区、亚洲中部荒漠亚区[8]。蔷薇科植物中包括一些独特的物种,如单叶蔷薇[Hulthemiaberberifolia(Pall.) Dumort.]。单叶蔷薇隶属于蔷薇科(Rosaceae)单叶蔷薇属(HulthemiaDumort),在亚洲中部以及西伯利亚等地均有分布,在中国只分布于新疆,且在新疆仅见于昌吉、伊犁、沙湾、塔城、玛纳斯等地,分布范围有限[9]。单叶蔷薇属于早春植物,生长在在草场内,果肉致密饱满,富含丰富的氨基酸和维生素,嫩叶可作为饲料供动物食用[10]。
新疆属于盐旱地区,生长于此种环境中的植物体极易丧失水分和养分。为了适应土壤盐渍化的环境,单叶蔷薇的叶片收缩,呈卷曲化,同时在每年的7月其进入半休眠期,很好地规避了土地水分丧失而导致的高盐环境的影响。单叶蔷薇在长期的进化发展过程中逐渐形成了自己独特的耐盐特性。目前,对单叶蔷薇的研究主要集中在形态学、生境研究及繁殖方法等方面,而关于外源钙对单叶蔷薇抗盐性的研究却鲜见报道[11-14]。本研究拟在模拟盐胁迫条件下施加不同浓度的氯化钙(CaCl2),通过测定种子萌发率及其幼苗的生理生化指标的变化以及分析单叶蔷薇种子萌发和幼苗生长对盐胁迫的响应特点,探究单叶蔷薇对盐胁迫的耐受性及外源钙对盐胁迫的缓解作用,为单叶蔷薇资源保护提供理论支持。
1 材料与方法
1.1 研究材料
于2020年7月中旬,在新疆乌鲁木齐市五一农场的单叶蔷薇自然分布区进行材料的采摘,选取生长相对较好的单叶蔷薇植株,收集成熟的果实,贴上标签并标记分类,带回实验室清洗同时剥取种皮,取出种子,筛选出完整饱满的种粒,晾干后4℃低温保存备用。本实验在新疆师范大学干旱区植物逆境生物学实验室完成。
1.2 研究方法
本实验于2020年8月18日开始,将单叶蔷薇种子浸泡在无菌水中,通过漂洗的方法除去没有活性的、干瘪的种子,最终选取相同粒厚的单叶蔷薇种子进行实验。单叶蔷薇种子休眠时间长,种皮较厚,实验前需对种子进行酸蚀处理。我们分别设置浸种时间为30 min,1 h,2 h,最终确定处理时间1 h效果明显且对种子伤害较小。向盛有种子的烧杯注入浓硫酸,酸量以淹没种子为度,在浸泡过程中用玻璃棒不断搅动。处理废弃酸液,将种子在流动水中冲洗1 h以将种皮表面残留的酸除尽。
试验采用双因素设计,共设3个盐度胁迫条件处理,用分析纯试剂配置处理液,氯化钠(NaCl)的浓度设3个水平,分别为50 mmol·L-1,100 mmol·L-1,150 mmol·L-1;CaCl2的浓度设2个水平,分别为10 mmol·L-1,20 mmol·L-1,以无菌水为对照,共计10个处理,每个处理重复3次。
1.3 研究指标测定
1.3.1单叶蔷薇种子萌发率的测定 按照国际种子检验规则,用无菌滤纸进行种子萌发实验。供试单叶蔷薇种子平均横径为0.21±0.04 cm,纵径为0.35±0.06 cm。将酸蚀后的种子浸泡于75%的乙醇中消毒30 s,用蒸馏水将种皮表面的乙醇冲洗干净,无菌滤纸吸干多余的水。在直径为9 cm培养皿中平铺两层滤纸,将30粒种子均匀放置,每个处理3皿,共计90粒种子,将处理液加入至培养皿中至滤纸湿润饱和每个培养皿中加入10 mL处理液。本项实验在恒温25℃智能人工气候箱内进行,采取白天12 h,夜晚12 h的条件,周期性光照。实验过程中辅以称重补水法补充培养皿中蒸发的溶液,每24 h定期来补充水分[15]。种子的萌发以单叶蔷薇种子露白作为标准,观察并记录种子的相对发芽率,当连续3天种子的数量没有变化时视作萌发实验结束。
种子的相对发芽率按照以下公式计算:
1.3.2单叶蔷薇幼苗生长指标及其生理指标测定 萌发实验结束后,每个处理中随机选取15株幼苗,进行根和茎长度的测量。用游标卡尺分别测定根和芽长度,计算平均值,以mm表示。种子萌发状况完全稳定后,即选取每个处理下生长状态较为一致的幼苗10株进行生理生化指标的检测[16]。超氧化物歧化酶(SOD)的活性采用羟胺法测定[17];过氧化氢酶(CAT)的活性采用钼酸铵法测定[18];过氧化物酶(POD)活性采用比色法测定,利用过氧化物酶催化过氧化氢反应的原理,通过测定420 nm处吸光度的变化得出其酶活性[19];过氧化氢(H2O2)含量的测定采用比色法,利用H2O2可以与钼酸相互作用生成一种络合物的特性,在405 mm处测定其生成量可计算出H2O2的含量[20]。
1.3.3单叶蔷薇幼苗叶绿素含量测定 选取新鲜的单叶蔷薇幼苗叶片,清洁叶片表面,切割掉叶脉,并搅拌均匀。称取一份切好的样品40 mg,置于5 mL EP管中,用液氮速冻,研磨两次每次30 s,研磨完立即加入96%乙醇4 mL,摇匀后静置5 min以备后续的测量。取上清液,在波长665 nm,649 nm和470 nm下用分光光度计测定OD值,以96%乙醇作为空白对照,记录测量值并计算叶绿素的含量[21]。
叶绿素的含量按以下公式计算,单位为mg·L-1。
Ca=13.95D665-6.88D649
Cb=24.96D649-7.32D665

式中:Ca为叶绿素a的浓度,Cb为叶绿素b的浓度,Car为类胡萝卜素的浓度,C为叶绿素a与叶绿素b的总和。

1.3.4单叶蔷薇幼苗叶绿素荧光动力学参数测定 利用便携式调制叶绿素荧光仪PAM-2500测定单叶蔷薇幼苗的最大光化学效率(Fv/Fm)和实际光量子(YⅡ)。叶绿素荧光的测量是在完全成熟的叶片的中部原位记录,取6株幼苗分别测量参数,并计算平均值[22]。
1.4 数据处理
实验数据统计分析采用Microsoft Excel 2013进行原始数据处理,用SPSS 16.0分析软件进行方差分析,采用Duncan法进行多重比较及差异显著性检验(α=0.05),图表中数据为平均值±标准误,采用Origin 8.0进行图表绘制。
2 结果与分析
2.1 外源钙对盐胁迫下单叶蔷薇种子萌发的影响
单叶蔷薇种子经过酸蚀处理后种皮厚度降低,其形态如图1所示。在不同浓度的NaCl胁迫下,其萌发率差异显著(表1)。随着NaCl浓度的上升,单叶蔷薇的萌发率显著降低。处理5所示当NaCl浓度为100 mmol·L-1时,单叶蔷薇种子萌发受到明显的抑制,与处理1比下降了42%。处理8所示NaCl浓度为150 mmol·L-1时单叶蔷薇种子的萌发率与处理1相比下降了53%。在100 mmol·L-1浓度的NaCl下,施加浓度为10 mmol·L-1及20 mmol·L-1的CaCl2后,单叶蔷薇种子的萌发率显著提升(P<0.05),与处理5相比分别上升了17.2%,9.8%;当NaCl的浓度为150 mmol·L-1时,施加10 mmol·L-1以及20 mmol·L-1的CaCl2单叶蔷薇种子的萌发率较处理8分别提升了17.8%,8.9%,但二者无显著性差异。

图1 酸蚀处理后单叶蔷薇种子的形态Fig.1 Seed morphology of Hulthemia Berberifolia after acid etching注:图a、b为自然生境下单叶蔷薇种子;c、d为浓硫酸处理1 h后单叶蔷薇种子Note:figure a and b show the seeds of Hulthemia Berberifolia in natural habitat;figure c and d are Hulthemia Berberifolia seeds treated with concentrated sulfuric acid for 1 h

表1 外源钙对盐胁迫下单叶蔷薇萌发率的影响Table 1 Effects of exogenous calcium on germination rate of Hulthemia berberifolia under NaCl stress
2.2 外源钙对盐胁迫环境下单叶蔷薇幼苗根茎生长的影响
由图2可知,在无外源钙施加的情况下,随着NaCl盐胁迫强度的增加,单叶蔷薇幼苗的根茎长度受到较为明显的抑制作用,表现为幼苗的根茎长度显著低于对照(P<0.05)。通过对不同浓度NaCl胁迫下的观察可知,当NaCl的浓度为100 mmol·L-1和150 mmol·L-1时,施加浓度为10 mmol·L-1以及20 mmol·L-1的CaCl2对蔷薇幼苗根茎的生长所受到的抑制有明显的缓解作用(P<0.05),且10 mmol·L-1CaCl2的效果更好,表现为在NaCl的浓度为100 mmol·L-1时,根茎长度较胁迫下幼苗的根茎长度分别增加了27.7%,33.4%,NaCl的浓度为150 mmol·L-1时,根茎长度分别增加了41.7%,25.4%(P<0.05)。
2.3 施加外源钙对盐胁迫下单叶蔷薇幼苗叶绿素荧光参数的影响
由图3可知,随着NaCl浓度增高,Fv/Fm呈现出显著降低的趋势(P<0.05)。当NaCl的浓度为150 mmol·L-1时,施加CaCl2后Fv/Fm显著上升,且施加浓度为10 mmol·L-1的CaCl2的效果显著高于施加浓度为20 mmol·L-1的CaCl2(P<0.05);由图3可知,YⅡ对盐胁迫的响应明显,随着NaCl的浓度的增加呈显著降低的趋势(P<0.05),当NaCl的浓度为150 mmol·L-1时,施加浓度为10 mmol·L-1的CaCl2的效果显著高于施加浓度为20 mmol·L-1的CaCl2(P<0.05)。

图2 外源钙对NaCl胁迫下单叶蔷薇幼苗根长、茎长的影响Fig.2 Effects of exogenous calcium on root length and stems length of Hulthemia berberifolia seedlings under NaCl Stress注:图中数值为平均值±标准差,图中不同小写字母表示不同NaCl与CaCl2浓度处理间显著差异(P<0.05),下同Note:The values in the table are mean±standard deviation,Different lowercase letters in the figure indicate significant differences between different concentrations of NaCl and CaCl2treatment at the 0.05 level,the same as below

图3 外源钙处理对盐胁迫下单叶蔷薇幼苗叶绿素荧光的影响Fig.3 Effects of exogenous calcium on Chlorophyll Fluorescence of Hulthemia berberifolia Seedlings under Salt Stress
2.4 外源钙对盐胁迫下单叶蔷薇幼苗叶片中的光合色素含量
由表2可知,随着盐胁迫强度的增加,单叶蔷薇幼苗中的光合色素的含量呈下降趋势,当NaCl的浓度为150 mmol·L-1时效果最为显著(P<0.05);当NaCl的浓度为50 mmol·L-1时,叶绿素总含量较对照相比下降了18.1%;当NaCl的浓度为100 mmol·L-1时,叶绿素总含量较对照相比下降了28.9%。外源钙的施加缓解了盐胁迫对光合作用的抑制,10 mmol·L-1的CaCl2效果优于20 mmol·L-1的CaCl2,具体表现为较同等胁迫下叶绿素及类胡萝卜素分别上升了20.9%,17.1%。当NaCl的浓度为150 mmol·L-1时,叶绿素总含量较对照相比下降了50.2%,施加10 mmol·L-1的CaCl2后较同等胁迫下叶绿素及类胡萝卜素分别上升了33.7%,16.7%(P<0.05)。
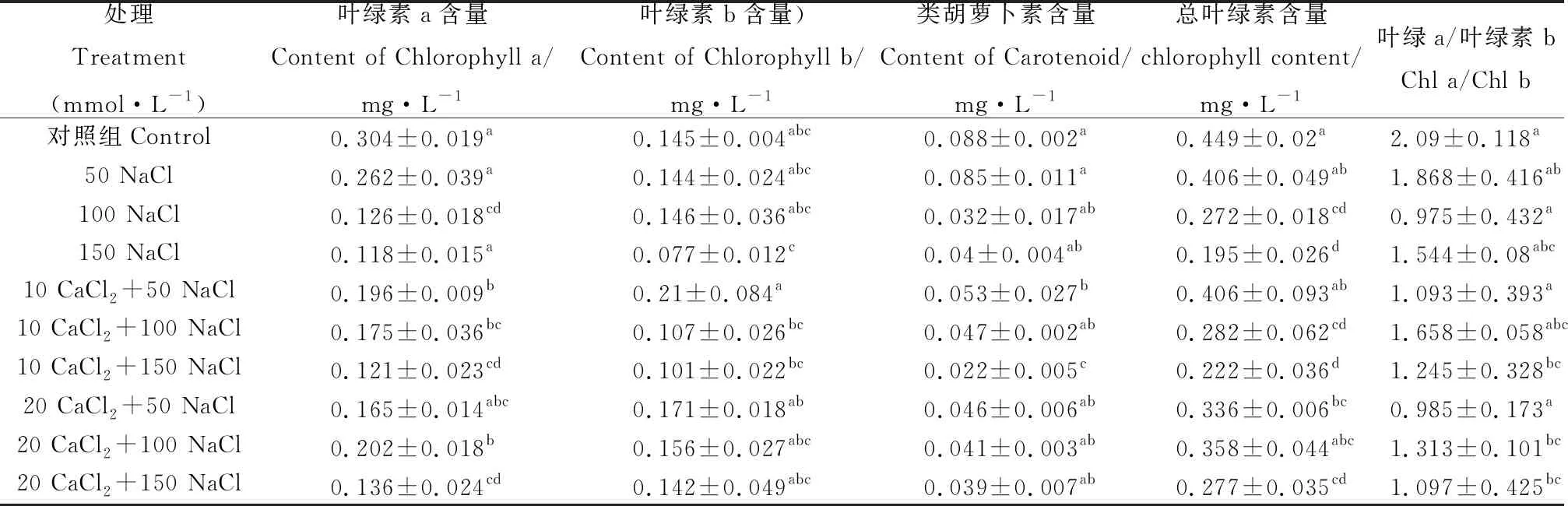
表2 外源钙对盐胁迫下单叶蔷薇幼苗的光合色素含量的影响Table 2 Effects of CaCl2 on the photosynthetic pigment content in the Hulthemia berberifolia seedlings under salt stress
2.5 外源钙对盐胁迫下单叶蔷薇幼苗抗氧化酶活性和H2O2含量的影响
由图4可知,在受到盐胁迫后,单叶蔷薇幼苗中POD、SOD和CAT的活性显著升高,但随着胁迫强度的增加,POD、SOD和CAT活性呈先增后降的趋势,且在NaCl浓度为100 mmol·L-1时三种酶的活性最高(P<0.05);在该浓度下,施加浓度为10 mmol·L-1的CaCl2后单叶蔷薇幼苗POD、SOD和CAT活性与未施加相比分别提升22.3%,9.9%,17.3%。NaCl浓度为100 mmol·L-1时,施加浓度为10 mmol·L-1的CaCl2后单叶蔷薇幼苗中三种酶的活性显著高于施加20 mmol·L-1的CaCl2时的酶活性(P<0.05)。此外,过氧化氢的含量随着NaCl浓度的增加而呈现显著上升趋势(P<0.05)。

图4 外源钙对盐胁迫下单叶蔷薇幼苗氧化酶活性和H2O2含量的影响Fig.4 Effects of exogenous calcium on oxidase activity and H2O2 Content of Hulthemia berberifolia seedlings under salt stress
2.6 主成分分析
采用主成分分析法(PCA)研究了外源钙对盐胁迫下单叶蔷薇种子萌发、生长及幼苗生化指标的影响,结果如图5所示。主成分别为主成分1(PC1)解释了总变异性的58.4%和主成分2(PC2)解释了总变异性的27.3%。从各组样本之间的总体分布结果可以得到,在PC1的方向上,无CaCl2添加的情况下,盐胁迫被很好的分离开,NaCl浓度越高对单叶蔷薇种子及幼苗的作用越明显:在PC2的方向上可得,当NaCl浓度确定时,施加浓度为10 mmol·L-1的CaCl2的效果优于施加20 mmol·L-1的CaCl2,且根据二者在PC2的方向上的分布情况进行比对,确定CaCl2的浓度为10 mmol·L-1效果最好。
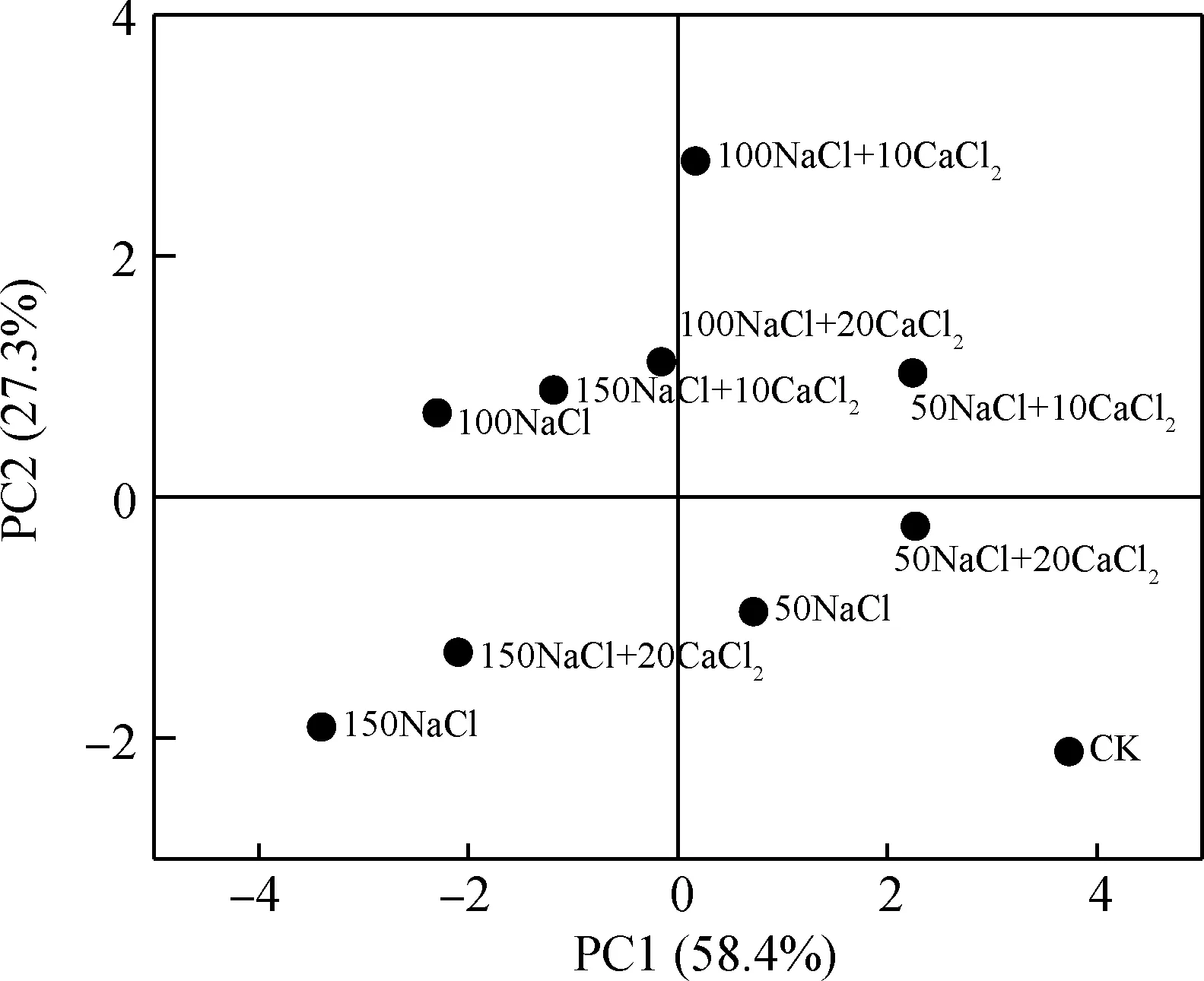
图5 主成分分析法(PCA)对不同处理下单叶蔷薇种子萌发、生长及生化指标进行分析Fig.5 The main analysis of Components (PCA) was used to analyze the germination,growth and biochemical indices of different treatments in Hulthemia berberifolia
3 讨论
盐胁迫对种子萌发以及植物生长发育有抑制作用,盐生植物能够在一定程度的盐胁迫下保持其萌发能力,而当盐的浓度超过植物可承受的临界值时,植物的萌发率急剧下降[23]。本研究发现随着盐胁迫强度的增加,单叶蔷薇的萌发率出现明显的下降趋势,且在NaCl的浓度为100 mmol·L-1时显著抑制,Chen等在棉花耐盐性的研究中也报道了类似的结果[24],我们推测该现象发生的原因是由于种子受到盐胁迫后,Na+渗透积累导致原先Na+与Ca2+竞争的平衡被打破,Ca2+信号调节的功能受到抑制,产生离子应力,盐胁迫下产生的毒性累积,从而导致萌发率的下降。Tanveer等发现浓度为100 mmol·L-1的NaCl对番茄的萌发率有明显抑制作用,施加10 mmol· L-1的CaCl2后萌发率有所改善[25]。我们得到了类似的结论,在本研究中当NaCl的浓度为100 mmol·L-1和150 mmol·L-1时,外源钙的施加对单叶蔷薇种子的萌发率有明显的提升作用,且CaCl2浓度为10 mmol·L-1时对萌发率的影响最明显,效果优于20 mmol·L-1,该结果可能是由于Ca2+通过增强抗氧化酶的活力和离子稳态系统进而提高植物耐盐的能力。NaCl的浓度为50 mmol·L-1时,外源CaCl2的施加未对种子的萌发率造成显著影响,反而降低了种子的萌发率,我们推测该结果可能是由于在低浓度盐胁迫下施加外源钙反而对种子的萌发起到抑制作用。
研究表明,植物的根和茎会受到盐胁迫的影响,根和茎的长度可以作为评价盐害合理的指标,其中根系生长比茎生长更容易受到盐害[26]。本研究发现,当NaCl的浓度为100 mmol·L-1和150 mmol·L-1时,施加外源钙对单叶蔷薇幼苗根茎所受到的盐胁迫有缓解作用,根对于外源钙的敏感程度大于茎,且CaCl2的浓度为10 mmol·L-1时缓解效果最好。Mulaudzi等人的研究表明盐胁迫下施加外源钙增加了高粱幼苗根茎的长度,且低浓度的钙对盐胁迫的改善作用更加明显[27],我们得出相类似的研究结果。我们推测这可能是由于盐胁迫下植物根系外部水势改变,导致离子水平的失衡,根系生长受到抑制,植株获取养分以及水分运输的能力受到阻碍,进而影响单叶蔷薇茎的生长;而盐胁迫下Na+与Cl-的累积对Ca2+产生抑制作用,植株的生长发育产生受到显著影响,外源CaCl2的施加有利于恢复Na+与Ca2+之间的离子平衡,进而缓解盐胁迫的危害。
Fv/Fm是光系统Ⅱ(PSⅡ)最大光化学量子效率,是PSⅡ光能最大利用效的直接体现。而光的实际量子(YⅡ)反映了光照下PSⅡ反应中心部分关闭时的实际光吸收效率以及PSⅡ反应中心的开启程度,其值可以直接体现光合能力的强弱[28]。杨玉平等人的研究表明,非生物胁迫会对植物的光合系统结构造成损伤,而荧光叶绿素参数的变化能够间接的判断其损伤的程度[29]。研究结果表明正常情况下单叶蔷薇幼苗的Fv/Fm约为740,Fv/Fm及YⅡ在受到盐胁迫后显著降低,Helena等人的研究同样显示在100,200和300·L-1的NaCl浓度下,芝麻菜的最大光化学量子效率显著降低[30]。这可能由于盐胁迫破坏光反应中心,产生有毒物质、降低光合酶活性以及叶绿体的损伤有关。研究结果发现经外源钙处理后的单叶蔷薇幼苗Fv/Fm以及YⅡ值上升,缓解了盐胁迫对单叶蔷薇幼苗光合能力的损伤。王静静等人的研究显示中度盐胁迫下施加适宜浓度的外源钙能够提升沙拐枣的最大光化学效率[31],我们得出类似的结果。Nomura等的研究表明Ca2+转运蛋白在植物外部胁迫因子的反应中起到重要作用,其相关的受体则存在于叶绿体中[32];我们推测外源钙的施加提升了Ca2+的浓度,增强了信号转导的能力,在盐胁迫下起到积极的调控作用,进而减缓了盐胁迫对叶绿体的损伤。
光合作用是植物生长发育中非常重要的过程,但对盐分的含量高度敏感,高浓度的盐分会导致植物光合作用的产量降低。类胡萝卜素作为一种抗氧化剂,能够对光合系统进行保护,光合色素含量的变化是植物所面临的环境的一种对策,也是用来评估植物耐盐性的一项重要指标[33]。本研究发现,随着盐胁迫强度的增加,单叶蔷薇幼苗的光合能力受到影响,光合色素的含量呈下降的趋势,这也与Hoang等关于盐胁迫对红苋菜光合色素含量影响的研究结果相类似[34]。这一结果出现的原因可能是由于盐胁迫,单叶蔷薇幼苗活性氧含量增加造成叶绿素酶的激活,叶绿素的降解以及叶绿素a和b含量的减少,叶绿体受到损伤而导致的。Ashraf等的研究结果表明外源钙的施加对盐胁迫下绿豆光合系统的损伤起到一定的缓解作用[35]。本研究的结论显示施加外源钙显著提升单叶蔷薇幼苗中叶绿素总含量及类胡萝卜素含量。这可能与Ca2+对维持细胞膜的稳定性起着重要的作用有关,外源钙的施加加强了叶绿体细胞膜的稳定性,避免其被叶绿素酶降解,从而提升了光合色素的含量。
当植物处于盐胁迫的状态下,会产生活性氧对植物造成伤害,而作用于活性氧的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)的活性并非与活性氧的含量呈线性相关[23]。本研究表明,当盐浓度上升时,POD、SOD和CAT的活性逐渐上升,在NaCl为100 mmol·L-1时抗氧化酶的活性最高,随着NaCl浓度继续上升,POD、SOD和CAT的活性呈现下降的趋势。该结果可能是由于高浓度的盐抑制了抗氧化酶的活性,从而造成H2O2累积。Abbas等人的研究表明外源钙在缓解盐胁迫的过程中通过维持POD和CAT的活性来缓解ROS损伤[36]。我们的结果同样表明当NaCl的浓度为100 mmol·L-1和150 mmol·L-1时,施加外源钙后POD、SOD和CAT的活性有明显的提升,且CaCl2的浓度为10 mmol·L-1时效果最为明显。前人的研究表明,外源钙能够增强质膜ATP酶活性以及提升细胞的排钠能力[37]。我们认为外源钙对抗氧化酶活力的影响是由于在盐胁迫下外源钙的施加提升了细胞的排钠能力,Na+的毒性降低,抗氧化酶活性上升。在盐胁迫下,细胞内活性氧的含量会上升,产生过量的H2O2对组织细胞造成损害,甚至导致细胞死亡。本研究发现随着盐胁迫强度的增加,单叶蔷薇幼苗内过氧化氢的含量显著上升,Ren等发现盐胁迫下小白菜内H2O2含量显著上升,这一现象与我们的研究结果相类似[38]。盐胁迫下施加外源钙后单叶蔷薇幼苗内H2O2的含量显著降低,这一结果可能是由于施加外源钙后细胞内抗氧化酶的活性上升进而将细胞内的H2O2还原成水,从而降低对细胞的侵害。
4 结论
本研究表明,盐胁迫抑制单叶蔷薇的种子萌发、幼苗生长,施加适宜浓度的外源钙能够缓解盐胁迫所造成的伤害,盐胁迫下施加适宜浓度的外源钙可以提升单叶蔷薇种子的萌发率,促进了幼苗根和茎生长,增加单叶蔷薇幼苗内光合色素以及光合指标Fv/Fm、YⅡ的含量,显著提高抗氧化酶的水平,进而缓解盐胁迫对单叶蔷薇的伤害。在对单叶蔷薇不产生抑制作用以及毒性的前提下,外源CaCl2的最适浓度为10 mmol·L-1。本研究阐述了外源钙在盐胁迫下的积极作用,有助于单叶蔷薇资源的开发及保护。

