高盐稀态酱油发酵优势真菌与风味物质相关性分析
阮志强,董玺梅,蒋雪薇,2,*,邹世东,杨俊文,张 伟,吴 灿,方勤军
(1.长沙理工大学食品与生物工程学院,湖南 长沙 410114;2.湖南省调味品发酵工程技术研究中心,湖南 长沙 410600;3.加加食品集团股份有限公司,湖南 长沙 410600)
酱油又称“清酱”或“酱汁”,是我国传统的调味品。是以蛋白质原料和淀粉质原料为主,经微生物发酵作用,酿造而成的色香味协调、营养物质丰富的调味食品。酱油发酵除了是蛋白质、淀粉等大分子物质降解成氨基酸、多肽及各种糖的过程外,还是各种微生物代谢作用产生酸、醇、醛、酯、酚、酮等与酱油风味密切相关物质的过程。酱油酿造是复杂微生物菌群作用的结果,米曲霉以外的其他有益微生物通过自然接种到酱醪中,在它们的作用下,得到了多种代谢产物,形成了酱油特殊的风味。已分析证明酱油中含有的挥发性风味物质超过1 000 种,分属13 大类,除一少部分来源于酿造原料外,大部分是微生物代谢作用生成。而有害微生物在酱油酿造过程中形成污染后,则会使酱油出现酸馊味、胀气等变质现象。因此,探索并解析酱油酿造中微生物群落结构,探讨酱油发酵过程中微生物变化规律,将为构建酱油酿造优势菌群提供理论依据,有利于酱油发酵机制的研究及质量控制。
酱油酿造过程中的真菌主要是米曲霉以及一些耐盐酵母。米曲霉具有丰富的酶系,可以分解原料中的大分子物质,不仅为耐盐酵母提供生长所需,还提升了酱油的风味。耐盐酵母能够在酱油酿造过程中代谢产生酯、醇、醛、酸、酚、酮等丰富的风味物质,对酱油风味的形成具有重要作用。真菌在酱油发酵中起了提高原料利用率、生成呈味物质及生香作用,其群落结构的变化将会影响酱油主要风味物质的形成,因此,研究酱油发酵过程中真菌群落结构变化是构建有益优势真菌菌群的基础。采用高通量测序技术研究高盐稀态酱油发酵过程中真菌多样性及群落结构变化,结合发酵过程品质指标及挥发性风味物质分析,探讨真菌群落结构变化与酱油风味物质形成的相关性,将为高盐稀态酱油重要风味物质的形成及品质的提升奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
高盐稀态发酵酱醪样品,豆粕-小麦质量比为7∶3,采自湖南某酱油厂。
酱醪发酵周期为6 个月,在发酵过程中不额外添加风味菌。以成品曲加盐水入罐开始记为0 个月,从0 个月入罐发酵至6 个月出罐,每隔1 个月取一次样品,分别记为S0~S6。取样前对发酵罐内酱醪样品进行通气搅拌,取混合均匀的酱醪样品约500 mL,冰袋冷藏运回实验室保存在-80 ℃低温冰箱中备用。
1.1.2 培养基与试剂
孟加拉红培养基 广东环凯微生物科技有限公司;E.Z.N.A.Soil DNA Kit 美国Omega BioTek公司;NEXTFLEX Rapid DNA-Seq Kit 美国Bioo Scientifci公司;AxyPrep DNA Gel Extraction Kit 美国Axygen Scientific公司;MiSeq Reagent Kit v3 美国Illumina Scientifci公司;2-甲基-3-庚酮 德国Dr.Ehrenstorfer公司。
1.2 仪器与设备
5424R高速台式冷冻离心机 德国Eppendorf公司;NanoDrop2000超微量分光光度计 美国Thermo Fisher Scientific公司;ELx800酶标仪 美国BioTek公司;Quantus™ Fluorometer微型荧光计 美国Promega Scientific公司;DYYY-6C电泳仪 北京六一仪器厂;GeneAmp9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;Illumina MiSeq测序仪美国Illumina Scientific公司;436 GC/EVOQ TQ/PAL气相色谱-质谱联用仪 美国Bruker Daltonics公司;DB-5MS色谱柱 美国Agilent公司;50/30 μm DVB/CAR/PDMS固相微萃取针 美国Supelco公司。
1.3 方法
1.3.1 真菌总数测定
参照GB 4789.15—2016《食品微生物学检验 霉菌和酵母计数》的方法。
1.3.2 还原糖、氨基酸态氮及总酸的测定
还原糖测定:参照GB 5009.7—2016《食品中还原糖的测定》直接滴定法;总酸测定:参照GB 5009.235—2016《食品中氨基酸态氮的测定》氢氧化钠滴定法;氨基酸态氮测定:参照GB 5009.235—2016《食品中氨基酸态氮的测定》甲醛滴定法。
1.3.3 高通量测序分析
1.3.3.1 真菌总DNA提取及PCR扩增定量
采用E.Z.N.A.Soil DNA Kit试剂盒对酱醪中真菌的总DNA进行提取,然后通过NanoDrop 2000分光光度计检测提取DNA浓度,琼脂糖凝胶电泳确定DNA完整性后,置于-20 ℃保存备用;分别使用ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS2R(5’-GCTGCGTTCTTCATCGATGC-3’)对ITS1区基因进行PCR扩增。
PCR扩增体系为5×FastBuffer 4 μL、2.5 mmol/L dNTPs 2 μL、5 µmol/L Forward Primer 0.8 μL、5 µmol/L Reverse Primer 0.8 μL、FastPolymerase 0.4 μL、Template DNA 10 ng,用ddHO补齐至20 μL。PCR程序为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,循环30 次;最终72 ℃延伸10 min。每个样本进行3 个PCR重复,将3 个重复PCR产物混合;使用1%琼脂糖凝胶电泳检测产物,确定其在250~500 bp有条带后,利用AxyPrep DNA Gel Extraction Kit进行回收产物纯化,并用QuantusFluorometer对回收产物进行检测定量。
1.3.3.2 高通量测序与数据分析
样本的建库和测序由上海美吉生物医药科技有限公司完成。针对真菌ITS1F_ITS2R区序列,设计带barcode标签的特异引物,测序平台为Illumina MiSeq PE300。根据测序序列barcode和引物区分样品,使用Trimmomatic软件对原始测序序列进行质控,使用FLASH软件进行拼接。按照获得的最小样本序列数对测序样品进行抽平,使用UPARSE软件以97%的相似度对抽平后的序列进行可操作分类单元(operational taxonomic unit,OTU)聚类,使用UCHIME软件剔除嵌合体。利用RDP classifier对序列进行物种分类注释,比对Unite数据库(真菌ITS数据库),阈值设为70%。根据样品的OTU及序列关系,采用Mothur软件对样品进行多样性分析,计算各种物种多样性指数,衡量样本物种多样性。每个样品测定3 个平行,测序结果取均值用于下一步分析。
1.3.4 挥发性风味物质检测
采用顶空固相微萃取-气相色谱-质谱(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)联用技术检测分析酱油中挥发性风味物质,每个样品平行测定3 次。
HS-SPME条件:取压榨酱油,添加5 μL 0.816 μg/μL 2-甲基-3-庚酮的甲醛溶液作为内标物,总体积为2 mL,在50 ℃加热振荡样品20 min,萃取头萃取20 min后进样;GC条件:进样口温度250 ℃,解吸5 min,程序升温条件为40 ℃保持4 min,以5 ℃/min升温至120 ℃,保持2 min,以7 ℃/min升温至230 ℃,保持2 min,载气为高纯氦气,载气流速为1.0 mL/min,不分流进样;MS条件:电子电离源,电子能量为70 eV,发射电流为200 μA,传输线和离子源温度为250 ℃,离子碎片质量扫描范围为/40~500。
挥发性化合物定性分析:采用NIST 14谱库进行检索比对,再根据保留时间和标准质谱比对确定物质结构。
挥发性化合物质量浓度计算如下式所示:
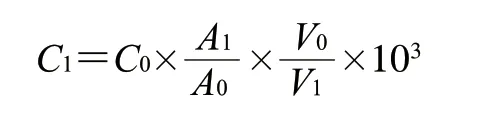
式中:为挥发性物质质量浓度/(mg/L);为内标物质量浓度(0.816 μg/μL);为挥发性物质峰面积;为内标物峰面积;为酱油的体积/mL;为添加内标物的体积/μL。
1.4 数据分析
采用SPSS 22软件对数据进行处理,相关性分析采用双变量Pearson检验,显著性水平设为5%,Origin 2021绘图;挥发性风味物质含量数据经标准化处理后,TBtools软件进行热图绘制。
2 结果与分析
2.1 高盐稀态酱油发酵过程中真菌总数、还原糖、氨基酸态氮及总酸变化
酱油发酵中的真菌主要有霉菌及酵母,米曲霉是酱油发酵的主要菌种,在酱油发酵过程中起着将蛋白质及淀粉降解的作用,而酵母多在酱油发酵中后期出现,对酱香风味有比较重要的贡献,因此,发酵过程中存在一定数量的真菌对于酱油的品质有重要的作用。对高盐稀态酱油发酵过程中真菌进行计数(图1),结果显示,入罐发酵(0 个月)时酱醪样品的真菌数量最高,为7.8×10CFU/g(酱醪质量计,下同),随着发酵的进行,真菌数量呈下降趋势,发酵结束时为5.8×10CFU/g,说明随着发酵的进行,酱醪中的真菌死亡速率高于生长速率。发酵2~3 个月,真菌数量速率趋缓,这时的酱醪发酵真菌适应了盐卤发酵,生长速率仅略低于死亡速率;而经过3~4 个月的快速下降后,4~6 个月又出现了真菌数量的稳定,说明在发酵中后期,耐盐酵母的生长使酱醪中的真菌数量达到了动态平衡。
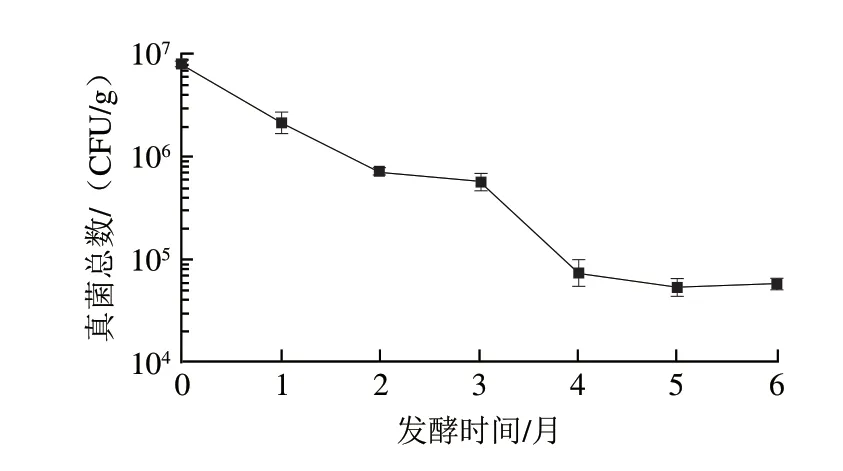
图1 高盐稀态酱油发酵过程中真菌总数变化Fig.1 Variation in the number of fungi during the fermentation of high-salt liquid-state soy sauce
酱油发酵过程中的糖类物质来源于原料中的淀粉降解,糖类物质除了为酱油提供甜味外,还是酱油风味物质的碳架来源,对酱油风味物质积累及灭菌中的美拉德反应极为重要;酱油发酵过程中的氨基酸类物质来源于原料中的蛋白质分解,其中谷氨酸、天冬氨酸等是酱油中呈鲜味物质的主要来源,也是酱油分级的重要指标;酱油发酵过程中的酸类物质是糖类物质发酵的结果,酸类物质能赋予酱油爽口的风味、醇厚感及回甜感,还能与醇类物质形成酯提升酱油的香气。酱油发酵过程中通过分析还原糖、氨基酸态氮和总酸含量变化考察上述3 类物质的变化,因此,还原糖、氨基酸态氮和总酸可以作为衡量酱油品质的重要指标,同时也是监控发酵过程的重要参数。从图2可以看出,发酵1 个月,还原糖、氨基酸态氮都出现了较大速率的增长,其中还原糖达到了峰值47.37 g/L,这是由于在发酵初期,米曲霉产生的淀粉酶、蛋白酶活性较高,酱醪中其他微生物还未形成优势生长,还原糖及氨基酸态氮的生成速率大于消耗速率所致;总酸在此阶段也出现了较大的增长,其原因是酱醪中耐盐细菌开始生长并代谢产生有机酸。发酵1 个月之后,还原糖被微生物消耗利用,含量不断下降,发酵结束时为17.73 g/L;发酵3 个月,氨基酸态氮已达到10.45 g/L,随着微生物对其利用速率的增大,上升趋势变缓,发酵结束时质量浓度为10.72 g/L;还原糖除发酵生成有机酸外,还生成醇、醛类物质等,随着发酵的进行,有机酸与醇类物质酯化,导致了总酸增速减缓,发酵结束时质量浓度为21.68 g/L。
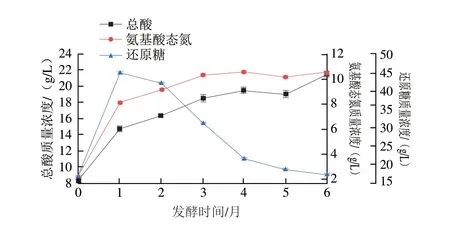
图2 高盐稀态酱油发酵过程中还原糖、氨基酸态氮及总酸的变化Fig.2 Variation in reducing sugars,amino acid nitrogen,and total acid during the fermentation of high-salt liquid-state soy sauce
2.2 高盐稀态酱油发酵过程中真菌α多样性变化
复杂微生物发酵体系的多样性研究有利于探明其菌群结构并实现优化。高盐稀态酱醪也是一个多菌种的发酵体系,真菌在其发酵过程中对于原料的降解以及主要风味物质的积累起着比较重要的作用,因此,研究酱醪发酵体系的真菌多样性,有利于高盐稀态酱油发酵的优化。多样性分析可以表征微生物群落的丰富度和多样性。其中覆盖率是指各样品文库的覆盖率,其数值越高,则样本中序列未被检测出的概率越低;ACE指数和Chao1指数与样品微生物群落的物种丰富度呈正相关,可以反映样品中微生物群落的丰富度;Shannon指数与样品微生物群落的物种多样性呈正相关,而Simpson指数与其相反,可以反映样品中微生物群落的多样性。6 个月发酵周期共计7 个样品的测序数据经过滤和质量控制后,共获得949 843 条有效序列,按照最小样本序列数对所有样品序列进行抽平,以97%的相似度水平对抽平后的序列进行OTU聚类,共获得65 个OTU,每个样品含有的OTU数及多样性指数数据如表1所示。
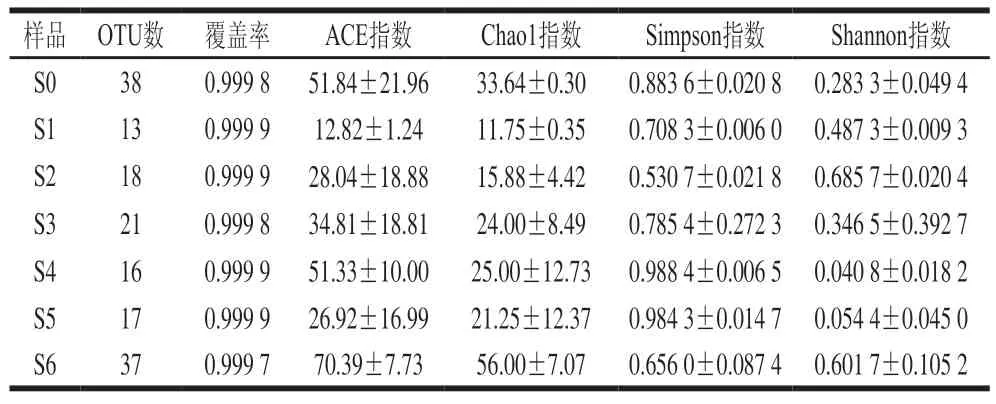
表1 高盐稀态酱油发酵过程中真菌OTU数及α多样性Table 1 OTU number and alpha diversity of fungal community during the fermentation of high-salt liquid-state soy sauce
由表1可知,各个样品的覆盖率均达到了0.999以上,测序样品数据能够代表酱醪样品中真菌群落的真实情况。样品真菌群落物种丰富度和多样性方面,ACE指数和Chao1指数呈现发酵0~1 个月降低、1~4 个月升高、4~5 个月再降低、5~6 个月重新升高直至最高,说明发酵过程中酱醪样品的物种丰富度在波动变化中升高,这应该是由于随着酱油发酵的进行,制曲带入的真菌不适应高盐环境逐渐消亡而耐盐真菌开始生长繁殖所致。从Shannon指数和Simpson指数看,在发酵过程中酱醪样品真菌的物种多样性呈现0~2 个月升高、2~4 个月降低、4~6 个月再升高的趋势。结合图1中真菌数量变化,发酵0~2 个月,真菌总数降低,而物种多样性升高,说明在此阶段制曲时的不耐盐真菌数量开始减少,其他的耐盐真菌开始生长,从而形成了真菌总数降低、物种多样性升高的现象;发酵2~3 个月,真菌总数保持平稳,物种多样性降低,说明前期开始生长的耐盐真菌逐步成为优势菌,而不耐盐真菌则出现消亡,此消彼长保持了真菌总数的平稳,但物种多样性降低;发酵4~6 个月,真菌总数保持平稳,物种多样性重新开始升高,说明在此阶段耐盐真菌出现了多样化,而前期生长的耐盐真菌数量下降,从而形成了真菌总数平稳、物种多样性升高的现象。
2.3 高盐稀态酱油发酵过程中真菌群落结构变化
根据物种分类注释结果,7 个样品共获得30 个真菌科、44 个真菌属,其中S0~S6样品分别获得29、8、13、20、11、13 个和22 个真菌属。选取相对丰度较高的9 个真菌属绘制物种丰度图(图3)。从图3可以看出,在7 个酱醪样品中占据优势地位的真菌分别为曲霉属()、柯达酵母属()、接合酵母属(),3 个真菌属的相对丰度之和均超过了99%。制曲是大量培养米曲霉的工序,成品曲加盐水入罐发酵为0月,此时曲霉属的相对丰度很高,达到了93.85%,随着发酵的进行,高盐环境是曲霉的菌丝萎缩而逐渐消亡,此外在发酵前期酱醪中的产乳酸细菌开始增殖并分泌有机酸,降低了酱醪的pH值,进一步促进了曲霉属的消亡。图中显示曲霉属在1~4 个月占比逐渐降低,分别为82.31%、62.62%、14.28%和0.43%,而4~6 个月则保持相对稳定,这与之前物种多样性结果相符。柯达酵母属的相对丰度变化呈现先升高后降低的趋势,在0月占比为5.17%,发酵1~4 个月占比逐渐增加并达到最大值,分别为17.60%、37.31%、85.64%和99.50%;发酵5~6 个月从99.28%降至20.33%,被中后期生长的耐盐真菌所取代。柯达酵母属被报道能降解生物胺和生产絮凝剂,从生姜猕猴桃酒醅、腌鱼、腐乳等发酵食品中也有分离,还有研究将其作为污染菌从腐烂的泡菜中分离出,但酱醪中分离出柯达酵母属则鲜见报道。接合酵母属在0~4 个月占比较低,相对丰度不超过0.01%,在5~6 个月开始增长,占比从0.40%迅速增至78.12%。接合酵母属中的鲁氏酵母()是酱醪中常见的耐盐酵母,能代谢积累醇类(特别是乙醇),还能通过酯化作用形成多种酯类,丰富酱油的风味,常作为生香酵母应用于酱油发酵。在本批发酵中,接合酵母属出现较晚,仅在最后一个月形成了优势生长,不利于酱油在较短的时间内生香并形成成熟的风味,因此可以考虑在酱油发酵中期(3~4 个月)添加接合酵母以促进酱香风味的形成并缩短发酵周期。此外,假丝酵母属()在样品中也少量存在,在发酵过程中占比均未超过0.3%,有报道埃切假丝酵母()对酱油风味也有贡献。
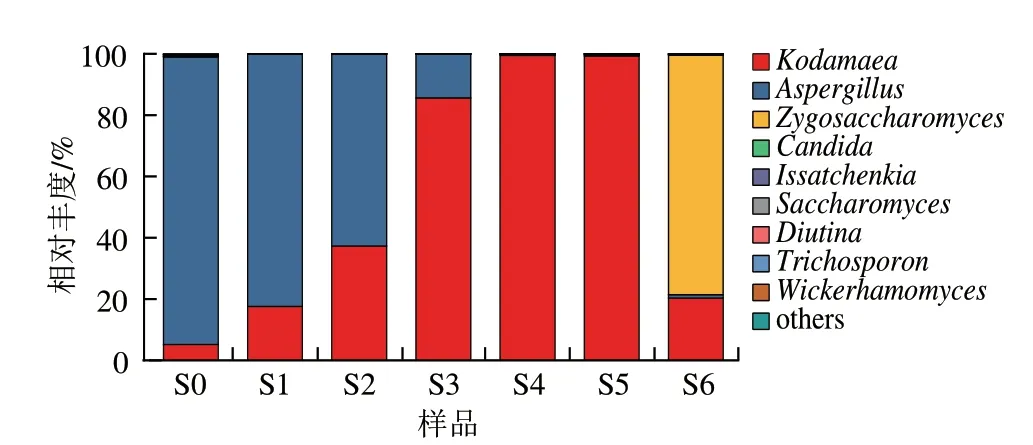
图3 属水平物种丰度图Fig.3 Microbial richness at genus level
2.4 高盐稀态酱油发酵过程中挥发性风味物质变化
利用HS-SPME-GC-MS对高盐稀态酱油发酵过程样品挥发性风味物质进行分析(表2),结果显示,7 个样品共检测出61 种挥发性风味物质,其中酯类物质14 种,醇类物质12 种,酮类物质10 种,醛类物质8 种,酸类物质7 种,酚类物质4 种,其他物质(吡嗪类物质等)6 种。挥发性风味物质总含量在发酵0~1 个月下降,入罐发酵时酱醪样品的挥发性风味物质多来自于原料,随着发酵的进行,原料逐渐被降解利用,因此0~1 个月挥发性风味物质含量下降;发酵1~6 个月总含量逐渐上升,到6 个月发酵结束时,挥发性风味物质总质量浓度最高,为12 404.15 μg/L。其中醇类物质质量浓度最多,为8 826.2 μg/L,主要在发酵5~6 个月积累,这与接合酵母属的变化趋势一致,显示醇类物质的积累与其有密切的关系;酸类物质质量浓度位居第二,为2 349.97 μg/L,其积累从发酵4 个月开始,在发酵结束时达到最高,与发酵过程的总酸趋势比较一致,与酱醪中的细菌有关;醛类物质质量浓度处于第三,为524.18 μg/L,其积累也是从发酵5 个月开始,这与酱醪中的接合酵母属有关;本批发酵酯类、酮类、酚类质量浓度不高,分别为324.81、304.34、69.19 μg/L;酯类物质含量在发酵4 个月达到最大值,发酵5 个月含量骤减,说明酯类物质的产生可能与柯达酵母有关,而发酵后期随着接合酵母形成优势,柯达酵母逐步减少,接合酵母积累的醇类物质也合成了少量酯类,致使发酵6 个月,酯类物质又出现了小幅升高,但结束时总体含量较低;酮类和酚类物质的积累也主要在发酵后期,这些物质占比较低,具有一定的丰富酱油香气的作用。总体看来,本批发酵挥发性风味物质含量不够均衡,与真菌菌群结构形成明显的由米曲霉→柯达酵母→接合酵母的演替有关,且采用豆粕-小麦为7∶3的原料发酵,原料中的碳源较少而氮源丰富,导致发酵前中期酵母类真菌及细菌生长不利,各类挥发性风味物质的大量积累延迟到了发酵5~6 个月。而氨基酸态氮则在发酵3 个月就已达到特级酱油的标准(10 g/L),其主要原因是发酵前3 个月米曲霉为优势菌。根据酱油发酵过程真菌群落结构及挥发性风味物质变化的研究可以发现,挥发性风味物质的积累与菌群结构有着密切的关系,可以通过改变菌群结构达到优化挥发性风味物质的效果。
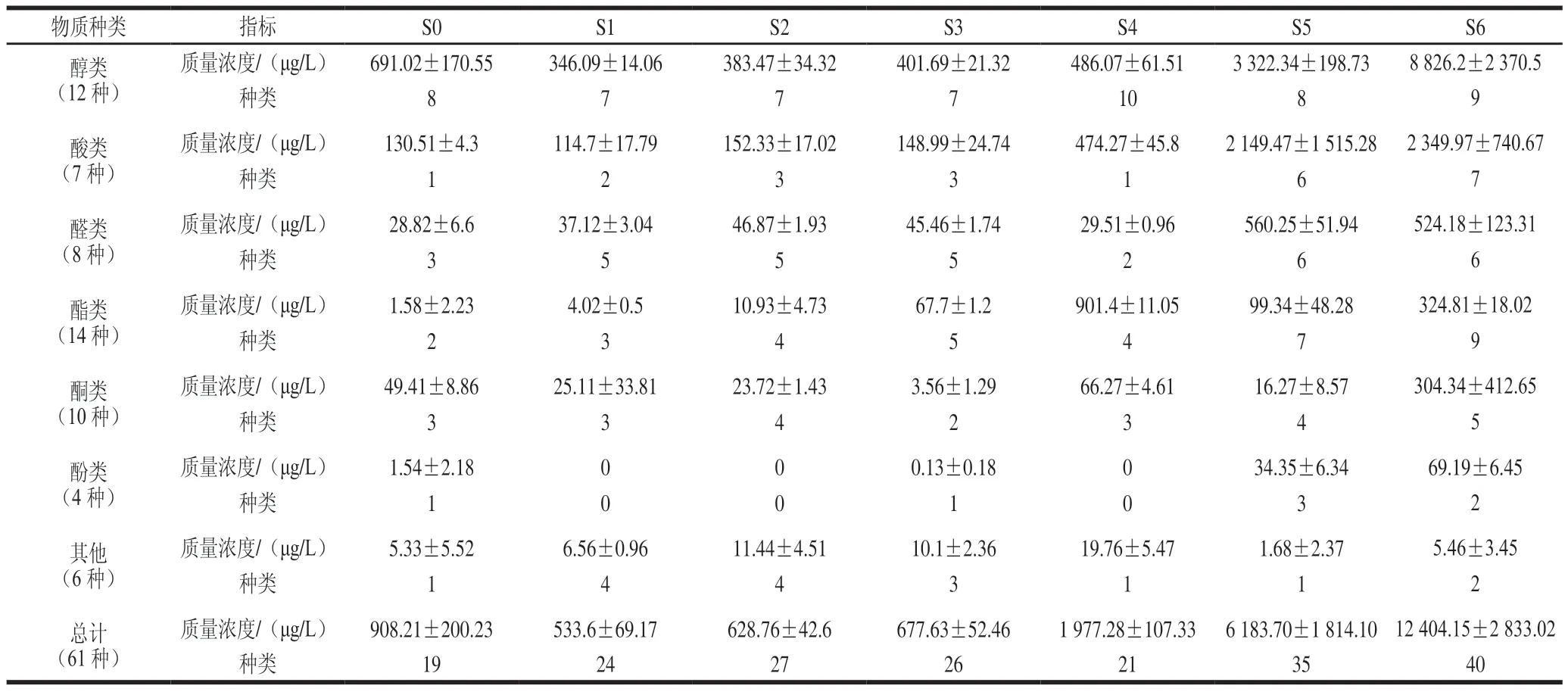
表2 高盐稀态酱油发酵过程中挥发性风味物质变化Table 2 Changes in volatile flavor compounds during the fermentation of high-salt liquid-state soy sauce
2.5 高盐稀态酱油发酵过程中优势真菌与挥发性风味物质变化的相关性
进一步研究各物质与酱醪中真菌菌群的关系,从检测到的挥发性风味物质中选取了香气活性值(odor activity value,OAV)大于1的11 种物质,将其含量标准化数据随发酵时间的变化绘制成热图。由图4可知,对酱油总体风味影响较大的挥发性风味物质多在发酵5、6 个月生成积累,其中影响较大的醇类物质为苯乙醇、3-甲基-1-丁醇、2-甲基-1-丁醇和1-辛烯-3-醇,醛类物质为苯甲醛、苯乙醛、3-甲基丁醛、2-甲基丁醛和癸醛,酯类物质为乙酸乙酯,酚类物质为4-乙基愈创木酚。
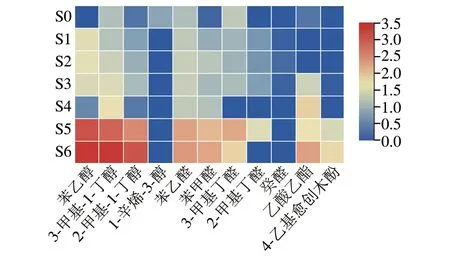
图4 高盐稀态酱油发酵过程中香气活性值大于1的挥发性风味物质含量变化Fig.4 Changes in volatile flavor compounds with odor activity over 1 during the fermentation of high-salt liquid-state soy sauce
利用SPSS软件分析酱醪中优势真菌属与这些物质之间的相关性。由表3可知,柯达酵母属与11 种风味物质均无显著相关性,说明柯达酵母属对酱油风味没有明显促进作用,其在酱油发酵过程中发挥的作用还有待研究。曲霉属与1-辛烯-3-醇呈显著正相关(<0.05),1-辛烯-3-醇具有蘑菇的香气,只在0 个月样品中检测到,另外根据Zhao Jianxin和Lee等的研究,在添加米曲霉发酵的豆酱中均检测到1-辛烯-3-醇,1-辛烯-3-醇可能来源于制曲阶段,推测与酱油制曲中的米曲霉代谢有关。接合酵母属与苯乙醇、3-甲基-1-丁醇、2-甲基-1-丁醇、苯甲醛、乙酸乙酯等多种物质呈显著正相关(<0.05),说明接合酵母属是酱油发酵后期的重要菌属,属于多种风味物质的主要产生菌。
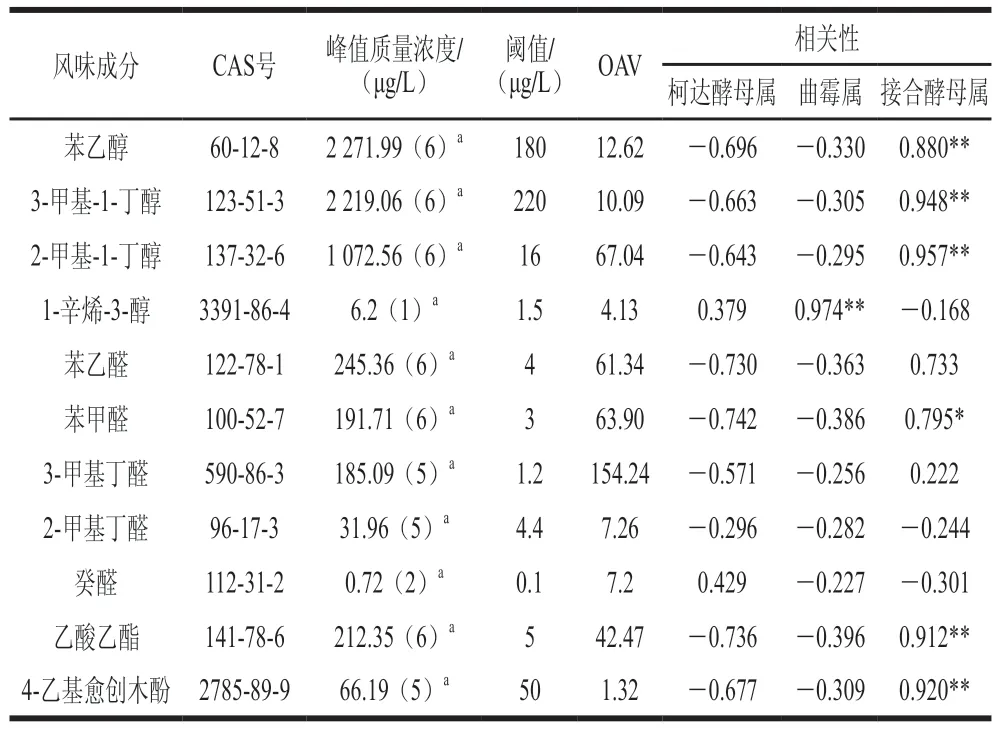
表3 优势真菌与主要风味成分的相关性Table 3 Correlation between dominant fungi and major falvor components
醇类物质主要由酵母菌经过糖酵解途径或Enrlich途径产生,在酱油风味中占有很大的比重,是酱油中醇香风味的主要来源,同时作为酯化反应的前体物质对酯类物质的形成具有重要的作用。苯乙醇具有玫瑰香气,是酵母菌降解苯丙氨酸的产物,3-甲基-1-丁醇具有苹果白兰地香气,2-甲基-1-丁醇具有麦芽香,能赋予酱油香气的浓郁感,与接合酵母属呈显著正相关。小分子醛类物质主要是微生物在碳代谢中产生,含量一般较低,但对酱油香气具有一定调和作用,可赋予酱油清香、果香和坚果香等芳香。苯甲醛具有特殊的杏仁气味,对构成酱香有一定的作用。苯乙醛具有风信子、紫丁香样的香气,3-甲基丁醛具有苹果香气,这两种风味物质具有较高的香气活性值,可由苯乙醇和3-甲基-1-丁醇经过氧化脱氢生成,与3 种优势真菌均无显著相关性。酱油中的酯类物质主要通过由酵母菌产生的酶催化生成,多以乙酯的形式存在,如乙酸乙酯等,在酱油中起着香甜、浓郁而柔和的基底作用,赋予酱油甜香和果香的气味。酚类物质大多具有香气明显的特征,对酱油风味有较大贡献,4-乙基愈创木酚是酱油的特征风味物质,具有典型烟熏气味,与接合酵母属呈显著正相关,目前没有研究报道接合酵母属直接代谢生成4-乙基愈创木酚,可能是由细菌或其他酵母代谢积累。酸类物质主要由乳酸菌等产酸细菌生成,可以将发酵体系转变为偏酸的环境,能在一定程度上抑制杂菌的污染,还可以作为前体物质参与酯类的生成。
3 结论
应用Illumina MiSeq高通量测序技术研究高盐稀态酱油发酵过程真菌群落结构变化及优势真菌,结合随发酵时间变化的酱油重要品质指标还原糖、氨基酸态氮、总酸及挥发性风味物质含量的变化,得出以下结论:1)高盐稀态酱油发酵过程中检出44 个真菌属,其中曲霉属为发酵0~2 个月的优势真菌;柯达酵母属为发酵3~5 个月的优势真菌;接合酵母属在发酵6 个月时占优势地位。2)还原糖含量在发酵0~1 个月快速上升,达到峰值47.37 g/L,随后质量浓度不断降低,发酵结束时为17.73 g/L;与酱油呈味密切相关及酱油分级的重要指标氨基酸态氮含量在发酵0~3 个月快速上升,随后增速放缓,发酵结束时为10.72 g/L;总酸含量在发酵0~3 个月上升较快,4~6 个月增速放缓,发酵结束时为21.68 g/L。3)酱油发酵过程中共分析出61 种挥发性风味物质,发酵结束时总质量浓度为12 404.15 μg/L,其中醇类物质和酸类物质含量较高;对发酵优势真菌与挥发性风味物质进行相关性分析发现,发酵后期出现的优势真菌接合酵母属与多种酯类物质、醇类物质、醛类物质等呈显著正相关,对于酱油风味的形成具有重要的作用,而发酵中期的优势真菌柯达酵母属则显示与挥发性风味物质无显著相关性。
高盐稀态酱油发酵过程中真菌群落结构变化及优势真菌与酱油品质及风味具有比较显著的相关性,因此构建有益的酱油发酵真菌群落将有利于提升酿造酱油品质。

