核桃蛋白的酶解及脱色工艺优化
王 薇,李亚娟,蒋 悦,沈明娟
(1. 赣南卫生健康职业学院,江西 赣州 341000;2. 雪山中心学校,云南 临沧 675906;3. 西南林业大学 生命科学学院,云南 昆明 650224)
核桃(Juglans regia L.)富含油脂、蛋白质及维生素等营养成分,其中蛋白质含量占比 14%~28%,消化吸收率可达85%[1-2]。核桃仁经榨油后的饼粕是潜在的食品蛋白质来源,但因所含蛋白质的加工特性不理想,且色泽较深,限制了其在食品工业上的高值化应用。
酶法水解蛋白质具有反应条件温和、高效、成本低等优点[3]。研究发现核桃蛋白经不同程度酶解后,其溶解度、持水性、乳化性能、起泡性能等加工特性有所提高[4-5],此外,核桃蛋白的抗氧化活性、二肽基肽酶IV抑制肽含量等也显著增加[6-8]。因此,可通过蛋白酶的选择和参数的优化,获得水解度(degree of hydrolysis,DH)较高的蛋白酶解产物,从而达到改善其功能性质的目的。但由于蛋白质经酶解后色泽加深,限制了其在食品工业等领域的应用。活性炭吸附常用于蛋白酶解液的脱色,如焦涵等研究了活性炭对卵黄多肽的最优脱色工艺[9],肖怀秋等优化了活性炭对花生蛋白酶解液的脱色工艺[10],而目前关于核桃蛋白酶解液脱色方面的研究较少,活性炭脱色可能会使蛋白被吸附损失,因此如何控制脱色的工艺条件,以获得理想的脱色率和蛋白回收率,是核桃蛋白酶解液脱色的关键。
本文以核桃饼粕中蛋白质为研究对象,采用单因素和正交实验优化胰蛋白酶水解核桃蛋白的工艺条件,并以脱色率和蛋白回收率为考察指标,优化活性炭对核桃蛋白酶解液的脱色工艺,以期获得优良加工特性的核桃蛋白制品,本文对于核桃产业加工副产物的进一步开发利用具有一定意义。
1 材料与方法
1.1 材料与试剂
冷榨核桃饼:由迪庆香格里拉舒达有机食品有限公司提供。胰蛋白酶(酶活力70 000 U/g)、Folin-酚试剂:索莱宝生物科技有限公司;牛血清蛋白:上海伯奥生物科技有限公司;氢氧化钠、盐酸、活性炭:天津市大茂化学试剂厂。以上试剂均为分析纯。
1.2 仪器与设备
5804R型多功能台式高速冷冻离心机:美国Eppendorf公司;FJ200-SH数显高速分散均质机:上海标本模型厂;UV-2600紫外可见分光光度计:日本岛津公司;F50型酶标仪:瑞士Tecan公司。
1.3 实验方法
1.3.1 工艺流程
冷榨核桃饼→粉碎过筛→碱提酸沉→核桃蛋白→酶解工艺的优化→灭酶(90 ℃, 15 min)→离心→上清液→脱色工艺的优化[11]
1.3.2 核桃蛋白的制备
采用碱溶酸沉法提取核桃蛋白。核桃饼粕经粉碎过60目筛后,按料液比1∶25(W/V)加入蒸馏水,以NaOH溶液调pH至8.7,于48 ℃搅拌提取1 h后,4 000 r/min离心20 min,取上清液以盐酸溶液调至pH 5并在4 ℃静置过夜,按上述条件离心取沉淀洗涤至中性,冻干为核桃蛋白(walnut protein,WP)[12]。
1.3.3 冷榨核桃饼和核桃蛋白主要理化指标的测定
观察冷榨核桃饼、所提取核桃蛋白样品的色泽和形态,其粗蛋白、水分、粗脂肪和灰分含量分别按照 GB 5009.5—2016《食品中蛋白质的测定》、GB 5009.3—2016《食品中水分的测定》、GB 5009.6—2016《食品中脂肪的测定》和 GB 5009.4—2016《食品中灰分的测定》中方法测定。
1.3.4 核桃蛋白酶解单因素实验
称取0.25 g核桃蛋白,控制底物质量浓度为3%(W/V),pH为7.5,酶解温度为55 ℃,加酶量为5 000 U/g,分别酶解1,2,3,4和5 h,经90 ℃,15 min灭酶后,测定相应条件下核桃蛋白酶解液的水解度,考察酶解时间对核桃蛋白水解度的影响。
同时,固定其它酶解参数条件,分别以底物浓度(2%、3%、4%、5%和6%,W/V),酶解温度(45、50、55、60和65 ℃),加酶量(2 500、3 750、5 000、6 250和7 500 U/g)为单因素变量,考察底物浓度、酶解温度、加酶量对核桃蛋白水解度的影响[16]。
1.3.5 核桃蛋白酶解正交实验
根据单因素实验所得结果,以酶解时间、底物浓度、酶解温度、加酶量为影响因素,每个因素选 3个水平,设计 L9(34)正交实验(如表 1所示),以水解度为指标,确定胰蛋白酶酶解核桃蛋白的最优条件。

表1 酶解工艺正交实验因素水平表Table 1 Factor level of enzymolysis orthogonal experiment
1.3.6 水解度的测定
核桃蛋白酶解液的水解度参照公式(1)和(2)计算。其中酶解液的总氮含量采用凯氏定氮法测定,氨基氮的含量采用甲醛滴定法测定,分别称取一定量的两份样品于三角烧瓶,一份加入中性红指示剂2~3滴,用0.100 mol/L NaOH溶液滴定终点,另一份加入麝香草酚酞3滴和中性甲醛20 mL,摇匀,以0.100 mol/L NaOH准溶液滴定至淡蓝色[13]。

式中:DH为酶解液的水解度,%;N为氨基氮含量,%;N0为总氮含量,%。

式中:N为氨基氮含量,%;V1为以中性红为指示剂滴定到终点所消耗的标准NaOH溶液体积,mL;V2为以麝香草酚酞为指示剂滴定到终点所消耗的标准 NaOH溶液体积,mL;W 为样品的重量,g。
1.3.7 核桃蛋白酶解液脱色的单因素实验
取核桃蛋白酶解液50 mL,调pH至4.5,分别添加 0.6%、0.8%、1.0%、1.2%和 1.4%的活性炭(W/V),于45 ℃水浴90 min后,6 000 r/min离心15 min,取上清液测定吸光度值和蛋白质含量,以脱色率和蛋白质回收率为指标,考察活性炭添加量对脱色效果的影响。
同时,固定其它脱色参数条件,分别以 pH(2.0、3.0、4.0、5.0、6.0)、温度(35、40、45、50、55 ℃)、时间(30、45、60、75、90 min)为单因素变量,考察pH、温度和时间对脱色效果的影响。
1.3.8 核桃蛋白酶解液脱色的正交实验
在单因素实验的基础上,选取活性炭用量、pH、温度、时间四个因素进行正交实验,每个因素三个水平,选择 L9(34)正交表进行实验,分别以脱色率、蛋白回收率和加权评分为考察指标,优化核桃蛋白酶解液的脱色工艺,正交实验因素水平表如表2所示。
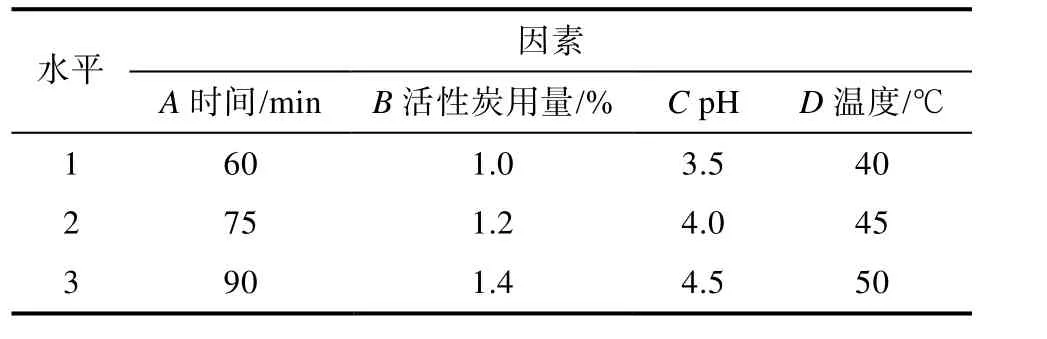
表2 脱色工艺正交实验因素水平表Table 2 Factor level of decolorization orthogonal experiment
1.3.9 核桃蛋白酶解液的脱色评价方法
取一定体积核桃蛋白酶解液,添加 1.2%(W/V)的活性炭,调节pH为4.5,并保温90 min后,于6 000 r/min离心15 min,取上清液分别测定吸光度值和蛋白质含量,根据公式(3)和(4)计算脱色率和蛋白质回收率[14]。采用公式(5)的加权评分法考察酶解液的脱色效果[10,15]。

式中:X为脱色率,%;A0为核桃蛋白酶解液在314.5 nm处的吸光度;A为核桃蛋白酶解脱色液在314.5 nm处的吸光度。

式中:Y为蛋白回收率,%;W1为脱色后蛋白质的含量,mg/mL;W2为脱色前蛋白质含量,mg/mL。

式中:Z为脱色综合评分;X为脱色率,%;Y为蛋白回收率,%。
1.4 数据分析
所有实验重复 3次,正交实验采用 SPSS软件分析,采用OriginPro 2019b 64-bit绘图。
2 结果与分析
2.1 冷榨核桃饼、核桃蛋白的主要物理化学指标
冷榨核桃饼、核桃蛋白的主要物理化学指标如表3所示。相较冷榨核桃饼,所提取的核桃蛋白色泽较浅,粒度较小,粗脂肪、水分和灰分含量低,粗蛋白含量接近90%,说明核桃蛋白样品的纯度较高,可用于下一步的酶解和脱色实验。

表3 冷榨核桃饼及核桃蛋白的主要物理化学指标Table 3 Main physicochemical indicators of cold-pressed walnut meal and WP %
2.2 核桃蛋白酶解单因素水平的确定
2.2.1 加酶量对核桃蛋白水解度的影响
胰蛋白酶添加量对核桃蛋白水解度的影响如图1所示,随着胰蛋白酶添加量的增大(2 500~6 250 U/g),核桃蛋白水解度的增幅较大,而当加酶量继续增加(>6 250 U/g),水解度上升的趋势变缓,因此综合成本等因素,选择胰蛋白酶添加量为6 250 U/g进行下一步实验。

图1 加酶量对核桃蛋白水解度的影响Fig.1 Effect of enzyme dosage on DH of WP
2.2.2 底物浓度对核桃蛋白水解度的影响
底物浓度对核桃蛋白水解度的影响如图 2所示,随着底物浓度的增加(1%~3%,W/V),核桃蛋白的水解度大幅度上升,但当底物浓度达 3%(W/V)后,水解度呈下降趋势,这可能是因为在低底物浓度时,核桃蛋白分散液的流动性好,酶与核桃蛋白更易接触反应,从而使水解度呈上升趋势[17];而当底物浓度>3%(W/V),蛋白分散液的流动性变小,不利于酶的作用,水解度也随之下降。因此,底物浓度宜选取3%(W/V)进行正交实验。
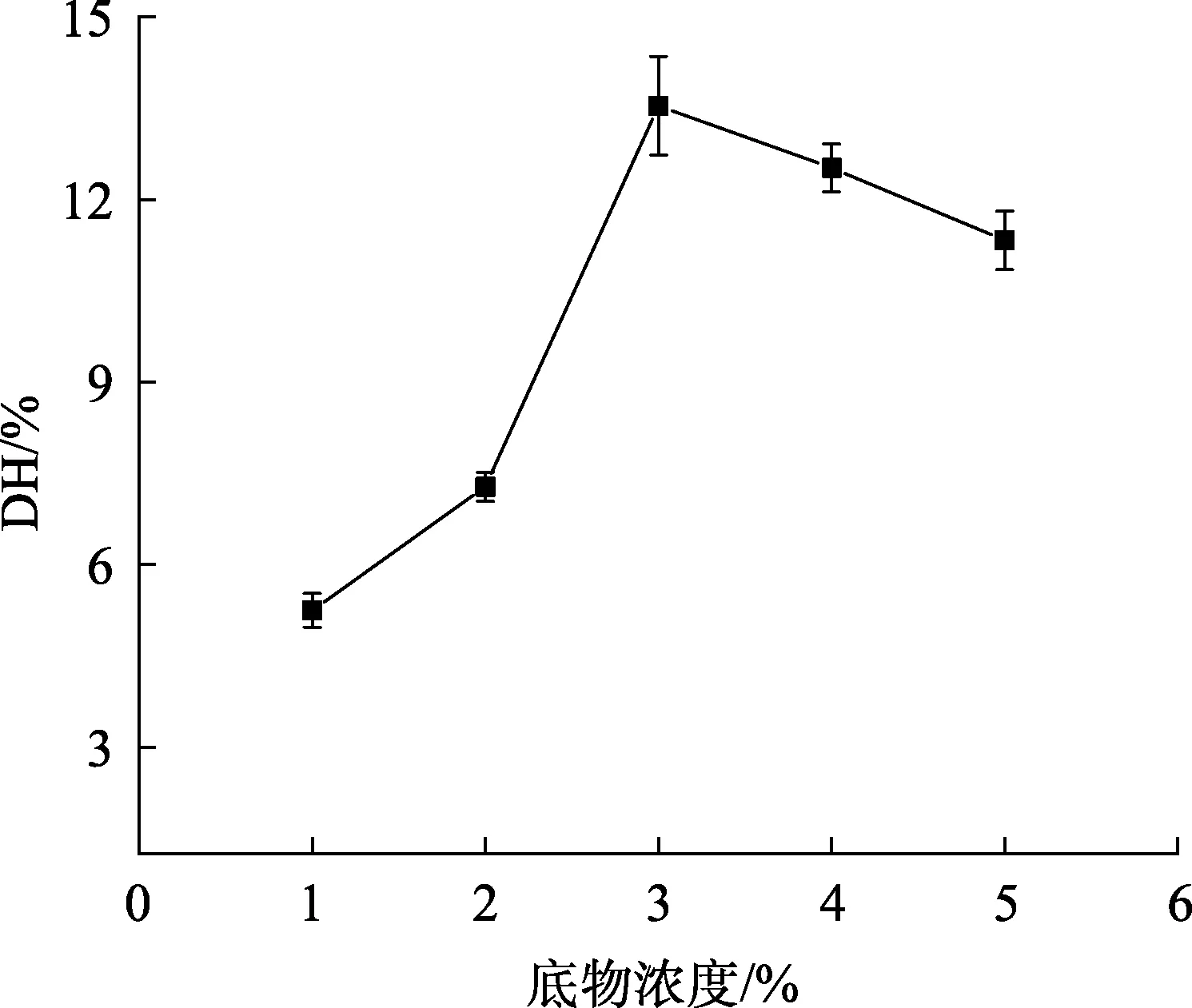
图2 底物浓度对核桃蛋白水解度的影响Fig.2 Effect of substrate concentration on DH of WP
2.2.3 酶解温度对核桃蛋白水解度的影响
酶解温度对核桃蛋白水解度的影响如图 3所示,随着酶解温度的升高(45~55 ℃),核桃蛋白的水解速度随之加快,而当温度升高到一定程度(>55 ℃),酶在高温的作用下变性甚至失活,导致核桃蛋白的水解度下降[18]。因此,选取酶解温度为55 ℃进行下一步优化。
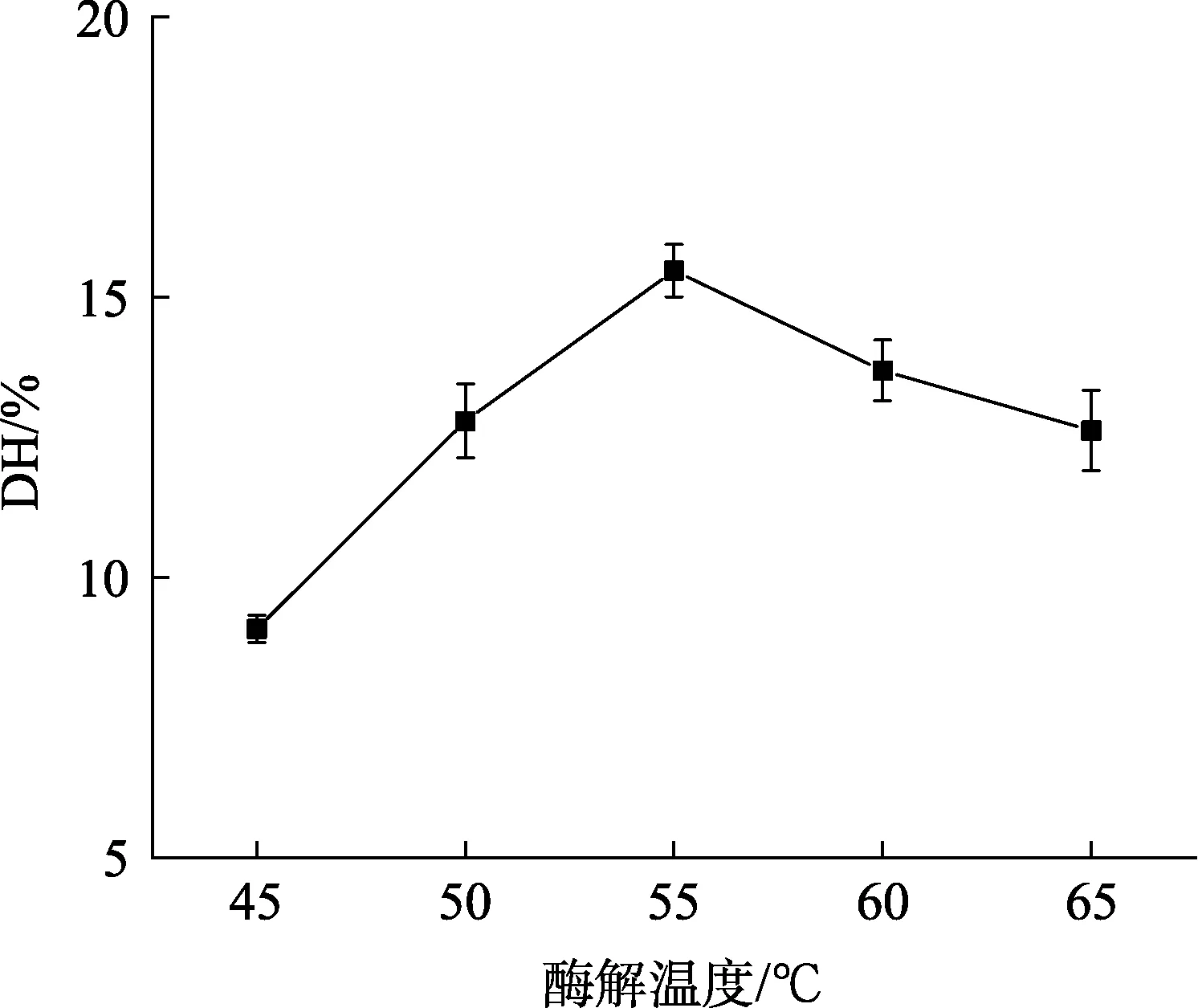
图3 酶解温度对核桃蛋白水解度的影响Fig.3 Effect of enzymolysis temperature on DH of WP
2.2.4 酶解时间对核桃蛋白水解度的影响
酶解时间对核桃蛋白水解度的影响如图 4所示,随着酶解时间的增加,核桃蛋白的水解度一开始呈大幅上升的趋势,而当酶解时间超过 4 h后,水解度增幅减缓,综合考虑生产效率和时间成本,选择酶解时间4 h进行正交实验优化。
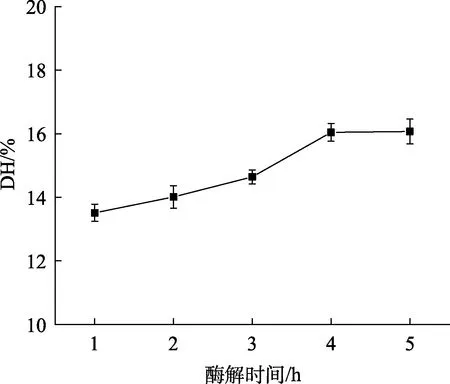
图4 酶解时间对核桃蛋白水解度的影响Fig.4 Effect of enzymolysis time on DH of WP
2.3 正交实验优化核桃蛋白酶解工艺
核桃蛋白酶解的正交实验结果及分析如表 4所示。由极差R可知,影响核桃蛋白酶解的各因素主次顺序为B(底物浓度)> C(温度)> D(加酶量)> A(时间),核桃蛋白的最佳酶解工艺为A3B2C2D2,即底物浓度3%,加酶量6 250 U/g,酶解温度55 ℃,酶解时间5 h,在此条件下核桃蛋白的水解度最大。为避免偶然实验因素造成误差,对优化的酶解工艺进行验证,测得水解度为21.08%,高于表 4中的最大水解度(19.24%),说明 L9(34)正交实验优化的核桃蛋白酶解工艺准确可靠。
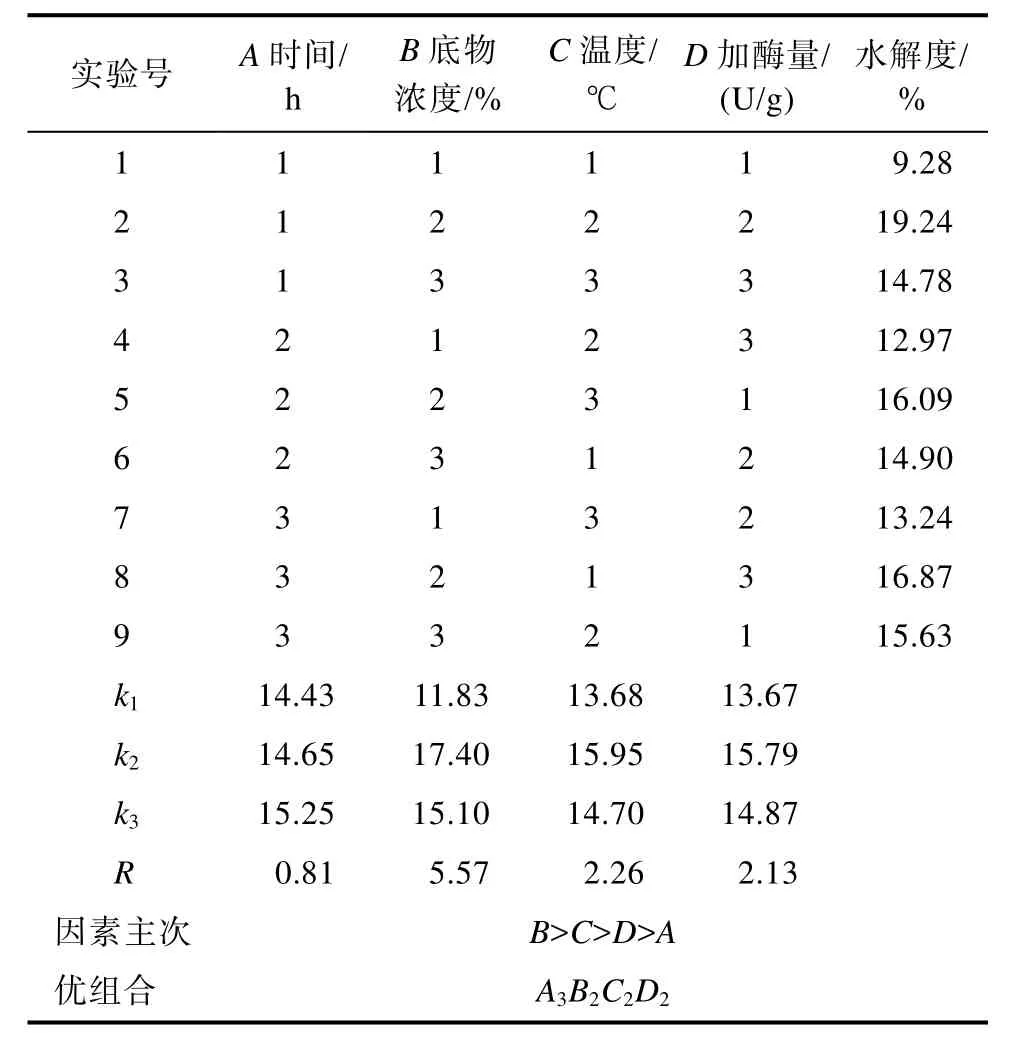
表4 酶解正交实验结果及分析Table 4 Results and analysis of enzymolysis orthogonal experiment
2.4 核桃蛋白酶解液脱色单因素水平的确定
2.4.1 活性炭用量对核桃蛋白酶解液脱色效果的影响
活性炭对核桃蛋白酶解液脱色的单因素实验结果如图5所示。随着活性炭用量的增大,核桃蛋白的脱色率逐渐增大,回收率逐渐减小。这是由于活性炭的用量增大,比表面积也随之增加,可更高效地吸附酶解液中的色素物质,同时,活性炭也会吸附酶解液中的蛋白(肽),导致蛋白含量的降低[19-20]。当活性炭用量为1.2%(W/V)时,脱色率达 68.68%,蛋白回收率为 81.75%,可在保留大部分核桃蛋白的前提下达到较好的脱色效果,因此选择活性炭用量为 1.20%(W/V)进行正交实验。
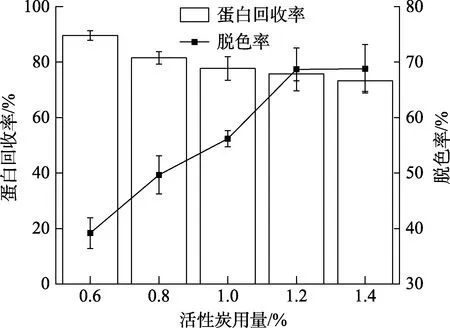
图5 活性炭用量对核桃蛋白酶解液脱色效果的影响Fig.5 Effect of activated carbon dosage on decolorization of WP hydrolytes
2.4.2 pH对核桃蛋白酶解液脱色效果的影响
pH对核桃蛋白酶解液脱色效果的影响如图6所示。当pH值为2.0~3.0时,活性炭对酶解液的脱色率逐渐增大,蛋白回收率逐渐减小;而当pH值为 3.0~6.0时,活性炭对酶解液脱色率逐渐减小,蛋白回收率逐渐增大。可能是因为酶解液中的色素物质在酸性条件下与活性炭有较强的亲和力,因而更容易被吸附脱色,同时,pH的变化也会影响蛋白酶解物的电荷和活性炭的表面化学性质,导致一些小肽被活性炭吸附损失[14]。综合考虑蛋白回收率和脱色率,选择脱色pH值4.0进行下一步实验。
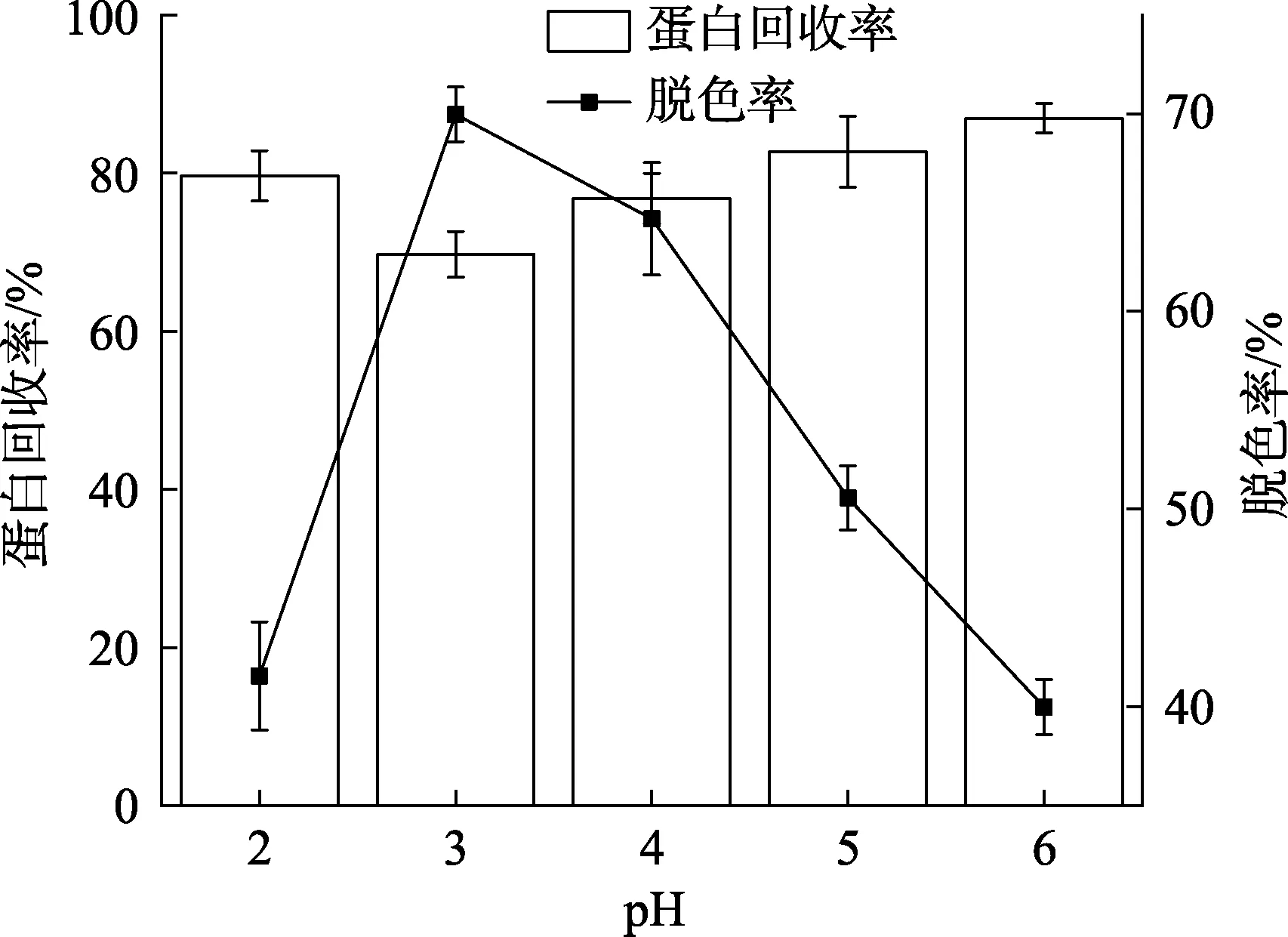
图6 pH对核桃蛋白酶解液脱色效果的影响Fig.6 Effect of pH on decolorization of WP hydrolytes
2.4.3 温度对核桃蛋白酶解液脱色效果的影响
温度对核桃蛋白酶解液脱色效果的影响如图7所示。随着温度的升高,酶解液的脱色率呈先上升后下降的趋势,而蛋白回收率则呈下降的趋势。这是由于温度升高可使酶解液的粘度降低,有利于色素物质的扩散,从而与活性炭充分接触,增强脱色的效果。但温度继续升高(>50 ℃)不利于物理吸附,脱色率随之下降[19]。综合考虑蛋白回收率和脱色率,选择脱色温度 45 ℃进行优化实验。
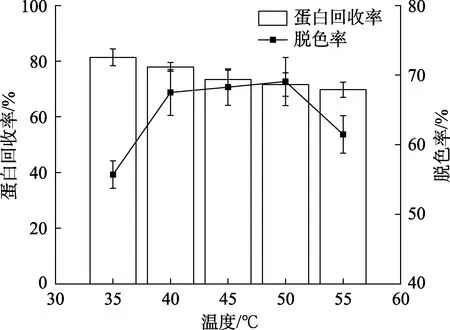
图7 温度对核桃蛋白酶解液脱色效果的影响Fig.7 Effect of incubating temperature on decolorization of WP hydrolytes
2.4.4 时间对核桃蛋白酶解液脱色效果的影响
时间对酶解液脱色效果的影响如图 8所示。随着脱色时间的延长,脱色率逐渐增大,蛋白回收率则逐渐减小。当脱色时间为75 min时,脱色效果较好,且蛋白回收率也相对较高。因此选择脱色时间为75 min进行下一步实验。
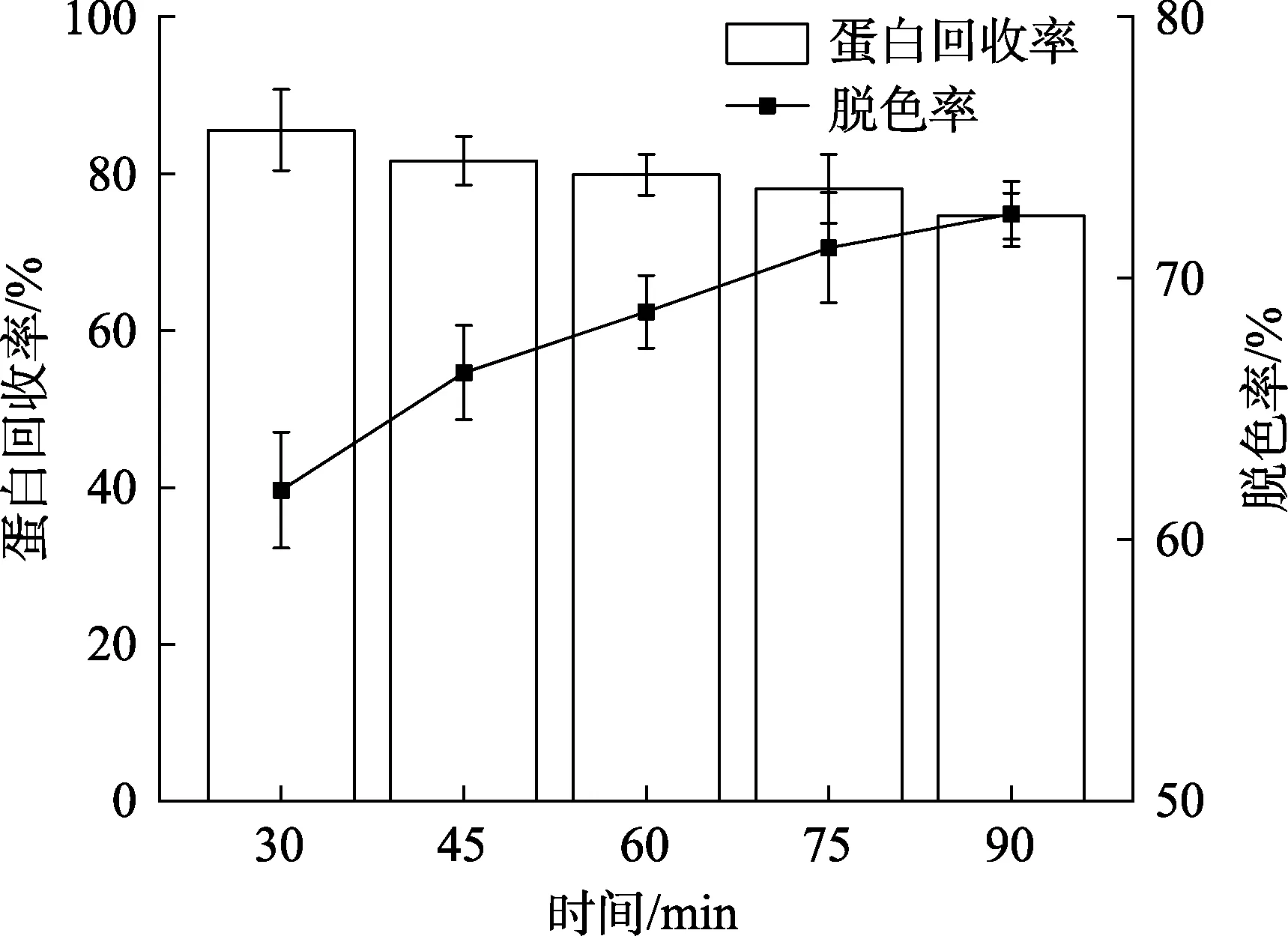
图8 时间对核桃蛋白酶解液脱色效果的影响Fig.8 Effect of incubating time on decolorization of WP hydrolytes
2.5 正交实验优化核桃蛋白酶解液的脱色工艺
核桃蛋白酶解液脱色正交实验的结果和直观分析如表5所示。影响核桃蛋白酶解液脱色率的各因素主次顺序为C(pH) > B(活性炭用量) > A(时间) > D(温度),最高脱色率的工艺为A3B2C1D3,即pH为3.0,活性炭用量为1.2%(W/V),温度为50 ℃,脱色时间为90 min。影响核桃蛋白酶解液中蛋白回收率的各因素主次顺序为 C(pH) >B(活性炭用量) > D(温度) > A(时间),最高蛋白回收率的工艺为A1B2C3D1,即pH为5.0,活性炭用量为 1.2%(W/V),温度为 40 ℃,脱色时间为60 min。对加权综合评分影响的主次顺序为B(活性炭用量) > C(pH) > A(时间) > D(温度),最佳综合评分组合为A3B2C2D2,即pH为4.5,活性炭用量为 1.2%(W/V),温度为 45 ℃,脱色时间为90 min。为避免偶然因素造成误差,对加权综合评分的最佳实验条件进行验证,测得脱色率为78.05%,蛋白回收率为82.16%,加权综合评分为80.11,说明 L9(34)正交实验优化的核桃蛋白酶解液最佳脱色工艺准确可靠。
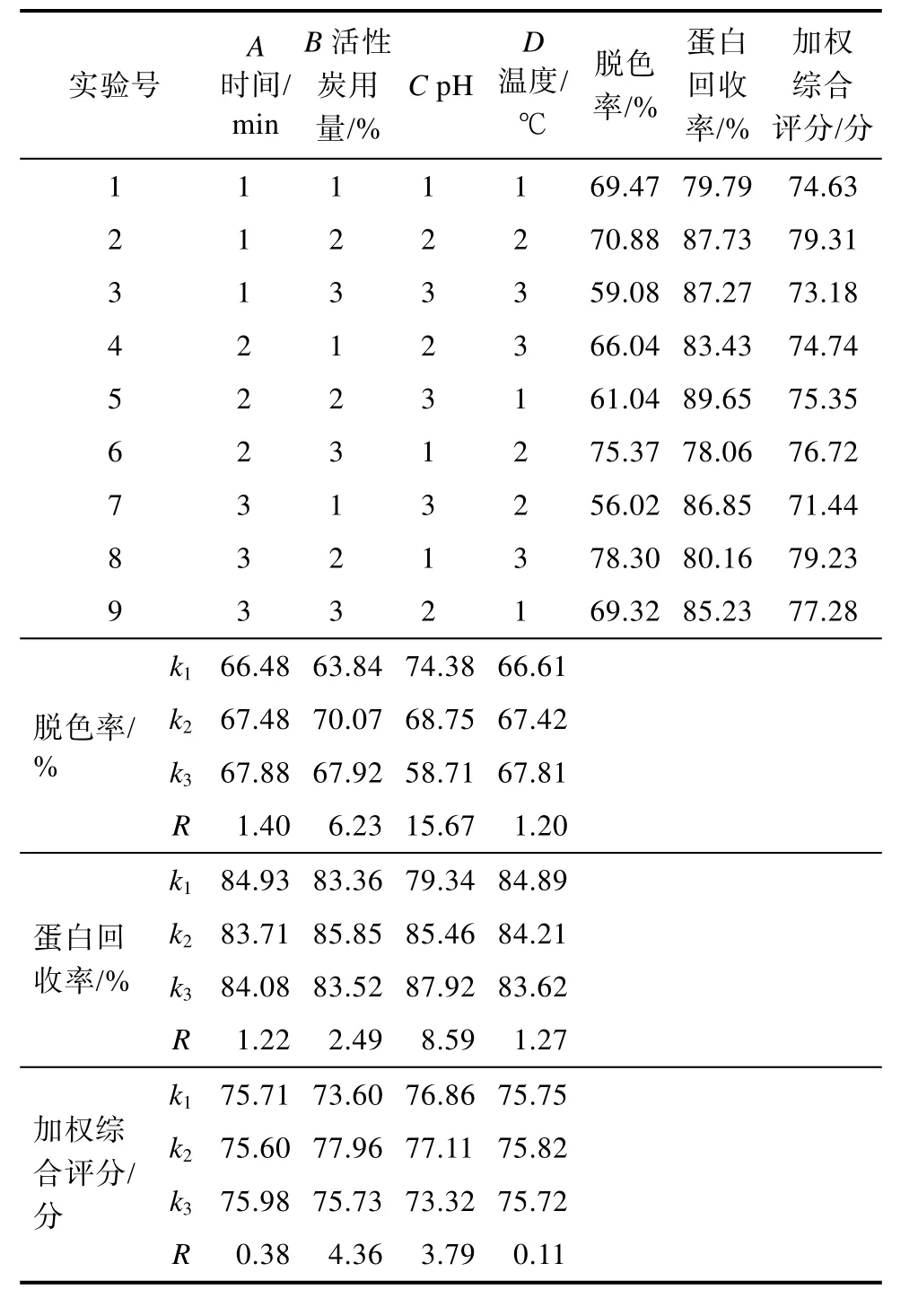
表5 核桃蛋白酶解液脱色正交实验结果及分析Table 5 Results and analysis of decoloring orthogonal experiment of WP hydrolytes
3 结论
本文以水解度为考察指标,通过单因素和正交实验确定胰蛋白酶酶解核桃蛋白的最佳工艺为底物浓度 3%(W/V),温度 55 ℃,加酶量为6 250 U/g,酶解时间5.0 h,在此条件下核桃蛋白的水解度为21.08%。以脱色率和蛋白回收率的加权综合评分为考察指标,确定了活性炭对核桃蛋白酶解液脱色的最佳工艺条件为pH为4.5,活性炭用量 1.2%(W/V),温度 45 ℃,脱色时间为90 min,在此条件下脱色率为78.05%,蛋白回收率为82.16%,加权综合评分为80.11分。研究可为核桃饼粕中蛋白质的高值化利用提供一定参考。

