运动员冷环境暴露相关呼吸系统疾病的预防和治疗*
杨倩文,朱昱彦,边原,2,杜姗,2,童荣生,2,何霞,2,刘心霞,2
(1.电子科技大学医学院,成都 600054;2.四川省医学科学院·四川省人民医院/电子科技大学附属医院药学部·个体化药物治疗四川省重点实验室,成都 610072)
为了更好地进行体育赛事医疗保健,保障运动员身体健康,国际奥委会在2008年北京奥运会期间首次采集运动员的运动损伤数据。随后在2010年温哥华冬奥会上,国际奥委会损伤疾病监控系统(IOC injury and illness surveillance system)启用,扩展到疾病监测,迄今已用于多届奥运会。该系统监测数据显示,2010年温哥华[1]、2014年索契[2]和2018年平昌[3]三届冬奥会期间,运动员新发或复发疾病中,均以呼吸系统疾病占比最高;与夏季举行2012年伦敦奥运会[4]和2016年里约奥运会[5](2021年东京奥运会结果尚未见发表)相比,冬奥会的呼吸系统疾病占比明显更高。这可能与冬奥会运动员的冷环境暴露有关。体育运动中的冷环境一般指陆上温度低于12 ℃的环境,冬季项目的环境温度通常会更低[6]。低温下空气相对干燥,同样为相对湿度100%,20和37 ℃时吸入空气的含水量分别为18和44 mg·L-1[7]。通常情况下,人体吸入的空气流经鼻腔及咽喉(上呼吸道)进入气管和各级支气管(下呼吸道),可逐渐达到适宜的温度及湿度,满足人体呼吸需求。运动员在冷环境中运动时,通气量增加,大量吸入相对寒冷干燥的空气,导致气道降温和干燥,触发气道病理生理学改变,容易诱发运动相关呼吸系统疾病,包括上呼吸道感染(upper respiratory tract infection,URTI)、运动诱发支气管收缩(exercise-induced bronchoconstriction,EIB)、上气道咳嗽综合征(upper airway cough syndrome,UACS)和运动诱发性喉梗阻(exercise-induced laryngeal obstruction,EILO)等[8-9]。正确认识应对上述疾病有助于减少冷环境暴露对运动员的不良影响。笔者在本文拟对以上疾病的临床特点、流行病学、发病机制及防治策略进行概述。
1 冷环境暴露下的URTI
1.1发病机制 URTI是由各种病毒和(或)细菌引起的主要侵犯鼻、咽或喉部的急性炎症的总称,包括普通感冒、咽炎、鼻窦炎、流感和百日咳等。其病原体病毒占70%~80%,细菌占20%~30%。URTI是运动员中最常见的感染类型,在2009—2017年举办的共11届国际锦标赛报告的运动员疾病中,URTI发生率最高[10]。2018年平昌冬奥会期间,48%运动员因疾病就诊于奥运村综合诊所,其中绝大部分与URTI有关[11]。URTI在冬季多发,在运动员中亦如此[12],这可能与URTI病原体(如流感)的季节性变化[13]及因冷暴露引发的病理生理变化有关。冷环境下吸入相对干燥的冷空气,鼻道导气管受冷和干燥,黏液纤毛的清除能力降低,白细胞的吞噬作用下降,呼吸道对感染的防御能力减弱[14]。低温低湿度环境会增加URTI发生率佐证这一点[15]。NIEMAN等[16]研究指出,经常在高通气水平下锻炼的耐力运动员由于气道反复冷却和干燥,URTI的风险升高。
1.2预防方案 中度及以上的URTI会影响运动员在比赛中的表现[13]。URTI常具有传染性,积极预防非常重要。一般预防措施包括戴口罩,手卫生,注意良好的咳嗽礼仪和正确处置污染纸巾,避免过度训练综合征,避免共用个人物品及与感染者接触等[13],与本届冬奥会疫情防控相关措施要求一致[17]。此外,还应按规定接种疫苗,如流感疫苗,接种程序与一般人群一致。但需注意接种时间与下一场比赛尽可能有较长间隔,最大程度降低可能发生的不良反应对训练和比赛的影响,灭活疫苗的不良反应多在接种后2 d内发生,减毒活疫苗的不良反应多在接种后第10~14天发生。
1.3治疗策略 运动员URTI的治疗与普通人群类似。大多数为自限性病毒感染,7~10 d内恢复。但病程中的症状,如流鼻涕、喉咙痛、乏力、鼻塞、体温轻度升高和咳嗽会导致运动员感觉不适,甚至影响比赛发挥,可能需要对症使用改善症状的药物。另外,如果病原体为细菌或流感病毒,需要对因使用抗菌药物与抗流感药物。运动员用药有特殊的要求,需遵守世界反兴奋剂机构(World Anti-Doping Agency,WADA)的规定,关于运动员URTI治疗用药及注意事项见表1。冬季流感高发,应特别注意:对参与团体项目且有流感样疾病的运动员,应及时进行检测以指导对患病运动员及其队友的治疗;对于高度怀疑流感的运动员,在等待检测结果期间应进行抗病毒治疗;若检测阳性,应采取隔离措施;同时需对其密切接触者进行预防治疗。对确诊百日咳的运动员,推荐在抗菌药物治疗的最初5 d将患者隔离,其队友和教练应接受暴露后预防治疗[18]。
2 冷环境暴露下的EIB
2.1发病机制 EIB是指在运动期间或运动后发生的支气管收缩急性发作[19]。常见于哮喘患者,多达90%哮喘患者存在一定程度的EIB[20]。通常发生于运动期间或运动后的15 min内,并在60 min内自发缓解,主要表现为呼吸急促、胸闷和咳嗽[19]。普通人群EIB的患病率为5%~20%[21],而精英运动员中EIB的患病率为30%~70%,且随运动强度和环境而变化[19]。在冰球、越野滑雪和滑冰等冬季项目运动员中,EIB的患病率较高[22]。以相同强度进行运动时,冷环境中运动后EIB的发生率高于室温环境[23]。这可能与冷环境中运动导致下气道负荷增加有关[24]。人体平静呼吸时,上呼吸道的调节作用可使吸入空气到达下呼吸道前基本调节至合适的温湿度,下呼吸道负荷较小。而在冷环境下运动时由于吸入大量冷干空气,气道温度和湿度下降明显,下呼吸道也需参与调节,散热量和失水量增加,内衬液渗透压增大,引发炎症反应和支气管血流量变化,诱发支气管平滑肌收缩[24]。基于该机制对运动过程中吸入的空气进行预热和加湿,可使EIB发生程度减轻[25]。所以,美国过敏、哮喘和免疫学会将运动员在干燥或寒冷的空气中进行超过5~8 min的运动均列为EIB高风险运动[19],即冬奥会多个项目都是EIB高风险运动。
2.2预防方案 短效β2受体激动剂(short-acting beta-agonist,SABA)是预防EIB的一线药物,在运动前15 min使用,5~7 min内迅速起效,持续时间2~4 h[19-20]。但重复和(或)长时间使用β2受体激动剂,可使气道平滑肌和肥大细胞上的β2受体下调,诱发耐受。因此,对需要每日规律使用SABA预防EIB的患者,推荐同时使用吸入性糖皮质激素(inhaled corticosteroid,ICS)或换用白三烯受体拮抗剂(leukotriene receptor antagonists,LTRA)[19-20,26]。ICS虽然没有即刻的抗EIB保护作用,但可改善气道高反应性,并能在数周至数月内减小支气管收缩程度[27]。LTRA并非对所有患者有效,但在大部分患者中能减少EIB并帮助恢复至基线水平,且运动后的恢复加快,长期使用也不会产生耐受性[28]。孟鲁司特半衰期较长,单剂给药预防作用可持续24 h,应至少在运动前2 h使用,以获得最大保护效应。在患有EIB的哮喘运动员中,使用ICS和LTRA有助于改善哮喘整体控制,减少EIB发生[29]。对不能耐受SABA不良反应(如紧张和心率加快)的运动员,可尝试采取以下措施来预防EIB:①减少使用剂量(可能效果不够);②使用带储雾罐的吸入器减少药物口腔沉积;③换用LTRA;④换用左旋沙丁胺醇,对β2受体选择性更高,代谢更快,不良反应更小;⑤换用抗胆碱能药物异丙托溴铵,该药相对于安慰剂能减少第1秒用力呼气容积(forced expiratory volume in one second,FEV1)的下降,但效果不如SABA[30]。⑥另外,运动前热身,戴口罩,避免吸入冷空气、污染物和刺激物等对EIB也有预防作用[19,26]。

表1 运动员URTI治疗用药及注意事项
2.3治疗策略 除用于预防外,SABA也是快速缓解EIB的一线治疗药物,对所有出现EIB的患者都可使用SABA迅速缓解症状[19-20,26]。长效β2受体激动剂(long acting beta agonist,LABA)也能提供短期的EIB控制效应,但同样容易耐受,会降低运动和比赛中支气管保护效应持续时间。因此不推荐定期使用LABA作为EIB的单药治疗,除非与ICS联合用于治疗中度至重度持续性哮喘[19]。在运动员中推荐每日使用ICS控制性治疗EIB[19,26]。对精英运动员和在极端条件下(如非常寒冷、干燥的空气)训练的运动员,联合SABA与LTRA预治疗可能比单用任意一种有效[31]。另外有研究显示,在越野滑雪运动员中,吸入性异丙托溴铵相比吸入性沙丁胺醇可以更好地改善FEV1[32]。需要注意的是,以上措施无法避免突破性EIB的发生,因此EIB运动员需要备有SABA以快速缓解突破性EIB或紧急症状[19]。关于饮食干预,如增加膳食ω-3脂肪酸和维生素C摄入,在EIB治疗中的作用目前尚无定论[33-34]。
WADA于2022年1月1日实施的最新规定中,对沙丁胺醇和糖皮质激素的使用进行修订[35],运动员EIB的治疗需要遵守相关规定,必要时申请治疗用药豁免(therapeutic use exemptions,TUE),具体见表2。
3 冷环境暴露下的UACS和EILO
咳嗽是运动员最常见的呼吸道症状之一[36]。UACS、EILO与URTI、EIB均为运动相关咳嗽的常见病因[36]。有研究调研698名不同领域的运动员,结果显示15.2%运动员存在运动相关咳嗽[37]。与运动相关的咳嗽在耐力运动员中更为普遍,尤其是冬季项目运动员[36]。2021年国际奥委会正式将登山滑雪列为2026年米兰冬奥会项目。此前在意大利举行的国际登山滑雪比赛中,超过一半的运动员在比赛中出现咳嗽[38],研究者认为这与运动员过度通气摄入大量干冷空气有关。运动相关咳嗽还表现出季节差异:TURMEL等[39]评估53名耐力冬季项目运动员和33名非运动员在不同季节的运动相关咳嗽发生情况。结果显示:停止运动后1 h内的咳嗽发生率,运动员组明显比非运动员组高(54%vs.3%,P=0.02);且运动员组咳嗽发生率,冬季高于夏季(71%vs.44%,P=0.04)。研究者认为这可能与冷空气吸入时,气道咳嗽受体及效应因子对气道水热流失及渗透压变化的敏感性增加有关;另外冷空气吸入还可诱发神经源性炎症反应,刺激速激肽和激肽分泌,导致咳嗽反应[39]。
UACS包括引起咳嗽的所有上呼吸道异常,有多种病因,包括过敏性鼻炎、非过敏性鼻炎、血管运动性鼻炎、急性鼻咽炎和鼻窦炎[37]。在运动员中,过敏性和非过敏性鼻炎相关UACS较为常见。在对10 328名运动员进行16项横断面研究中,鼻炎患病率高达41%[40]。鼻炎在冷环境暴露项目运动员中的患病率更高,几乎一半的滑雪者都有鼻炎[41]。过敏性鼻炎相关UACS治疗的首要任务是避免或减少刺激物或过敏原的暴露。鼻用糖皮质激素(glucocorticoid,GC)是过敏性鼻炎症状的最有效治疗,对非过敏性鼻炎也有效。对于过敏性鼻炎所致咳嗽患者,鼻用GC一般在使用的头几日内就能有效减轻咳嗽,但可能需要长达2周才能实现最大疗效。如果患者对治疗有反应,则治疗需再持续约3个月。运动员鼻炎的其他治疗药物还包括抗组胺药,吸入鼻抗胆碱能药物、LTRAs[36-37]。其中抗组胺药,尤其是第一代抗组胺药可能导致嗜睡,影响运动表现,需谨慎使用。必要时抗组胺药可与局部减充血剂伪麻黄碱联合使用。但需要注意的是,伪麻黄碱尿中浓度>150 μg·mL-1时被WADA禁用[35,37]。
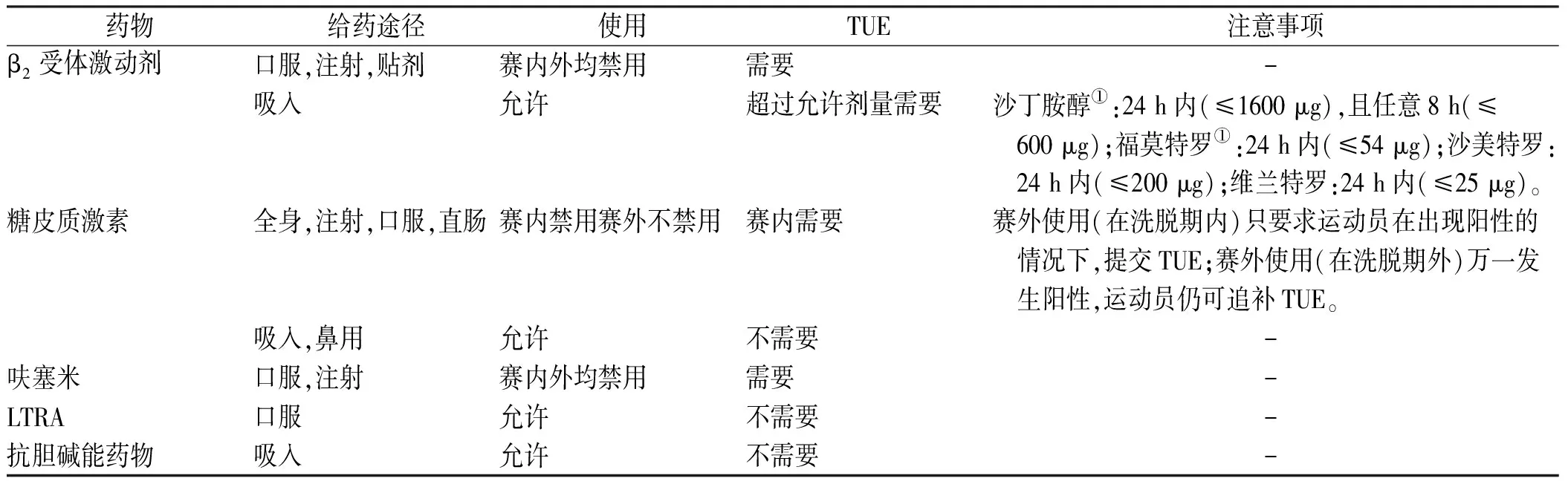
表2 EIB治疗药物的使用情况及TUE事项
EILO指运动时发生在声门(声带)或声门上(声门以上)水平的喉气道狭窄,是青少年和青年运动员中的常见病[42]。言语-行为治疗是EILO的一线治疗,无效可使用运动时治疗性喉镜。目前关于EILO的药物治疗尚缺乏明确证据。但EILO往往合并共存疾病如胃食管反流病(gastroesophageal reflux disease,GERD),对GERD进行治疗可能改善EILO相关症状。UACS和EILO相关治疗药物及注意事项参见表3。

表3 UACS和EILO治疗药物的反兴奋剂现状及注意事项

续表3 UACS和EILO治疗药物的反兴奋剂现状及注意事项
4 结束语
冬季项目运动员常暴露在冷环境下训练和比赛,容易诱发多种运动相关呼吸系统疾病,如URTI、EIB、UACS、EILO等,处理不当可能影响运动员健康状况、训练能力和运动成绩。对此提高认识,科学预防和合理治疗,有助于运动员备赛参赛过程中减少相关疾病的发生,优化健康状况,提升运动表现。国家统计局2022年1月12日发布的《“带动三亿人参与冰雪运动”统计调查报告》显示,我国已实现 “带动三亿人参与冰雪运动”的目标,居民参与率达24.56%。随着2022年北京冬奥会的召开,将会兴起“冰雪热”,有更多人参与冰雪运动。本文总结的防治策略,对一般人群在享受冰雪运动的同时预防冷环境暴露相关呼吸系统疾病也有一定的借鉴意义。

